药品(中成药)安全性监测报告核心要素的探讨
王桂倩+廖星+谢雁鸣
[摘要] 针对当前药品(中成药)安全性监测报告规范存在的问题,制定安全性监测报告规范的核心要素,提高有关中成药安全性监测研究报告的质量,提供完整、准确和透明的报告,该研究对药品安全性监测的核心要素进行了探讨。按照由国际EQUATOR网工作组制定的健康研究报告指南中规定的国际上比较公认的报告规范制定的方法和程序进行,基于团队长期开展的中成药安全性医院集中监测工作经验,参照WHO、欧盟、美国等药品安全性监测的不良反应报告表和国际上公认的报告规范中有关药品安全性的内容,形成药品安全性监测报告规范核心要素初稿,听取采纳专家论证修改意见和实际工作中的应用,最终制定出药品安全性监测报告核心要素“DPSDQAS”,共包括7个条目,D为drug监测中成药,P为population监测人群、S为setting监测机构,D为design监测设计,Q为quality监测质量控制,A为adverse监测中成药的不良反应/不良事件,S为statistics监测中成药的统计分析。该核心要素需要更多专家形成共识意见,并在更多药品安全性监测研究中使用得到完善。
[关键词] 中成药;医院集中监测;报告规范;核心要素
[Abstract] Studies on post-marketing drug surveillance have become increasingly important in recent years. In particular,many researchers for traditional Chinese medicine have paid more attention to the safety of post-marketing Chinese patent medicines. Observational studies,like cohort study,registry study,and intensive hospital monitoring,were conducted to collect data on safety information. How to accurately report and assess these studies and let readers to completely understand relevant published reports and obtain transparent information about its methodology and findings remain unsolved. According to the reporting guidelines made by EQUATOR,our research team drafted a framework based on a four-year study by reference to relevant rules,guidelines and standards all over the world in the field of drug safety evaluation. Besides,we consulted relevant experts in this field and formed a framework on how to report post-marketing safety studies of Chinese patent medicines. There were seven core components,namely drug,population,setting,design,quality,adverse reaction and statistics,which could be abbreviated to DPSDQAS. We introduced the framework here to provide reference for future researchers.
[Key words] Chinese patent medicine;intensive hospital monitoring;report specification;core element
doi:10.4268/cjcmm20162402
为了提高药品的安全性,2011年卫生部发布了新修订的《药品不良反应报告和监测管理办法》,指出要“引入重点监测制度,加强不良反应监测和研究工作”[1]。其中第六十三条有明確规定“药品重点监测是指为进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动”[2]。
医院集中监测[3]是指在时间(数月或数年)、范围内对某一医院或地区内所发生的ADR及药物利用作详细记录,并计算相应的ADR发生率,探讨其危险因素,医院集中监测方法收集的病例资料详尽,数据准确、真实,可对ADR发生规律进行归纳总结,能为临床用药安全性问题的预防和处理提供参考。
本团队承担了国家“重大新药创制”科技重大专项“中药上市后再评价关键技术研究”项目,历时4年进行了10个中药注射剂的临床30万例人群的上市后医院集中监测,安全性集中监测完成后需要对药品安全性监测的结果及结论进行报告,虽然国际上有众多报告规范标准,但是专门针对药品安全性监测的报告规范未有发表。药品安全性集中监测属于观察性研究,国际上推出了观察性流行病学研究的报告指南STROBE声明[4-5],但与药品安全性监测的报告存在差异。
为了提高监测报告的质量,本研究以中成药的安全性监测研究报告要素探讨为范例,以期为未来药品安全性监测研究的报告提供借鉴和参考。
1 报告规范核心要素形成的研究方法
本研究按照由国际EQUATOR网工作组制定的guidance for developers of health research reporting guidelines[6]指南规定的国际上比较公认的报告规范制定的方法和程序进行。
参照了WHO[7]、欧盟[8]、美国[9]、英国[10]、澳大利亚[11]等药品安全性监测的不良反应报告表如报告人的信息、患者的信息、怀疑的药品、怀疑的不良反应、说明所发生不良事件严重性的足够证据以及国际上FDA发表的良好药物警戒规范与药物流行病学评估指南中的[12]新的、标签未标示的严重不良事件、已知不良事件其严重或发生案例显著增加、新的药品相互作用、特定族群使用的安全性问题、药品名称标示易混淆问题、不同处方行为导致的问题等;欧盟药品管理局制定了《药物警戒实践指南》中研究方案的主要修订[13];人用药品注册技术要求国际协调会议着重参考了ICH E2B[14-15]共包括两大部分,报告管理及鉴别信息和部分病例信息组成;CARE guidelines[16] ;《中药不良反应/不良事件报告规范建议》[17];GRACE准则[18-19];2011年卫生部颁布《药品不良反应报告与监测管理办法》[20];国家药品安全监管司发布的《药品定期安全性更新报告》[21];不良反应病例报告表(CIMOSI reporting form)[22]推荐不良反应按其发生率分为十分常见、常见、少见、偶见、罕见、十分罕见6级;世界卫生组织不良反应术语集(WHOART)[23]规范不良反应术语等众多国际国内的报告规范中有关安全性的方面,同时基于团队长期开展的中成药安全性医院集中监测工作经验,对安全性报告规范核心要素进行了编排起草。
经过了多次专家论证会,包括方法学、流行病学、药理学、中药学、临床研究和统计学等方面的专家。
核心要素起草后,进一步征求专家组成员的意见和建议,经过4次论证修改,最后达成了一致意见,确定了药品安全性监测报告核心要素的内容。
2 中成药安全性监测报告规范的核心要素
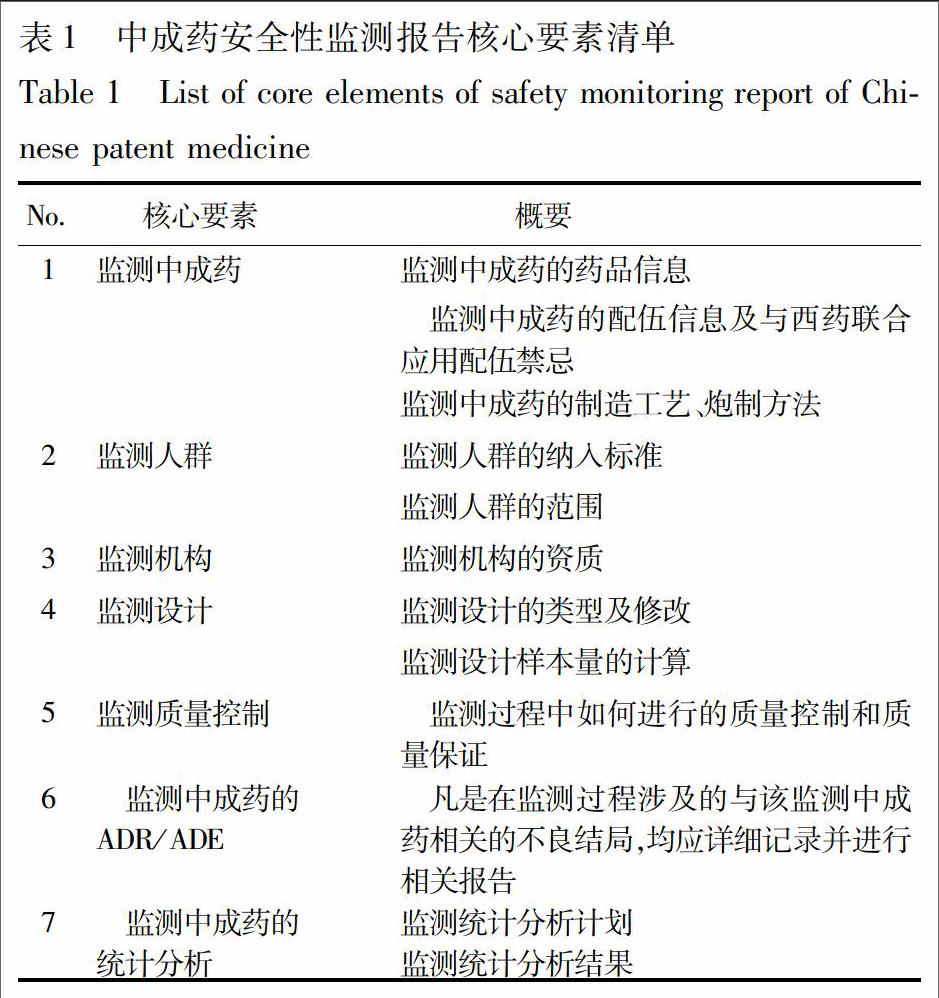
以下为药品(中成药)安全性监测报告核心要素建议条目,共包括7个核心要素和12个概要,见表1。
2.1 监测中成药
中成药出现安全性的问题有多种原因,如组方复杂、成分复杂、机制复杂、综合效应、蓄积毒性、需要个体化用药、联合用药等,虽然许多中成药在上市前进行了基础及临床研究,在安全性方面仍存在很多问题,所以对于重点监测的中成药,应该明确所监测中成药的详细信息。
2.1.1 监测中成药的药品信息 所监测中成药的名称、生产厂家、生产批号、中成药说明书(药物组成、功能主治、用法用量、化学成分、性状、药理作用、相互作用、不良反应、禁忌症、注意事项、原生药含量)、用药适应证、批准文号,以全面了解监测中成药的情况。
研究发现ADR的发生与生产厂家、批号,其他中成药联合使用及不规范操作有一定的关系,所以应该详细介绍监测中成药的药品信息。
2.1.2 监测中成药的配伍信息 介绍所监测中成药的药物组成、方剂解析“君臣佐使”、升降沉浮药性,以期预测可能出现的不良反应,如对于活血破瘀药力较猛,血虚经闭者不可使用,孕妇禁服。
阐述监测中成药与其他西药的联合用药情况及联合用药禁忌,如麻黄及其制剂不宜与单胺氧化酶抑制剂等合用,因麻黄素可使贮存于神经末硝中的去甲肾上腺素大量释放,当它与单胺氧化酶抑制剂等合用时,使血压升高,严重时可致高血压危害,甚至死亡。
2.1.3 监测中成药的制造工艺和炮制方法 炮制可以使药材提高药效、降低毒副作用。考虑到某些中成药出现不良反应可能与制造工艺、炮制方法不当有关,如生半夏有毒,而经炮制后的法半夏则毒性大减或甚微。但炮制不当则留毒可增加,其他如马钱子、附子、巴豆等均与炮制有关。
2.2 监测人群
监测中成药的安全性信息主要是从所监测人群临床用药前后的病情严重程度、症状体征和各种实验室检查指标的前后变化反映出来,所以监测人群的定义选择也十分重要。
监测人群为在规定的监测机构(名称、地点)且在规定的监测时间范围内,至少使用了1次监测中成药,无论用药时间长短,都作为被监测人群。
纳入时不比较监测人群的条件比如病情的轻重等,研究属于观察性研究治疗上不施加干预,只是记录监测人群用药前后的病情、有无不良反应等方面的变化。
监测人群应阐述是使用所监测中成药的普遍人群监测或和特定人群监测。特殊人群包括老年、兒童、妊娠及哺乳期妇女、肝肾功能不全人群等,其机体功能及体内药物代谢、排泄功能与正常人不同,某些药品用于特殊人群可能存在更高的风险,要对特殊人群的剂量疗程有所规定,特殊人群的用药安全是安全性监测的重要内容。
2.3 监测机构
中成药安全性监测是由国家食品药品监督管理总局或者生产所监测中成药的企业发起的主动监测,不同于真实世界研究,应该选择在地域、医院性质、规模大小有代表性的二级及二级以上资质的医疗机构作为监测医院,如有必要可以采取多级整群抽样的方式选择监测医院。
选择的监测机构首先必须通过国家食品药品监督管理总局和卫生部共同制定的《药物临床试验机构资格认定办法(试行)》[24]并得到药物临床试验机构的资格认定。
选择二级及二级以上的医院考虑的是具有与承担药品安全性监测相适应的诊疗技术能力;具有防范和处理药品安全性监测中突发事件的管理机制和措施;具备开展监测所需要的病房、门诊、专用资料储存柜等硬件条件;具备具有医学或药学背景的监测中心负责人、主要监测者、数据录入员、质量控制员且可以熟练掌握监测方案。只有具备了这样的资质才能参与临床监测,保证临床安全性监测的质量。
2.4 监测设计
2.4.1 监测设计的类型 药品安全性监测虽然有时候是政府监管行为,但也可以涉及临床研究行为,如果从研究层面来讲,科学而合理的监测设计,是提高临床监测结果真实性的关键。
一般用于药物安全性评价的研究设计,多为临床流行病学中的观察性研究。例如,对于队列研究,应指出研究设计的类型,描述组成队列的各组人群及其暴露状态;对于病例对照研究,描述病例和对照及其源人群;对于横断面研究,报告人群和调查的时间点。另外,有时候根据实际需求,如对于罕见的过敏反应机制的研究,会采用一些特殊的设计类型,如巢式病例对照研究。
2.4.2 样本量的计算 样本量的估算是研究设计中的基本要素之一。临床研究中保证研究对象具有足够的数量,对提高临床研究结论的真实性和外推性具有重要的意义。
一般中成药可按照《生产企业药品重点监测工作指南》[25]的要求进行。前瞻性、多中心、大样本医院集中监测,如果監测中成药ADR背景发生率未知,需根据公式计算样本含量。比较简单的算法是参考国际通用“三例原则”。在实际监测研究中,可以根据自身研究设计的需要灵活确定样本量[26]。
2.5 监测质量控制
与所有临床流行病学研究一样,药品安全性监测研究过程中也存在随机误差与系统误差,只有进行严格的质量控制,才能确保试验记录和报告数据准确、完整、可信。团队在10 种中药注射剂临床安全性医院集中监测的工作中,发现存在许多质量控制不佳的问题[27],如监测单位存在遗漏监测病例,未上报不良事件,仅上报不良反应,电子数据上报滞后或者数据录入错误,一级质量控制力度不足的问题,部分监测单位的一级质量控制计划、报告等材料过于简化,且检查频率过低的问题,所以必须进行严格的质量控制,各个环节遵守临床试验SOP。同时报告监测过程中遇到的问题及其处理措施。
加强监测实施过程的质量控制是保证数据真实准确的关键环节,也是监测的重点及难点。因此,科研工作者必须强化质量控制的意识,遵循药物临床试验管理规范,在此基础上抓住医院集中监测质量控制的特点才能确保试验记录和报告数据准确、完整、可信。
2.6 监测中成药的不良反应/不良事件(ADR/ADE)
作为药品安全性监测来讲,监测的主要结局是不良反应和不良事件的发生。因此,凡是在监测过程涉及的与该监测中成药相关的不良结局,均应详细记录。不利反应/不良事件的报告可以从以下几个方面进行。
2.6.1 规范不良反应术语集 根据WHOART术语集规范不良反应术语,药品不良反应术语集将不良反应报告的术语进行医学上有意义的分组汇总并使其标准化,有利于药品不良反应信息数据的准确采集和进一步数据分析。
2.6.2 记录ADR/ADE发生过程 ADR/ADE发生特征、发生过程,尤其要注意ADR发生时间、采取措施干预ADR的时间、ADR终结的时间。第一次药品不良反应出现时的相关症状、体征和相关检查;药品不良反应动态变化的相关症状、体征和相关检查;发生药品不良反应后采取的干预措施结果。发生ADR/ADE患者的详细信息,报告人的信息。不良反应发生时的处理措施、处理情况、处理结果。
2.6.3 提供ADR/ADE实验室检查证据 提供ADR/ADE检查证据,最好是实验室指标,具有客观性,便于日后认定查询。
2.6.4 报告不同程度以及不同类型的ADR/ADE 报告新的不良反应、严重不良反应、特殊病例分析。
2.6.5 ADR/ADE关联性评价过程 关联评价标准、三级关联评价(报告单位、省级、国家ADR监测中心)过程,这有利于客观、透明化展现ADR因果关联判读过程。
2.6.6 ADR/ADE发生率及分级 ADR/ADE发生率、报告根据国际医学科学组织委员会(CIOMS)推荐不良反应的分级。
2.6.7 特殊类型ADR/ADE的特征 如报告发生过敏反应的特征,机制研究,过敏反应的预防与处理措施、处理情况、处理结果。
2.7 监测中成药的统计分析
统计分析是临床研究的关键环节,正确的统计分析方法,合理的统计分析流程及严谨的统计分析结果是统计分析过程必须遵循的原则,也是保证临床研究结论可靠性、科学性的基础之一。
2.7.1 统计分析的步骤 统计分析首先要进行所监测人群的描述性统计分析,再进行深入分析如所监测中成药的联合用药情况,监测中成药发生不良反应的危险因素等。所有分析过程均需报告采用何种统计方法。
2.7.2 统计分析内容 分清基于监测目的所进行的统计分析和因数据驱使的分析。比如完成预先确定的针对主要研究目标的分析(基线特征,主要监测指标和次要监测指标,ADR/ADE相关因素分析);此外可做相关探索性分析。
2.7.3 缺失数据的处理 研究中缺失数据,应报告各变量、各分析步骤上缺失值的数量,对于缺失值的填补和分析方法,说明其原理和假定进行描述。
2.7.4 混杂因素的处理 安全性监测研究中存在众多混杂因素,有可能是药物的使用剂量、合并用药、合并疾病、入院病情等,为了平衡混杂因素,应用何种统计分析方法进行处理。
2.7.5 敏感性分析 如果采用了敏感性分析,则应报告敏感分析的结果和目的。
通过报告上述统计方法,读者才能更好的理解监测过程中数据的可靠性及监测结果的精确度。
通过对中成药安全性监测,可以对该药品的效益风险评估有更深刻的认识。如果效益风险评估的结果是效益大于风险时,可以采取修改完善说明书的方法,为临床用药提供更完善的数据,包括在药品说明书中补充新的信息,如不良反应、禁忌症、警告、注意事项、药物相互作用等;限制或修改适应症范围;对可能出现的不良反应的治疗建议。
与此同时,七大核心要素对于如何报告中成药安全性监测将起到良好的引导作用。使国家食品药品监督管理总局和药品生产企业更充分的认识所监测药品的安全性问题,进一步改善提高中成药质量,同时通过对中成药不良反应发生特征等研究,不良反应的发生有无规律性,为下一步风险评估提供依据。
3 药品安全性监测报告规范的价值展望
本团队对于具体报告中成药安全性监测的规范已经形成初稿,不日即将发布,希望通过这样一份基于实践经验和参考国内外相关报告规范以及法规的工作,能够有益于日后的药品安全性监测研究及监测报告的规范。
本药品安全性监测报告规范探讨了药品安全性监测报告所需系列清单,用于规范报告药品安全性监测中设计、实施、结果分析以及原始材料提供等,旨在能够全面、真实、清楚、准确报告药品安全性监测,进而促进药品安全性监测方法学质量。完整、准确和透明的监测报告有助于传播、解释、转化和重复,利于研究成果的推广应用,为临床实践和制定医疗卫生政策提供高质量的临床证据。
[参考文献]
[1] 颜敏,兰奋,叶国庆. 《药品不良反应报告和监测管理办法》修订要点和释义[J]. 药物流行病学杂志,2011,20(6):273.
[2] 卫生部. 药品不良反应报告和监测管理办法[EB/OL]. (2011-05-04) [2016-05-31]. http://www. sda. gov. cn/WS01/CL0053/62621. html.
[3] Luis A,Garcia Rodriguez,Susanne Perez Guethann.Use of the UK general practice research database for pharmacoepidemiology[J].Br J Clin Pharmacol,1998,45(5):419.
[4] 孙凤,詹思延. 医学研究报告规范解读[M]. 北京:北京大学医学出版社,2015.
[5] Erik von Elm,Douglas G Altman. The strengthening the reporting of observational studies in epidemiology(STROBE) statement: guidelines for reporting observational studies[EB/OL]. [2016-03-30]. http://www. equator-network. org/reporting-guidelines/strobe/.
[6] Mother D,Schulz K F,Simera I,et al. Guidance for developers of health reasearch reporting guidelines[J]. PLoS Med,2010,7(2):el000217.
[7] Edwards I R.Spontaneous reporting-of what clinical concerns about drugs[J]. Br J Clin Pharmacol,1999,48:138.
[8] 田峰,謝雁鸣. 欧盟人用医药产品药物警戒体系译介[J]. 中成药,2010,12:2154.
[9] Shader R I,Greenblatt D J. MedWatch,the new FDA adverse effects reporting system [J]. J Clin Psychopharmacol,1993,13(5):303.
[10] 方素清.论英国黄卡制度对我国药品不良反应监测的启示[J]. 国际医药卫生导报,2006,12(23):100.
[11] 孙骏. 对比中澳药品不良反应报告处理方法给我省监测工作的启示[J]. 中国药物警戒,2005,2(2):111.
[12] US food and drug administration. Guidance for industry development and use of risk minimization action plans[EB/OL]. [2016-05-31]. http://www. rsihata. com/updateguidance/usfda2/bio1/ UCM071616. pdf.
[13] European medicines agency. Guidelines on good pharmacovigilance practices[EB/OL]. [2016-03-10]. http://www. ema. europa. eu/ema/index. jsp?curl=pages/regulation/document_listing/document_listing_000345. jsp.
[14] ICH. E2B:data elements for transmission of individual csae safety reports[EB/OL]. (2001-02-05) [2016-03-29]. http://www. fda. gov/downloads/drugs/guidance comlpiance regulatory information/guidances/ucm073093. pdf.
[15] 叶小飞,郭晓晶,赵璐,等. 个例安全性报告规范(ICH E2B)简介及应用[J]. 中国药物警戒,2012(3):149.
[16] Gagnier J J,Kienle G,Altman D G,et al.The CARE guidelines: consensus-based clinical case report guideline evelopment[J]. J Diet Suppl,2013,10(4):381.
[17] Wu Jasmanda,Juhaeri Juhaeri,Wang Lili. 美国与欧洲上市后药品安全风险管理进展概述[J]. 药物流行病学杂志,2014(4):19.
[18] Nancy A Dreyer,Sebastian Schneeweiss. GRACE principles: recognizing high-quality observational studies of comparative effectiveness[EB/OL]. [2016-06-22]. http://www. graceprinciples. org/grace-c. html.
[19] 谢雁鸣,廖星. 对比较效益研究GRACE准则的解析[J]. 中国中西医结合杂志,2012(8):1121.
[20] 国家食品药品监督管理局. 《药品不良反应报告和监测管理办法》(卫生部令第81号)[EB/OL]. (2011-05-04) [2016-03-28]. http://www. sda. gov. cn/WS01/CL0053/62621. html.
[21] 杨乐,任经天. 对我国药品定期安全性更新报告撰写规范主要内容的解读(一)[J]. 中国药物评价,2013(2):121.
[22] CLOMS working groups Ⅲ and Ⅴ. Guidetines for preparing core safety information on drugs [EB/OL]. [2016-05-31]. http://www.gbv.de/dms/bs/toc/350771871.pdf.
[23] Venulet J,Bankowski Z. WHO adverse reaction terminology[J]. Drug Safety,1998,19(3):165.
[24] 国家食品药品监督管理总局. 《药物临床试验机构资格认定办法(试行)》[EB/OL]. [2004-02-19]. http://www. sda. gov. cn/WS01/CL0058/9346. html.
[25] 國家食品药品监督管理局安监司. 《关于推动生产企业开展药品重点监测工作的通知(征求意见稿)》[EB/OL]. [2013-03-25]. http://www. sda. gov. cn/WS01/CL0778/79321. html.
[26] Wu Y Te,Makuch R W. Detecting rare adverse events in post-marketing studies: sample size considerations[J]. Drug Inform J,2006(40):87.
[27] 姜俊杰,谢雁鸣. 中药注射剂临床安全性监测质量控制指标的构建与实现[J]. 中国中药杂志,2015,40(24):4766.
[责任编辑 曹阳阳]

