注射用丹参多酚酸盐联合阿司匹林治疗稳定型心绞痛机制的生物分子网络研究
李园+王连心+谢雁鸣

[摘要] 該研究运用生物分子网络分析方法,预测注射用丹参多酚酸盐与阿司匹林联合用药治疗稳定型心绞痛的作用机制。从Genecards,STITCH,DisGeNET数据库获取注射用丹参多酚酸盐、阿司匹林及稳定型心绞痛(stable angina pectoris,SAP)的相关基因;采用Agilent Literature Search文献搜索软件构建生物分子网络;经AP,MCODE和MCL 3种方法对生物网络进行模块识别;通过DAVID软件进行相关KEGG通路识别。结果表明注射用丹参多酚酸盐和阿司匹林对SAP分子网络的覆盖率分别为45.92%,62.56%,联合用药的覆盖率为71.64%。注射用丹参多酚酸盐、阿司匹林与SAP前10个重要节点中,MAPK14,MAPK8,IL-6,IL-8为2个药物共同重叠的SAP重要节点,AKT1和IFNG为注射用丹参多酚酸盐单独重叠的SAP重要节点,EPHB2和TP53为阿司匹林单独重叠的SAP重要节点。2个药物共同参与的SAP相关信号通路包括JAK-STAT信号通路和MAPK信号通路等;注射用丹参多酚酸盐单独参与的SAP相关信号通路包括VEGF信号通路和1型糖尿病信号通路;阿司匹林单独参与的SAP相关信号通路包括AA代谢、亚油酸代谢信号通路等。该研究表明联合用药一方面在抗炎症反应和抑制动脉粥样硬化发展方面有疗效增强作用;另一方面注射用丹参多酚酸盐在阿司匹林抗血小板聚集的基础上能够保护血管内细胞和调节糖代谢,起到疗效相加作用。
[关键词] 注射用丹参多酚酸盐;阿司匹林;稳定型心绞痛;联合用药;生物分子网络;作用机制
[Abstract] Biomolecular network analysis was used to predict the mechanism of Salvianolate injection combined with aspirin for the treatment of stable angina pectoris(SAP). Related genes of Salvianolate injection,aspirin and SAP were obtained from Genecards,STITCH and DisGeNET databases. Agilent literature search software was used to construct biomolecular network;modules were identified by AP,MCODE and MCL methods. DAVID software was used for identification of related KEGG pathways. Results showed that Salvianolate injection and aspirin had a coverage rate of 45.92%,62.56% respectively for SAP molecular network,and the coverage rate was 71.64% in combined use. The top 10 important nodes of SAP overlapped with Salvianolate injection and aspirin included MAPK14,MAPK8,IL-6 and IL-8. The important SAP nodes overlapped with Salvianolate injection alone included AKT1 and IFNG,and the important SAP nodes overlapped with aspirin included EPHB2 and TP53. Related SAP signaling pathways with combined Salvianolate injection and aspirin included Jak-STAT signaling pathway and MAPK signaling pathway. Related SAP signaling pathways with Salvianolate injection alone included VEGF signaling pathway and type 1 diabetes signaling pathway. Related SAP signaling pathways with aspirin alone included AA metabolism,linoleic acid metabolism signaling pathway,etc. The results showed that Salvianolate injection and aspirin combination had an enhancement effect in treatment of SAP through anti-inflammatory reaction and inhibition of atherosclerosis development;in addition,the combination use may have an additive effect through the antiplatelet aggregation,protecting endothelial cells,regulating blood lipid and regulating glucose metabolism.
[Key words] Salvianolate injection;aspirin;stable angina pectoris(SAP);drug combination;biomolecular network analysis;molecular mechanism
doi:10.4268/cjcmm20162408
稳定型心绞痛(stable angina pectoris,SAP)是在冠状动脉固定性严重狭窄的基础上,由于心肌负荷增加引起心肌急剧、暂时性缺血与缺氧的临床综合征,是临床最常见的一种心绞痛[1]。阿司匹林作为目前应用最广泛的血小板药物,主要用于治疗冠心病心绞痛、心肌梗死等[2],同时也存在阿司匹林抵抗问题[3]。近年来,中西药联合应用治疗复杂疾病在临床取得了较好的疗效。前期在全国18家三级甲等综合医院信息系统数据仓库(hospital information system,HIS)中发现,14 191例使用注射用丹参多酚酸盐的患者中多与阿司匹林联合用药治疗冠心病[4-5],并有大量文献研究[6-9]证实注射用丹参多酚酸盐联合阿司匹林等常规西药治疗SAP疗效优于单纯西药治疗,并且没有发现明显的不良反应。注射用丹参多酚酸盐从活血化瘀类中药丹参中提取其水溶性有效成分制备而成,用于治疗SAP或中医辩证为心血瘀阻证的患者[10],具有活血、化瘀、通脉的作用,其中80%为丹参乙酸镁(magnesium lithospermate B,MLB/salvianolic acid B),其余20%包括迷迭香酸钠(rosmarinic acid,RA)、紫草酸镁(rosmarinic acid,RA)、丹参素钾、紫草酸二钾、丹参乙酸二钾等[10-11]。
生物分子网络强调用网络来表示药物、靶点和疾病之间的复杂关系。大多数复杂疾病并非由单个致病基因引起,而是多个基因或其产物功能紊乱所致调控网络失衡的结果[12]。中医药在治疗复杂疾病方面显示出了良好的效果,生物分子网络分析方法能够系统、综合地观察药物对疾病网络的干预与影响,进行“疾病-基因-药物”多层次网络的分析,为揭示联合用药、多分子药物协同作用于人体的作用机制提供了有效的研究方法[12-13]。因此,本研究基于生物分子网络的分析方法探索注射用丹参多酚酸盐联合阿司匹林治疗SAP的作用机制,从分子层面分析2个药物对SAP相关重要节点和信号通路的影响,为临床联合用药研究提供参考。
1 材料和方法
1.1 基因获取
将“aspirin”和注射用丹参多酚酸盐主要成分(“MLB/salvianolic acid B”,“RA”,“LA”)[10]设置为关键词,通过Genecards(http://www.genecards.org/)数据库和STITCH(http://stitch.embl.de/)数据库检索药物相关的种子基因。以“Homo sapiens”为背景,提取Genecard数据库中全部相关基因和STITCH数据库信度较高(>4.0分)的相关基因,并进行去重、统一名称等处理。将“angina,stable”设置为关键词,通过DisGeNET(http://www.disgene.org/web/DisGeNET/menu)数据库,以人类基因为背景,获取SAP相关基因。
1.2 分子网络构建
分别将数据库中检索到的注射用丹参多酚酸盐、阿司匹林和SAP的相关种子基因递交到安捷伦文献搜索软件(Agilent Literature Search 3.1.1)(http://www.chem.agilent.com/scripts/LiteratureSearch.asp),设置以人类基因为前提并限定交互词汇,选择通过全文进行文献搜索。通过发现文献中与种子基因有相互作用关系的基因,构建生物分子网络,并在Cytoscape_v3.2.软件平台对分子网络进行可视化加工和拓扑结构分析。
1.3 分子网络的模块识别
对注射用丹参多酚酸盐、阿司匹林和SAP的分子网络采用仿射传播聚类(AP)[14]、马尔可夫聚类算法(MCL)[15]和MCODE [16]3种方法根据网络中的基因聚類情况进行模块识别,比较3种方法识别结果熵值,熵值是对模块的离散程度进行判断的一个标准,熵值越小代表模块的离散程度越小,稳定性越高[17-18]。划分好的模块根据评分由高至低排序,每个模块由相互关联的基因聚类组成,评分越高表示该模块的显著性越高。
1.4 模块的生物功能注释
本研究采用DAVID Bioinformatics Resources 6.7(https://david.ncifcrf.gov/)软件的Functional Annotation Clustering 工具,分别对注射用丹参多酚酸盐、阿司匹林和SAP分子网络的主要模块进行GO功能富集分析,以人类基因为背景识别模块中显著富集的GO生物学过程和KEGG通路。为了检验模块中富集出的GO terms和KEGG通路是否具有统计学意义,DAVID软件初步采用Fisheris Exact Test计算出P(EASE score),再对富集分析得到的P进行Benjamini多重检验校正,最终认为校正后P<0.05的GO terms和KEGG通路为模块表达出的显著的生物功能和信号通路。
2 结果
2.1 分子网络构建
通过检索Stitch和Genecards数据库(2015年10月3日),发现注射用丹参多酚酸盐主要成分(MLB,RA,LA)的相关基因79个,阿司匹林相关基因498个。通过检索DisGeNET数据库(2015年10月4日),获得SAP的相关基因75个。
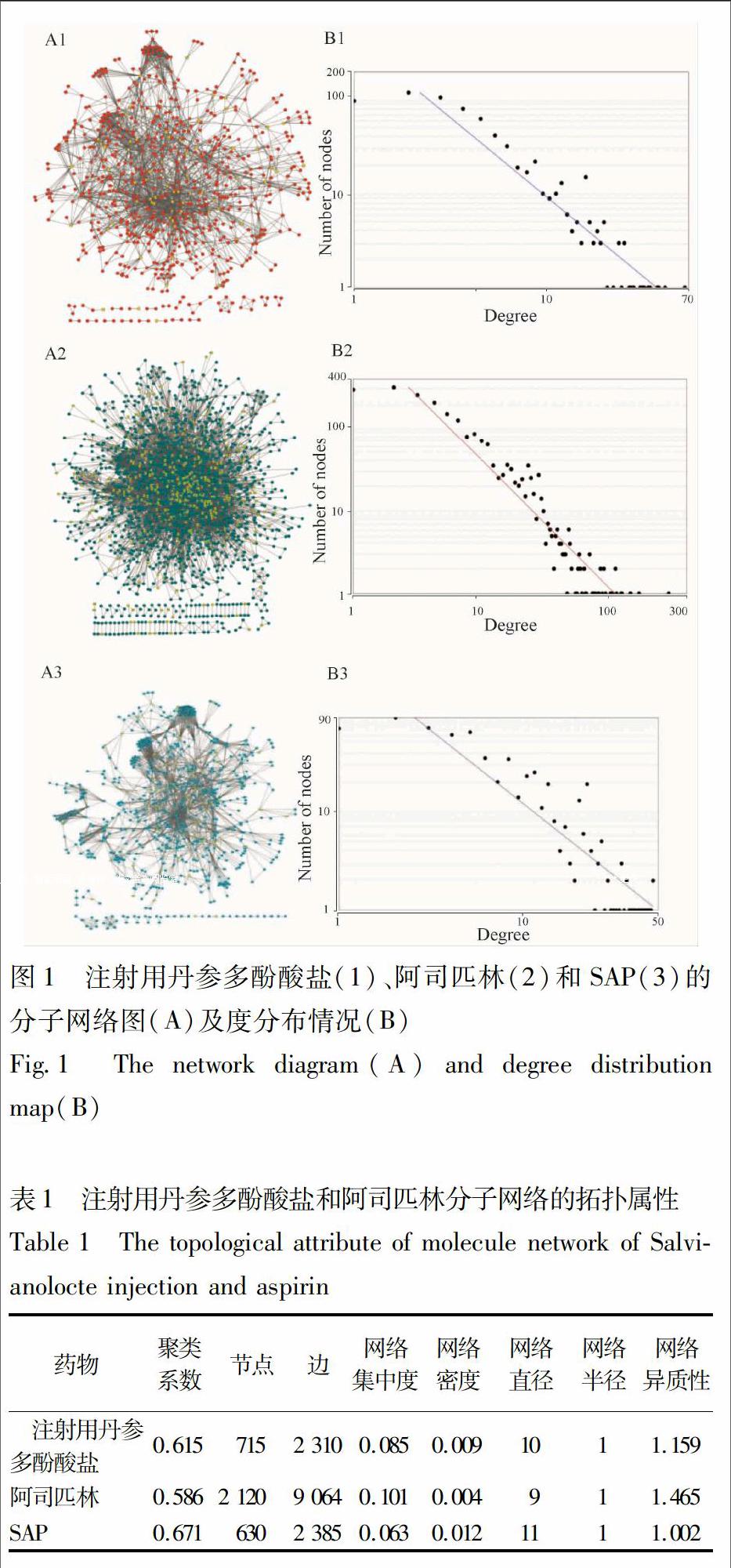
注射用丹参多酚酸盐的分子网络由715个节点和2 310条边构成;阿司匹林的分子网络由2 120个节点和9 064条边构成;SAP的分子网络由630个节点和2 385条边构成(图1)。拓扑结构分析发现,2个药物和SAP的分子网络节点度的分布均为遵循幂律分布特点的无尺度(scale free)网络(图1),注射用丹参多酚酸盐分子网络的聚类系数为0.615,网络半径为1,直径为10;阿司匹林分子网络的聚类系数为0.586,网络半径为1,直径为9;SAP分子网络的聚类系数为0.671,网络半径为1,直径为11(表1)。
2.2 模塊划分
比较AP,MCODE和MCL 3种模块识别结果,发现MCODE软件识别出的网络模块熵值最小,分别为5.607 8,6.629 6,5.707 99(表2)。MCODE方法识别结果为注射用丹参多酚酸盐分子网络的有61个模块,最大的模块由37个节点构成,最小的模块由3个节点构成(图2A);从阿司匹林的分子网络中识别出122个模块,最大的模块由112个节点构成,最小的模块3个节点构成(图2B);从SAP的分子网络中识别出40个模块,最大的模块由57个节点构成,最小的模块由3个节点构成(图2C)。
2.3 生物功能富集
2.3.1 注射用丹参多酚酸盐参与的KEGG信号通路 注射用丹参多酚酸盐相关KEGG信号通路有61条,其中39条为生物功能相关信号通路,前3位分别为免疫调节、信号转导和信号分子交互作用、细胞过程相关信号通路,其次还有内分泌调节、代谢作用、神经调节等相关信号通路(图3),如Toll样受体信号通路、JAK-STAT信号通路、MAPK信号通路、VEGF信号通路、胰岛素信号通路、红细胞色素P450代谢信号通路等;22条为疾病相关信号通路,其中前3位分别为肿瘤、内分泌疾病和代谢疾病、神经系统疾病相关信号通路(图4),如胰腺癌、1型糖尿病、2型糖尿病等信号通路。
2.3.2 阿司匹林参与的KEGG信号通路 阿司匹林相关KEGG信号通路有53条,其中42条为生物功能相关信号通路,分别为代谢作用、信号转导、免疫调节、细胞过程相关信号通路(图5),如AA代谢信号通路、亚油酸代谢信号通路、CAMs信号通路、JAK-STAT信号通路、Toll样受体信号通路、P53信号通路、MAPK信号通路等;11条为疾病相关信号通路,其中前3位分别为肿瘤、内分泌和代谢疾病、神经系统疾病相关信号通路(图6),如阿尔兹海默病、亨廷顿舞蹈病、帕金森病、小细胞肺癌等信号通路。
2.3.3 SAP的相关KEGG信号通路 SAP相关KEGG信号通路有65条,其中42条为生物功能相关信号通路,前3位分别为免疫调节、代谢作用、细胞过程相关信号通路,其次为信号转导、内分泌调节和神经调节相关信号通路(图7),如JAK-STAT信号通路、Toll样受体信号通路、NOD样受体信号通路、AA代谢信号通路、亚油酸代谢信号通路、ErbB信号通路、MAPK信号通路等;23条疾病相关信号通路中前3位分别为肿瘤、免疫系统疾病、神经系统疾病信号通路(图8),如非小细胞肺癌、胰腺癌、阿尔兹海默病、亨廷顿舞蹈病、帕金森病、1型糖尿病等信号通路等。
2.4 联合用药对SAP分子网络的覆盖情况
注射用丹参多酚酸盐与SAP分子网络的重叠基因有265个,对SAP分子网络的覆盖率为45.92%(图9a);阿司匹林分子网络与SAP分子网络的重叠基因有386个,对SAP分子网络的覆盖率为62.56%(图9b);联合用药能够覆盖SAP分子网络的442个基因,覆盖率为71.64%,其中2个药物共同覆盖基因209个,注射用丹参多酚酸盐单独覆盖基因56个,阿司匹林单独覆盖基因177个(图9c);2个药物联合可以覆盖SAP分子网络的的模块1和模块3(图9d)。
a.注射用丹参多酚酸盐对SAP分子网络的覆盖;b.阿司匹林对SAP分子网络的覆盖;c. 丹参多酚酸盐和阿司匹林对SAP的单独作用靶点;d.联合用药覆盖SAP分子网络的模块1(M1)和模块2(M2)。
2.5 联合用药对SAP分子网络重要节点的覆盖情况
分别对SAP、注射用丹参多酚酸盐、阿司匹林分子网络的节点度进行排序,注射用丹参多酚酸盐与SAP前10个重要节点中,重叠节点包括AKT1,IFNG,MAPK14,MAPK8,IL-6,IL-8,覆盖率为60%;阿司匹林与SAP前10个重要节点中,重叠节点包括EPHB2,TP53,MAPK14,MAPK8,IL-6,IL-8,覆盖率为60%;2个药物共同覆盖的SAP重要节点为MAPK14,MAPK8,IL-6,IL-8,覆盖率为40%;联合用药可覆盖8个节点,包括AKT1,IFNG,EPHB2,TP53,MAPK14,MAPK8,IL-6,IL-8,覆盖率为80%(表3)。
2.6 联合用药对SAP相关信号通路的覆盖情况
注射用丹参多酚酸盐参与了SAP分子网络的33条相关信号通路,将频次纳入计算,可影响SAP相关信号通路的64.62%(42/65);阿司匹林参与了27条相关信号通路,将频次纳入计算,可影响SAP相关信号通路的56.92%(37/65);2个药物联合能够影响44条SAP相关信号通路,以频次计算占SAP相关信号通路的86.15%(56/65)。
注射用丹参多酚酸盐和阿司匹林共同参与调节16条SAP相关信号通路,其中11条为生物功能相关信号通路(表4)。疾病相关的5条信号通路中,3条为肿瘤相关信号通路,免疫系统疾病和神经退行性疾病相关信号通路各1条。
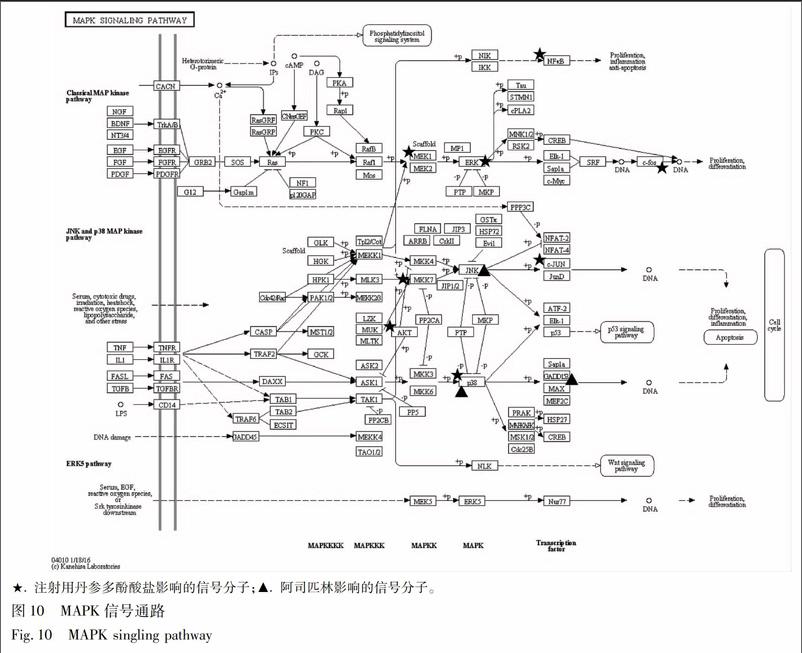
虽然2个药物都参与了这些信号通路的调控,但它们的调节途径不同,注射用丹参多酚酸盐和阿司匹林通过对不同信号分子的影响参与调控相关信号通路。注射用丹参多酚酸盐通过AKT1,MAPK1,FOS,MAP2K1,ARRB2,MAPK14,JUN,MAPK3,NFKB1基因,参与ERK,JNK,P38 MAPK 3个家族对MAPK信号通路的调节;而阿司匹林通过MAPK14,MAPK8,DDIT3基因,参与JNK和P38 MAPK 2个家族对MAPK信号通路的调节(图10)。
注射用丹参多酚酸盐单独参与的17条SAP相关信号通路中,P最小的前3条通路分别为VEGF信号通路、神经营养素信号通路和ErbB信号通路
(表5)。9条疾病相关信号通路中,包括8条肿瘤相关信号通路和1型糖尿病信号通路。
阿司匹林單独参与的11条SAP相关信号通路中,8条为生物功能相关信号通路(表6),以代谢作用相关信号通路为主,如AA代谢、亚油酸代谢信号通路。3条为疾病相关信号通路,分别为阿尔兹海默病、亨廷顿舞蹈病、帕金森病。
3 讨论
联合用药是指为了达到治疗目的而采用的2种或2种以上药物同时或先后应用[19]。联合用药的一种结果是增强疗效,即协同作用,协同作用又包括增强和相加2种效应;另一种结果是降低疗效,即拮抗作用;还有一种可能是引起不良反应,即产生毒副作用[19-21]。
3.1 联合用药治疗SAP的疗效增强作用
IL-6,IL-8,MAPK8和MAPK14是注射用丹参多酚酸盐和阿司匹林共同覆盖的SAP相关重要节点。IL-6和IL-8都属于白介素(interleukin,IL)家族分子,是2个重要的炎性标记物,有研究[22]观察血清IL-6和IL-8水平在正常人、SAP患者、心肌梗死(myocardialinfarction,MI)患者中的差异显示,结果显示SAP患者和MI患者的血清IL-6和IL-8水平均高于正常组,尤以MI组患者升高最为明显,
这一方面提示了IL-6和IL-8水平与血管动脉粥样硬化(atherosclerosis,AS)病变有关,另一方面提示了IL-6和IL-8的水平与血管阻塞程度和斑块稳定性有关。MAPK8和MAPK14都属于促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPKs)分子,对细胞中促炎性分子的表达有重要的调节作用[23-24]。研究显示,SAP患者血清中的MAPKs水平明显高于正常人[25],急性冠脉综合征患者血清中的MAPKs水平较SAP患者更高[25]。
炎症反应在SAP的发生、发展和预后过程中有重要作用,AS实质上是一种有免疫系统参与的慢性炎症反应过程[26-27]。注射用丹参多酚酸盐在基础研究[28-29]和临床研究方面[30-31],均有报道显示能显著降低血清内IL-6和IL-8的水平,抑制AS的炎症反应。阿司匹林也有相关基础研究[32-33]和临床研究[34-35]证明其单独使用或联合阿托伐他汀等药物能抑制IL-6和IL-8的表达,降低心绞痛患者血浆炎性因子水平。
2个药物共同参与的SAP相关信号通路在免疫系统中的共性表现最明显。如JAK-STAT信号通路的激活是多种细胞因子和生长因子诱导血管平滑肌细胞增殖和迁移的共同途径,一方面可以调节炎症细胞的增殖、分化和黏附迁移过程,影响AS炎症细胞的浸润[36-37];另一方面可以增加内皮细胞的迁移和增殖,抑制JAK-STAT信号通路中相关蛋白质的激活,可以有效阻止炎症介质所诱导的血管内皮细胞迁移率,从而影响AS的发生和发展[38-39]。Toll家族分子可通过上调选择素、粘附分子和趋化分子促进白细胞在AS斑块中的浸润[40-41];也可以通过抑制胆固醇逆向转运等促进脂质核心在AS斑块的生成[42-43];还可以通过上调VEGF促进AS斑块的血管新生[44-45]。NOD样受体能形成细胞内大多蛋白质复合体——“炎性体”,炎性体激活后产生的NLRP3,IL-1β和IL-18等与AS的关系非常密切。已有研究证明注射用丹参多酚酸盐能有效抑制JAK-STAT信号通路介导的炎症反应和Toll样受体的表达水平,缓解AS[46-47]。
MAPK信号通路是注射用丹参多酚酸盐和阿司匹林共同参与的SAP相关重要信号通路,包括ERK,JNK和p38MAPK 3条传导途径,在细胞增殖、存活、分化、凋亡等生理过程中有至关重要的作用。氧化修饰低密度脂蛋白(oxidized modified low density lipoprotein,ox-LDL)是导致AS的重要因素,能诱导血管平滑肌细胞增殖。研究表明[48],ox-LDL能引发MAPK信号通路的级联反应,促进血管平滑肌细胞异常增殖。也有学者认为[48],ox-LDL首先通过诱导体内活性氧簇(reactive oxygen species,ROS)增加,由ROS引起细胞有丝分裂信号,从而通过MAPK途径导致细胞增殖,促进AS的发生发展。研究发现,SAP患者血清中的MAPKs水平明显高于正常人[25],急性冠脉综合征患者血清中的MAPKs水平较SAP患者更高[25]。
3.2 联合用药治疗SAP的疗效相加作用
注射用丹参多酚酸盐对VEGF具有双向调节作用:一方面能够有效降低SAP患者血清内VEGF水平,抑制AS的发生发展[49];另一方面,可以通过上调VEGF促进血管新生,加快损伤内皮细胞的修复,同时为局部缺血建立有效的侧支循环,恢复缺血区功能[50-51]。VEGF是目前公认的参与血管增生的启动子,与SAP等缺血性心脏病的关系十分密切。IFNG也称为干扰素γ(IFN-γ),其由活化的T淋巴细胞产生,是多种致炎因子相互作用的枢纽,对AS的炎症反应和斑块的稳定性有负面影响[52-54]。同时,IFN-γ是内皮细胞中的活化因子[55],可以调节巨噬细胞相关脂质受体,抑制泡沫细胞出现,保护内皮细胞,抑制AS进展[56]。已有研究显示,注射用丹参多酚酸盐能抑制IFN-γ诱导的炎性反应,抑制AS的发展[57]。AKT1又称为蛋白激酶B,处于PI3K/AKT通路的中心环节,调控细胞生长与存活,增殖与凋亡等[58],激活PI3K/AKT信号途径,可以抑制血管内皮细胞中组织因子的表达,降低血管内皮细胞的凋亡和血管平滑肌细胞的迁移[59]。已有研究证明[60],PI3K/AKT信号通路在保护MIRI中发挥重要作用,在一定条件下,PI3K/AKT信号通路可以有效抑制心肌细胞凋亡发挥心肌保护作用[61]。已有基础研究证实[62-63],MLB一方面可以通过激活AKT和eNOS减轻心肌缺血再灌注造成的心肌细胞损伤,另一方面也可以通过降低血清内IL-1,IL-6,TNF-α等抑制 MIRI 损伤时的炎症反应。中国心脏调查结果显示冠心病患者中至少有1/3合并糖尿病[64],研究发现[65]418例服用阿司匹林抗血小板的患者中有78例(18.7%)患者出现阿司匹林抵抗现象,评估后认为与血糖升高密切相关,而与年龄、体重指数、吸烟、冠心病家族史等因素无显著关联。注射用丹参多酚酸盐和SAP都与1型糖尿病信号通路相关,并且注射用丹参多酚酸盐还与2型糖尿病信号通路和胰岛素信号通路的调节相关,考虑注射用丹参多酚酸盐可能通过调节糖代谢对降低高血糖影响的阿司匹林抵抗有一定积极作用,联合用药可能对SAP合并糖尿病患者发挥更好的临床疗效。高血糖影响阿司匹林抗血小板聚集作用的机制,一方面可能是阿司匹林和葡萄糖的浓度决定了二者在血小板蛋白的乙酰化过程中互相对抗的结果,血糖持续升高可减弱阿司匹林对血小板的乙酰化作用,导致糖尿病患者对阿司匹林的敏感性降低[66-68];另一方面可能是高血糖引起血小板膜表面蛋白糖基化和膜脂质代谢紊乱,导致血小板膜结构的改变,影响阿司匹林与血小板膜表面靶点结合[69-71]。
阿司匹林单独参与的SAP相关信号通路以代谢作用为主,如AA和亚油酸代谢信号通路,亚油酸代谢过程中依次产生γ-亚麻酸和AA等中间产物,参与脂类代谢,可降低血液中的胆固醇,软化血管,降低血压,对心血管疾病有改善作用[72-73]。AA代谢信号通路是其发挥抗血小板效应的主要作用机制[74],通过不可逆的抑制COX-1,阻碍AA衍变为PGI2和TXA2,发挥抗血小板作用。然而COX-1和COX-2均可导致血小板聚集,阿司匹林可以抑制血小板的COX-2,但不能完全抑制来自于炎性细胞产生的COX-2,对其抗血小板的作用有一定影响[75]。已有研究[76]表明,丹参乙酸镁可以通过激活P38,ERK和JNK抑制炎性分子的表达,能够有效抑制LPS诱导的COX-2在主动脉内皮细胞中的表达,抑制AS的发展进程。阿司匹林单独相关的SAP重要基因为TP53,EPHB2,相关信号通路还包括细胞生长与凋亡相关的P53信号通路等。TP53与细胞凋亡和细胞周期停滞等一系列生物学效应有关,参与血管平滑肌细胞的生长和凋亡,对AS发生有一定影响。研究认为血管平滑肌细胞的凋亡与P53途径有依赖性关系[77],TP53基因的激活与动脉粥样硬化斑块中DNA的损伤有关,并参与调节细胞衰老、血管平滑肌细胞凋亡等[78-79]。EPHB2与免疫细胞的活化和迁移的关系更加密切,属于EPH家族,是目前已知的最大的酪氨酸激酶家族,有研究表明[80] EPHB2参与了缺血性心脏病和血管内皮细胞增殖[81],对血管平滑肌细胞和单核细胞的增生有一定影响[82]。
阿司匹林作为心血管疾病防治的最常用药物,存在长时间、大剂量使用和滥用的情况,导致了阿司匹林不良反应发生的增加。主要表现为胃肠道症状,包括恶心、呕吐、出血等,长时间大剂量服用还有可能引起肝肾损害[83-84]。虽然尚无确切证据表明注射用丹参多酚酸盐能够缓解阿司匹林引起的胃粘膜出血等不良反应,但是本研究结果发现注射用丹参多酚酸盐通过对VEGF信号通路的调节可以修复损伤的内皮细胞,并且没有直接的抗血小板聚集作用,因而可能通过保护内皮细胞降低胃出血的风险。已有研究证实VEGF水平与上消化道出血[85-86]、慢性萎缩性胃炎[87-88]、胃癌[89-90]等胃肠道反应有关,并可以作为相关疾病的判断指标。也有研究发现[91],注射用丹参多酚酸盐可以通过抑制内毒素诱导的炎症因子释放,改善肠系膜微循环紊乱、保护肠上皮细胞完整性和降低肠黏膜通透性。
4 小结
通过生物分子网络分析注射用丹参多酚酸盐和阿司匹林联合用药治疗SAP,一方面可能通过对炎症反应相关因子及信号通路的调节,在抗炎症反应和抑制动脉粥样硬化发展方面起到疗效增强作用;另一方面注射用丹参多酚酸盐在阿司匹林抗血小板聚集的基础上具有保护血管内细胞的作用,同时能够调节糖代谢,联合用药可能起到疗效相加作用。本研究的局限性在于仅从生物分子网络的角度对注射用丹参多酚酸盐联合阿司匹林治疗SAP可能的作用机制进行了预测分析,尚不能作为临床联合用药的依据,还需要进一步的临床试验加以验证。
[参考文献]
[1] 《慢性稳定型心绞痛诊断与治疗指南》正式公布[J]. 中国全科医学,2007(7):601.
[2] 孙启民. 阿司匹林在心脑血管疾病中的应用效果观察[J]. 中国医药指南,2013(35):342.
[3] Rocca B,Petrucci G. Variability in the responsiveness to low-dose aspirin: pharmacological and disease-related mechanisms[J]. Thrombosis,2012(25):376721.
[4] 常艳鹏,张辉,谢雁鸣,等. 真实世界中注射用丹参多酚酸盐治疗冠心病的联合用药分析[J].中国中药杂志,2013,38(18):3186.
[5] 卢鹏飞,向永洋,谢雁鸣,等. 基于自发呈报系统丹参多酚酸盐安全信号预警分析[J]. 中国中药杂志,2013(18):3003.
[6] 叶瑞印.丹参多酚酸盐治疗稳定型心绞痛疗效观察[J].上海中医药杂志,2013(3):51.
[7] 陆立志. 老年稳定性心绞痛采用注射用丹参多酚酸盐治疗的临床疗效观察[J]. 河南医学研究,2014,23(10):85.
[8] 徐伟忠,徐开联,付延导. 注射用丹参多酚酸盐治疗冠心病心绞痛(心血瘀阻型)的疗效观察[J]. 中国卫生产业,2011,8(26):7.
[9] 陈述,张晶,严凤娣,等. 稳定型心绞痛患者血清一氧化氮、内皮素、血管内皮生长因子水平变化及丹参多酚酸盐的干预作用[J]. 中国临床药理学与治疗学,2009(10):1160.
[10] 王逸平,宣利江. 中药现代化的示范性成果——丹参多酚酸盐及其注射用丹参多酚酸盐的研究与开发[J]. 中国科學院院刊,2005(5):377.
[11] Wu W Y,Wang Y P. Pharmacological actions and therapeutic applications of Salvia miltiorrhiza depside salt and its active components[J]. Acta Pharmacol Sin,2012,33(9):1119.
[12] 李梢. 网络药理学在中医药研究中的应用[C].腾冲: 中国药理学会生化与分子药理学专业委员会网络药理学研讨会,2012.
[13] Ooi S L,Pan X,Peyser B D,et al. Global synthetic-lethality analysis and yeast functional profiling[J]. Trends Genet,2006,22(1):56.
[14] Frey B J,Dueck D. Clustering by passing messages between data points[J]. Science,2007,315(5814):972.
[15] Enright A J,Van Dongen S,Ouzounis C A. An efficient algorithm for large-scale detection of protein families[J]. Nucleic Acids Res,2002,30(7):1575.
[16] Bader G D,Hogue C W. An automated method for finding molecular complexes in large protein interaction networks[J]. BMC Bioinformatics,2003,4:2.
[17] 陈树. 聚类算法模型的研究及应用[D]. 苏州:江南大学,2007.
[18] 孙鹏岗. 聚类算法研究及其在网络模块性分析中的应用[D]. 西安:西安电子科技大学,2011.
[19] 陈扬,薛素兰. 中西药联合用药作用探析[J]. 中医药学刊,2006(5):898.
[20] 黄宇星,刘二伟. 联合用药的药物相互作用及研究方法[J]. 药物评价研究,2014(3):276.
[21] 谢雁鸣,王连心,王永炎. 临床联合用药机制研究的探讨[J]. 中国中药杂志,2014(18):3424.
[22] 卢小卓,于宪. 冠心病患者TNF-α,IL-1β,IL-6,IL-8的变化研究[J]. 放射免疫学杂志,2003(3):175.
[23] Davidson M K,Shandilya H K,Hirota K,et al. Atf1-Pcr1-M26 complex links stress-activated MAPK and cAMP-dependent protein kinase pathways via chromatin remodeling of cgs2+[J]. J Biol Chem,2004,279(49):50857.
[24] Ackerley S,Grierson A J,Banner S,et al. p38alpha stress-activated protein kinase phosphorylates neurofilaments and is associated with neurofilament pathology in amyotrophic lateral sclerosis[J]. Mol Cell Neurosci,2004,26(2):354.
[25] El M A,Abuabaid H M,Hurtig-Wennlof A,et al. High MAPK p38 activity and low level of IL-10 in intermittent claudication as opposed to stable angina[J]. Int Angiol,2010,29(4):331.
[26] 刘虹,徐庆科,夏伟,等. 冠心病与炎症因子IL-6、IL-8、IL-10、hs-CRP及TNF的相关性研究[J]. 实用心脑肺血管病杂志,2011(9):1446.
[27] 沈彩云. 冠心病患者脂类代谢及炎症因子与代谢综合征关系探究[J]. 当代医学,2012(23):43.
[28] 陈昕琳,顾仁樾,章怡祎. 丹参多酚酸B对动脉粥样硬化大鼠炎症细胞因子的影响[J]. 上海中医药大学学报,2011(1):63.
[29] 陈昕琳,顾仁樾,章怡祎. 丹参多酚酸B对动脉粥样硬化大鼠炎症细胞因子的影响[J]. 上海中医药大学学报,2011(1):63.
[30] 吴兴利,李德印,李金珉,等. 丹参多酚酸盐对UAP患者冠脉内支架置入术后血清IL-6、IL-8及TNF-α水平的影响[J]. 心脏杂志,2010(5):705.
[31] 吴兴利,李金珉,李德印,等. 丹参多酚酸盐治疗老年不稳定型心绞痛的疗效与机制研究[J]. 现代中西医结合杂志,2010,19(13):1561.
[32] 涂琳,张彦燕,罗红,等. 阿司匹林对急性心梗后心肌重塑大鼠血清中NO、TNF-α及IL-6的影响[J]. 华西药学杂志,2013(1):48.
[33] 郎艳松. 通心络联合阿托伐他汀、阿司匹林对新西兰兔动脉粥样硬化早期颈动脉外膜滋养血管新生相关炎癥机制的影响[D]. 石家庄:河北医科大学,2015.
[34] 冉群钗,夏碧桦,韩敏珍. 不同剂量阿司匹林干预对不稳定型心绞痛患者炎性因子水平的影响[J]. 中国医药指南,2011(21):277.
[35] 徐尚誉,唐胜惠. 阿司匹林对急性心肌梗死患者炎症指标的影响[J]. 心血管病防治知识:学术版,2012(2):14.
[36] 田轶魁. JAK2-STAT3通路在缺血后处理心肌保护作用中的机制研究[D]. 天津:天津医科大学,2009.
[37] 王庆高,卢健棋,朱智德,等. 扶芳藤丹参合剂预处理通过JAK/STAT通路干预心肌缺血再灌注损伤炎症反应的研究[J]. 新中医,2013(12):167.
[38] 郝赫,关立克. JAK-STAT信号通道在动脉粥样硬化中的意义[J]. 吉林医学,2013(1):123.
[39] 黄良珠,田英,龙石银. JAK/STAT信号通路及其负调控因子SOCS与动脉粥样硬化[J]. 中国动脉硬化杂志,2010(8):665.
[40] Jang H J,Kim H S,Hwang D H,et al. Toll-like receptor 2 mediates high-fat diet-induced impairment of vasodilator actions of insulin[J]. Am J Physiol Endocrinol Metab,2013,304(10):E1077.
[41] Madan M,Amar S. Toll-like receptor-2 mediates diet and/or pathogen associated atherosclerosis: proteomic findings[J]. PLoS ONE,2008,3(9):e3204.
[42] Kazemi M R,Mcdonald C M,Shigenaga J K,et al. Adipocyte fatty acid-binding protein expression and lipid accumulation are increased during activation of murine macrophages by toll-like receptor agonists[J]. Arterioscler Thromb Vasc Biol,2005,25(6):1220.
[43] Feingold K R,Kazemi M R,Magra A L,et al. ADRP/ADFP and Mal1 expression are increased in macrophages treated with TLR agonists[J]. Atherosclerosis,2010,209(1):81.
[44] Cho M L,Ju J H,Kim H R,et al. Toll-like receptor 2 ligand mediates the upregulation of angiogenic factor,vascular endothelial growth factor and interleukin-8/CXCL8 in human rheumatoid synovial fibroblasts[J]. Immunol Lett,2007,108(2):121.
[45] Saber T,Veale D J,Balogh E,et al. Toll-like receptor 2 induced angiogenesis and invasion is mediated through the Tie2 signalling pathway in rheumatoid arthritis[J]. PLoS ONE,2011,6(8):e23540.
[46] 吳燕燕,孙煜,王易. 丹参多酚酸盐活血化瘀作用的多元化药理作用[J]. 中国现代应用药学,2010(11):975.
[47] 张辉,张杨,杨蓉,等. 丹参多酚酸盐对急性冠脉综合征患者炎症因子影响的相关研究[J]. 中国中西医结合杂志,2013(5):598.
[48] Norata G D,Pirillo A,Pellegatta F,et al. Native LDL and oxidized LDL modulate cyclooxygenase-2 expression in HUVECs through a p38-MAPK,NF-kappaB,CRE dependent pathway and affect PGE2 synthesis[J]. Int J Mol Med,2004,14(3):353.
[49] 周坤,王梅. 丹参多酚酸盐对老年冠心病心绞痛患者血清VEGF、MMP-9的影响[J]. 临床合理用药杂志,2015(2):1.
[50] Lay I S,Chiu J H,Shiao M S,et al. Crude extract of Salvia miltiorrhiza and salvianolic acid B enhance in vitro angiogenesis in murine SVR endothelial cell line[J]. Planta Med,2003,69(1):26.
[51] 徐杰,范维琥. 丹参多酚酸盐对人血管内皮细胞迁移的影响[J]. 中西医结合学报,2003(3):211.
[52] 尹学哲,全吉淑,金泽武道,等. 大豆异黄酮和皂甙对糖尿病大鼠抗动脉粥样硬化活性的研究[J]. 中华预防医学杂志,2004(1):26.
[53] Serra P A,Esposito G,Enrico P,et al. Manganese increases L-DOPA auto-oxidation in the striatum of the freely moving rat: potential implications to L-DOPA long-term therapy of Parkinson′s disease[J]. Br J Pharmacol,2000,130(4):937.
[54] Taguchi S,Oinuma T,Yamada T. A comparative study of cultured smooth muscle cell proliferation and injury,utilizing glycated low density lipoproteins with slight oxidation,auto-oxidation,or extensive oxidation[J]. J Atheroscler Thromb,2000,7(3):132.
[55] Whitman S C,Ravisankar P,Daugherty A. IFN-gamma deficiency exerts gender-specific effects on atherogenesis in apolipoprotein E-/- mice[J]. J Interferon Cytokine Res,2002,22(6):661.
[56] Nosaka M,Ishida Y,Kimura A,et al. Absence of IFN-gamma accelerates thrombus resolution through enhanced MMP-9 and VEGF expression in mice[J]. J Clin Invest,2011,121(7):2911.
[57] 娄峥,彭军. 丹参乙酸镁的心脑血管保护作用及机制研究进展[J]. 中国动脉硬化杂志,2013(9):855.
[58] Enomoto A,Murakami H,Asai N,et al. Akt/PKB regulates actin organization and cell motility via Girdin/APE[J]. Dev Cell,2005,9(3):389.
[59] Ghigo A,Damilano F,Braccini L,et al. PI3K inhibition in inflammation: toward tailored therapies for specific diseases[J]. Bioessays,2010,32(3):185.
[60] Tsang A,Hausenloy D J,Mocanu M M,et al. Postconditioning: a form of "modified reperfusion" protects the myocardium by activating the phosphatidylinositol 3-kinase-Akt pathway[J]. Circ Res,2004,95(3):230.
[61] Lindsley C W,Barnett S F,Layton M E,et al. The PI3K/Akt pathway: recent progress in the development of ATP-competitive and allosteric Akt kinase inhibitors[J]. Curr Cancer Drug Targets,2008,8(1):7.
[62] 權伟. 丹酚酸B对心肌缺血/再灌注损伤的保护作用及机制研究[D]. 西安:第四军医大学,2013.
[63] 周丹,权伟,关月,等. 丹酚酸B通过Akt-eNOS通路对大鼠心肌缺血/再灌注损伤保护作用的研究[J]. 陕西中医,2013(1):104.
[64] Hu D Y,Pan C Y,Yu J M. The relationship between coronary artery disease and abnormal glucose regulation in China: the China heart survey[J]. Eur Heart J,2006,27(21):2573.
[65] Al-Azzam S I,Alzoubi K H,Khabour O,et al. The prevalence and factors associated with aspirin resistance in patients premedicated with aspirin[J]. Acta Cardiol,2012,67(4):445.
[66] Watala C,Pluta J,Golanski J,et al. Increased protein glycation in diabetes mellitus is associated with decreased aspirin-mediated protein acetylation and reduced sensitivity of blood platelets to aspirin[J]. J Mol Med (Berl),2005,83(2):148.
[67] 刘霖. 阿司匹林抵抗的危险因素调查及临床防治的实验研究[D].北京:中国人民解放军军医进修学院,2011.
[68] Watala C,Ulicna O,Golanski J,et al. High glucose contributes to aspirin insensitivity in streptozotocin-diabetic rats: a multiparametric aggregation study[J]. Blood Coagul Fibrin,2006,17(2):113.
[69] Keating F K,Sobel B E,Schneider D J. Effects of increased concentrations of glucose on platelet reactivity in healthy subjects and in patients with and without diabetes mellitus[J]. Am J Cardiol,2003,92(11):1362.
[70] Gresner P,Dolnik M,Waczulikova I,et al. Increased blood plasma hydrolysis of acetylsalicylic acid in type 2 diabetic patients: a role of plasma esterases[J]. Biochim Biophys Acta,2006,1760(2):207.
[71] Hangaishi M,Taguchi J,Miyata T,et al. Increased aggregation of human platelets produced by advanced glycation end products in vitro[J]. Biochem Biophys Res Commun,1998,248(2):285.
[72] Clarke S D. Polyunsaturated fatty acid regulation of gene transcription: a mechanism to improve energy balance and insulin resistance[J]. Br J Nutr,2000,83(Suppl 1):S59.
[73] 周鴻,山杉公男. 亚油酸对大白鼠血胆固醇浓度及磷脂分子组成的影响[J]. 江西科学,2002(4):207.
[74] Parekh A K,Galloway J M,Hong Y,et al. Aspirin in the secondary prevention of cardiovascular disease[J]. N Engl J Med,2013,368(3):204.
[75] Nakamura H. Cyclooxygenase (COX)-2 selective inhibitors: aspirin,a dual COX-1/COX-2 inhibitor,to COX-2 selective inhibitors][J]. Nihon Yakurigaku Zasshi,2001,118(3):219.
[76] Chen Y L,Hu C S,Lin F Y,et al. Salvianolic acid B attenuates cyclooxygenase-2 expression in vitro in LPS-treated human aortic smooth muscle cells and in vivo in the apolipoprotein-E-deficient mouse aorta[J]. J Cell Biochem,2006,98(3):618.
[77] Sheikh M S,Fornace A J. Role of p53 family members in apoptosis[J]. J Cell Physiol,2000,182(2):171.
[78] Bennett M R,Littlewood T D,Schwartz S M,et al. Increased sensitivity of human vascular smooth muscle cells from atherosclerotic plaques to p53-mediated apoptosis[J]. Circ Res,1997,81(4):591.
[79] Bennett M R,Evan G I,Schwartz S M. Apoptosis of rat vascular smooth muscle cells is regulated by p53-dependent and -independent pathways[J]. Circ Res,1995,77(2):266.
[80] Braun J,Hoffmann S C,Feldner A,et al. Endothelial cell ephrinB2-dependent activation of monocytes in arteriosclerosis[J]. Arterioscler Thromb Vasc Biol,2011,31(2):297.
[81] Mansson-Broberg A,Siddiqui A J,Genander M,et al. Modulation of ephrinB2 leads to increased angiogenesis in ischemic myocardium and endothelial cell proliferation[J]. Biochem Biophys Res Commun,2008,373(3):355.
[82] Korff T,Braun J,Pfaff D,et al. Role of ephrinB2 expression in endothelial cells during arteriogenesis: impact on smooth muscle cell migration and monocyte recruitment[J]. Blood,2008,112(1):73.
[83] 陈慧,张艳,吴小盈,等. 肠溶阿司匹林致冠心病患者上消化道出血不良反应调查[J]. 中华临床医师杂志:电子版,2010(8):1277.
[84] 吴冰冰,梅琼. 阿司匹林不良反应的国内文献分析[J]. 中国药师,2008(2):224.
[85] 乌日罕,冯占军,孙秀威,等. VEGF和MVD可作为判断胃癌患者预后和上消化道出血风险的指标[J]. 胃肠病学,2013(2):100.
[86] 乌日罕,苏娜,孙秀威. VEGF,MVD在胃癌预后及上消化道出血风险的研究进展[J]. 现代生物医学进展,2012(21):4159.
[87] 杨连生. VEGF在慢性萎缩性胃炎胃黏膜组织中的表达[J]. 白求恩军医学院学报,2010(6):408.
[88] 孙永红,孙良华,黄文波,等. 慢性萎缩性胃炎患者胃黏膜上皮细胞中PCNA、EGF、VEGF的表达及意义[J]. 山东医药,2008(40):4.
[89] 欧玉荣,康敏,周蕾,等. 胃癌中幽门螺杆菌L型感染与MIF、MMP9、VEGF表达的关系[J]. 南方医科大学学报,2014(2):180.
[90] 李国元,赵久达,王成,等. HIF-1α和VEGF在胃癌中的表达及临床意义[J]. 中国癌症杂志,2010(8):602.
[91] Han J Y,Horie Y,Miura S,et al. Compound Danshen injection improves endotoxin-induced microcirculatory disturbance in rat mesentery[J]. World J Gastroenterol,2007,13(26):3581.
[责任编辑 曹阳阳]

