肝细胞癌癌前异型增生结节的研究现状
焦俊喆, 李京涛, 闫曙光, 魏海梁, 鞠 迪, 宋艺君, 常占杰
(1 陕西中医药大学, 陕西 咸阳 712000; 2 陕西中医药大学附属医院, 陕西 咸阳 712046)
肝细胞癌癌前异型增生结节的研究现状
焦俊喆1, 李京涛2, 闫曙光1, 魏海梁2, 鞠 迪1, 宋艺君1, 常占杰2
(1 陕西中医药大学, 陕西 咸阳 712000; 2 陕西中医药大学附属医院, 陕西 咸阳 712046)
异型增生结节(DN)是肝细胞癌(HCC)癌前病变向HCC演变的重要阶段,具有极高的癌变风险。依据细胞异型性的不同,DN可分为低度异型增生结节(LGDN)和高度异型增生结节(HGDN),总结了LGDN与HGDN的病理特点、影像学特征及生物标志物,简述了DN恶变为HCC的风险大小,指出应当提高临床医师对于HCC癌前病变DN的认识,通过对DN的筛查发现恶变风险高的结节并进行干预,以防止HCC的发生。
癌, 肝细胞; 异型增生结节; 病理状态, 体征和症状; 生物学标记; 综述
肝细胞癌(HCC)是全球最常见和最致命的恶性肿瘤之一,约占癌症死亡病例的9.2%。过去15年HCC的发病率增长了一倍多,而我国的HCC新发病例占全球的50%以上[1]。HCC发病率高,预后不良。尽管治疗方案不断改进,但患者的长期生存率仍然很低,其最主要的原因是HCC早期阶段难以发现和检出。大量的研究[2-4]显示80%~90%的HCC发生在肝纤维化、肝硬化的基础上,经病理学、分子生物学及影像学研究[5-6]证实,肝硬化-HCC的恶变进程中,会经历一个较长的HCC癌前病变过程。HCC的癌前病变表现为[7]:肝细胞异型增生、异型增生灶、异型增生结节(dysplastic nodule,DN)、肝细胞腺瘤。其中DN的恶变风险极高,因此对于HCC癌前病变中DN的研究具有非常重要的临床和科研意义。
1 DN的病理特点及本质
1.1 DN的病理特点 1995年国际胃肠病学大会国际工作组将慢性肝病中的结节分为再生结节、DN及HCC结节。DN是指具有不典型增生(存在细胞质和细胞核异常)而在组织学上无恶变证据[8]、直径超过1 cm的肝细胞群,常见于肝硬化中,也偶见于其他慢性肝病中[9]。DN大多数直径为1~1.5 cm,可为单个或多个结节(数量常少于10个),与周围肝实质在大小、颜色和组织上有差异。依据组织学上细胞的异型性,可将DN分为低级异型增生结节(low grade dysplastic nodule,LGDN)和高级异型增生结节(high grade dysplastic nodule,HGDN)。两者的病理特点比较见表1[5,10-12]。
1.2 DN是HCC癌前病变 DN通常被认为是HCC癌前病变。HCC不全是DN发展而来,也可以是肝内任何部位发生恶变,但由DN发展导致的HCC,HCC结节通常位于DN中。对切除的高分化HCC进行取材,发现几乎所有高分化HCC均伴有DN。有报道[13]称DN与其毗邻的HCC具有非常相似的分子结构改变。DN中LGDN的恶变风险较小,而HGDN恶变风险大,大多数HCC是由HGDN恶变发展所致[10,14-15]。HGDN的端粒更短且染色体更加不稳定,大多数HGDN与HCC相似,均强表达hTERT mRNA,约33%的HGDN表现出更高的端粒酶活性[16]。Kobayashi等[14]对154例DN患者随访,随访中位时间为2.8年时,HGDN、LGDN的恶变风险系数分别为16.8和2.96。一项对中国患者随访29个月的研究[17]表明:1、2、3和4年的癌变率在再生结节为3%、5%、9%、12%;在LGDN为29%、35%、38%、44%;在HGDN为38%、41%、51%和51%,说明DN是HCC癌前病变且HGDN的出现增加了HCC的发生和死亡危险。

表1 LGDN和HGDN的病理特点比较
2 DN的影像学特征
2.1 DN的超声表现 超声是肝脏影像学检查中最常用的手段,但是常规超声的应用对于DN的检出率及特异性均差强人意,近几年来超声造影(contrast-enhanced ultrasound,CEUS)技术则提高了DN诊断的特异性。与CT和MRI相比,CEUS具有非肾排泄、实时成像能力及血管内造影等优势[18]。CEUS的造影时相与增强CT相似,都分为动脉期、门静脉期和延迟期。在CEUS中少数DN可表现为动脉期先于肝实质出现高强化,门静脉期和延迟期均与肝实质同等强化,而大多数DN动脉期和门静脉期与肝实质同步增强和同步减退。与DN不同的是,典型HCC在CEUS中表现为动脉期病灶出现高强化,门静脉期或延迟期出现低强化[18]。相比增强CT和MRI,CEUS可对≤1 cm的早期HCC病灶起到更好的诊断价值[18]。CEUS可实时监控肝内DN增强特征,如果出现恶变可早期明确HCC的诊断。通过结合常规超声和CEUS,有利于DN患者进展为HCC的早期诊断。
2.2 DN的CT表现 LGDN和HGDN在CT平扫期均表现为较低或等密度。在增强CT的动脉期,大多数LGDN和HGDN均表现为低密度,少数HGDN可出现强化,可能是由于肝动脉供血增加的缘故[19],而LGDN中异常增生血管较少,所以动脉期仍是较低或等密度。大多数的LGDN和HGDN在增强CT的门静脉期无强化,表现为稍低或等密度。少数HGDN则出现低密度,这与门静脉血供减少、动脉血供增多有关[19]。动态增强CT是检出小肝癌较为敏感的技术,但通常不能发现LGDN与HGDN,因为DN的门静脉血流量和周围的肝硬化组织大致相当[20]。LGDN与HGDN均不出现假包膜,而大多数的小肝癌可出现假包膜。2.3 DN的MRI表现 MRI对于DN的检测优势明显,检出率最高。临床上常见LGDN和HGDN在T1WI上常表现为高信号,也可表现为等信号,两者在T2WI均不表现为高信号。小肝癌在T1WI中,大多数表现为略低信号或等信号、少部分表现为略高信号,单看T1WI几乎不能区别DN与小肝癌。但在T2WI中,绝大部分小肝癌表现为略高信号,少数表现为等或略低信号,这是鉴别DN和小肝癌的关键性特征[6]。用造影剂超顺磁性氧化铁粒子(superparamagnetic iron oxide,SPIO)做增强MRI检查能准确鉴别DN和HCC。因为DN中有较多Kupffer细胞,HCC中Kupffer细胞较少甚至缺失,而Kupffer细胞能够摄取并清除SPIO,所以DN因含有SPIO在T2WI中表现为低信号,相反的,不含SPIO的HCC在T2WI中表现为高信号[21]。钆塞酸二钠(Gd-EOB-DTPA,普美显) 是特异性的肝细胞对比造影剂,可以被正常肝细胞持续摄取,而不被HCC细胞及病变细胞摄取。在DN中,随着肝细胞异型性的增加,摄取Gd-EOB-DTPA的能力逐渐下降。对DN和HCC分别进行Gd-EOB-DTPA增强MRI:DN在T2WI 表现低信号,而HCC 在T2WI 常表现为高信号,根据T2WI信号不同可鉴别二者[22]。
除了常规的超声、CT和MRI等影像学检查,还出现了PET-CT、PET-MRI等影像学“新秀”。PET-CT或PET-MRI获得的组织学影像及PET反映的功能代谢活动均优于单一的成像模式[23]。有研究[24]认为PET-CT发现HCC肝外转移及转移灶数目及大小比CT与MRI更加准确,但是PET-CT对于高分化HCC的特异性并不高,因为高分化HCC与正常肝组织在PET-CT上显像相似。PET-MRI可作为PET-CT中高分化HCC的有效补充手段[25]。由于诊断特异性或费用等问题,使得PET-CT与PET-MRI临床应用并不普遍,但随着其发展与普及,对于肝脏结节病变的诊断定能够提供更加准确的信息。
2.4 DN恶变的影像学表现 DN癌变的危险信号[19]:DN结节内出现脂肪变;结节的供血改变(由门静脉供血为主转变为肝动脉供血为主);出现结节中结节;出现假包膜;Kupffer细胞功能和数目减少,摄取清除SPIO能力明显下降;结节进行性增大;结节直径大于3 cm。
3 DN的生物标志物
3.1 磷脂酰基醇蛋白聚糖-3(glypican,GPC3) GPC3是一种细胞膜表面的硫酸乙酰肝素糖蛋白,具有调节细胞增殖与分化的作用。GPC3在HCC癌前病变和HCC组织中过度表达,而在正常肝组织和肝硬化组织中不表达[26]。HCC癌前病变一旦转变为小肝癌,GPC3迅速高表达,因而GPC3可用来区别HCC结节和良性肝结节。对172例肝切除术后患者的研究发现[27]GPC3与AFP水平和肿瘤结节中癌细胞转移呈正相关,肝组织中GPC3的高表达是术后无病生存期短、复发和总体生存率下降的独立危险因素。有报道[28]显示,在肝脏切除标本中,高分化HCC的GPC3免疫反应性是69%、中低分化HCC是81%、HGDN是9%,LGDN无阳性表达。近期的研究[29]也发现HGDN的GPC3阳性表达率高于LGDN。说明GPC3可作为常规HCC的筛查指标之一,同时,GPC3阳性表达的DN,尤其是高表达GPC3的HGDN,恶变的风险较高。
3.2 角蛋白(cytokeratin,CK)7和CK19 在汇管区、纤维间隔的内外出现肿瘤细胞的侵袭属于间质浸润。研究[30]发现间质浸润对于高分化HCC有较高的诊断意义,间质浸润有利于高分化HCC和HGDN的鉴别。由于高分化HCC肿瘤细胞与正常肝细胞相似,所以往往很难区分肿瘤细胞和慢性肝炎或肝硬化时集中分布在肝门区和纤维间隔内外的非肿瘤性肝细胞。CK7和CK19免疫组化染色有助于区别肝脏肿瘤细胞间质浸润(CK7、CK19阴性)和胆管反应(CK7、CK19阳性)[31]。通过对CK7和CK19进行免疫染色,可明显的区分高分化HCC肿瘤细胞与正常肝细胞。3.3 热休克蛋白(heat shock protein,HSP)70 HSP70是一种抗细胞凋亡因子,常在细胞增殖和肿瘤形成中出现高表达。高表达的HSP70可见于包括HCC在内的多种肿瘤疾病[32-33]。HSP70在胆管细胞的细胞核与细胞质中正常表达,在肝细胞中不表达,但在大多数的HCC中过度表达。Chuma等[34]对早期和进展期HCC的“结节中结节”进行了寡核苷酸阵列分析来对比其表达谱,证实HSP70的表达与结节分化程度相关;研究还发现HSP70在早期HCC中表达高于DN,而与早期HCC相比,进展期HCC过表达HSP70。HSP70免疫反应性,在高分化HCC是78%、中低分化HCC是67%、HGDN是5%、LGDN无阳性表达[28]。
3.4 谷氨酰胺合成酶(glutamine synthetase,GS) GS催化谷氨酰胺合成,是β-catenin的靶基因,GS过度表达与β-catenin的变异和此通路的活化有关[35]。GS在HCC中的表达较HGDN中更高(69.8% vs 13.6%),在阳性DN中表达GS的细胞比例小于50%,而在HCC中表达GS的细胞比例大于50%[28]。据报道[28],GS的免疫反应性在癌前病变、早期HCC和进展期HCC呈现递增趋势。HGDN的GS免疫反应性是14%、高分化HCC是59%、中低分化HCC是86%。
3.5 CD34抗原 不同于正常的肝动脉,DN或小肝癌中新形成的无胆管伴行的动脉叫做非配对动脉。肝窦毛细血管化是长期肝硬化组织病理学的重要改变,其发生与肝窦的血流增加及血压增高有关。肝窦毛细血管化的形成破坏了肝窦的正常结构,使肝内微循环发生障碍,肝细胞和血液间氧和营养物质的交换减弱。有研究[36]对正常肝脏、肝硬化、DN和高分化HCC进行比较,发现正常肝脏无肝窦毛细血管化,DN开始出现肝窦毛细血管化,并且在结节周边最明显,而高分化HCC的肝窦毛细血管化非常严重。随着LGDN-HGDN-早期HCC-进展期HCC的改变,CD34的阳性表达逐渐增加但并非阶梯式的增加[37]。CD34阳性表达只能用于区别正常肝组织和高分化HCC,而不能用于区分HGDN和高分化HCC,因为两者的CD34阳性表达无明显差异。
3.6 增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)和Ki-67抗原 PCNA在肿瘤细胞及正常细胞增殖时均可表达,是调节细胞周期的重要因子,具有启动细胞增殖的作用,可用于评估不同肿瘤细胞包括HCC细胞的增殖活性。Ki-67亦常用于细胞增殖活性的评估。从LGDN-HGDN-早期HCC-进展期HCC,PCNA和Ki-67的表达逐渐增加,在LGDN中活性很低,仅稍高于肝硬化[38]。检测PCNA和Ki-67也有助于评估肝损伤时细胞再生的增殖活性。但是由于没有明确区别多种组织的截断值,所以对细胞增殖活性进行半定量检测不能用于区分HGDN和高分化HCC[39]。
总之,单个生物标志物的特异性及敏感性差强人意,因此,应进行标志物指标的联合检测以增加诊断的敏感性和特异性。目前推荐的免疫染色“套餐”包括HSP70、GPC3和GS,以上3项指标中的2项为阳性即可考虑为HCC,而排除肝脏DN[28]。
4 DN恶变为HCC的风险评估
临床上可根据DN的病理特点和影像表现来预测恶变为HCC的风险[5]。HGDN尺寸增大和CT动脉期增强的发生率超过LGDN[15],HGDN的恶变风险更高。但是目前对单个HGDN结节恶性转变的风险进行准确评估仍比较困难。DN的尺寸大小、随访中DN大小的变化和血管模式的改变都是预测恶变风险的指标。DN恶变为HCC风险如表2[5]所示。
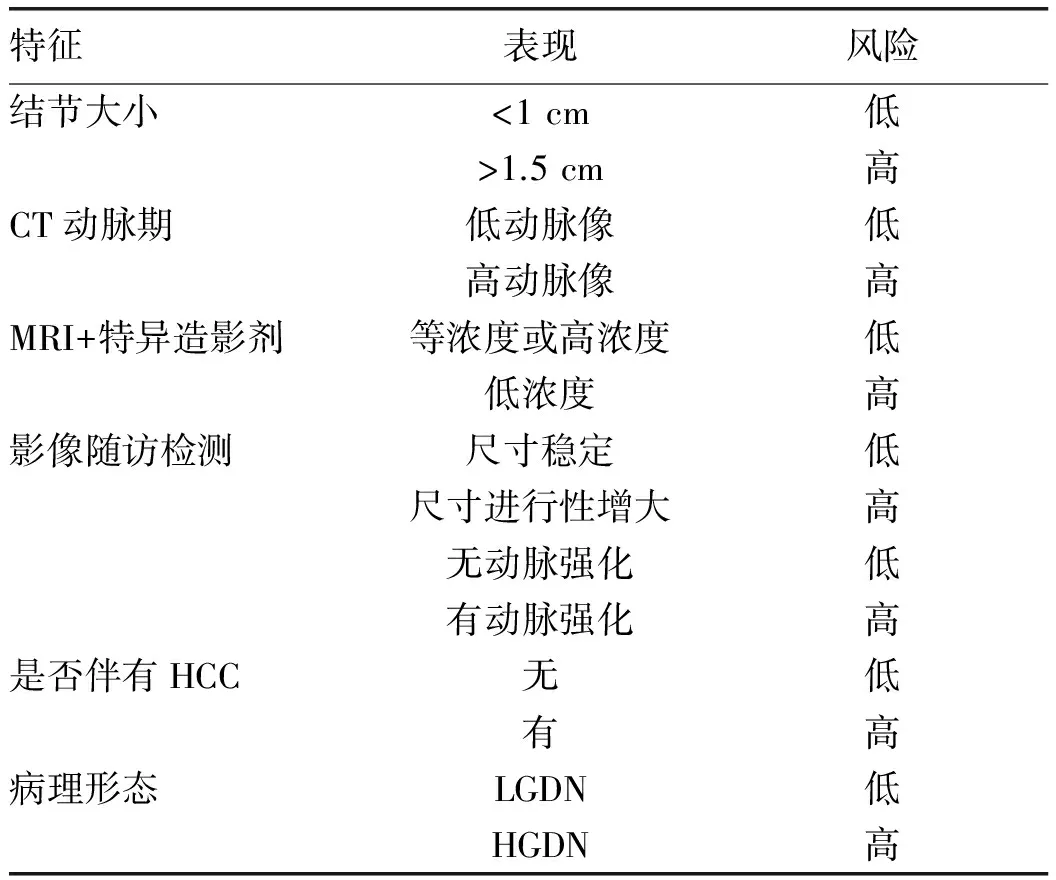
表2 DN恶变为HCC的风险
5 小结
目前临床上对HCC癌前病变DN的重视尚不足。肝穿刺获得标本组织量少、影像学表现的不典型性、病理组织检测技术的高要求等均是DN早期诊断和治疗的影响因素。通过对HCC癌前病变DN的深入研究,有望发展出更好的影像技术和筛选出更可靠的生物标志物来筛查出癌变风险高的结节并加以干预治疗,更好地预防HCC的发生,从而提高患者的生存期和生活质量。
[1] GOMMA AI, KHAN SA, TOLEDANO MB, et al. Hepatocellularcarcinoma: epidemiology, risk factors and pathogenesis[J]. World Gastroenterol, 2008, 14(27): 4300-4308.
[2] YANG JD, KIM WR, COELHO R, et al. Cirrhosis is present in most patients with hepatitis B and hepatocellular carcinoma[J]. Clin Gastroenterol Hepatol, 2011, 9(1): 64-70.
[3] KEW MC. The role of cirrhosis in the etiology of hepatocellular carcinoma[J]. J Gastrointest Cancer, 2014, 45(1): 12-21.[4] LI Y, ZHANG Z, SHI J, et al. Risk factors for naturally-occurring early-onset hepatocellular carcinoma in patients with HBV-associated liver cirrhosis in China[J]. Int J Clin Exp Med, 2015, 8(1): 1205-1212.
[5] DI TL, SANGIOVANNI A, BORZIO M, et al. Advanced precancerous lesions in the liver[J]. Best Pract Res Clin Gastroenterol, 2013, 27(2): 269-284.
[6] HE LL, ZHAO YL, DU LL, et al.Reserch advances in pathological and imaging manifestations of hepatic nodular lesions[J]. J Clin Hepatol, 2015, 31(9): 1547-1550.(in Chinese) 何玲玲, 赵亚林, 杜林林, 等.肝结节性病变的病理和影像学表现[J]. 临床肝胆病杂志, 2015, 31(9): 1547-1550.
[7] Chinese Society of Liver Cancer, Chinese Anti-Cancer Association; Liver Cancer Study Group, Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Pathology, Chinese Anti-Cancer Association, et al.Evidence-based practice guidelines for the standardized pathological diagnosis of primary liver cancer in China(2015 update)[J]. J Clin Hepatol, 2015, 31(6): 833-839.(in Chinese) 中国抗癌协会肝癌专业委员会, 中华医学会肝病会分会肝癌学组, 中国抗癌协会病理专业委员会, 等.原发性肝癌规范化病理诊断指南(2015年版)[J].临床肝胆病杂志, 2015, 31(6):833-839.
[8] WANLESS IR. Terminology of nodular hepatocellular lesions[J]. Hepatology, 1995, 22(3): 983-993.
[9] The International Consensus Group for Hepatocellular Neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia[J]. Hepatology, 2009, 49(2): 658-664.
[10] PARK YN. Update on precursor and early lesions of hepatocellular carcinomas[J]. Arch Pathol Lab Med, 2011, 135(6): 704-715.
[11] NIU ZS, NIU XJ, WANG WH, et al. Latest developments in precancerous lesions of hepatocellular carcinoma[J]. World J Gastroenterol, 2016, 22(12): 3305-3314.
[12] SCHLAGETER M, TERRACCIANO LM, D′ANGELO S, et al. Histopathology of hepatocellular carcinoma[M]// Multidisciplinary treatment of hepatocellular carcinoma. Springer, 2013: 7-10.
[13] WONG CM, YAM JW, NG IO. Molecular Pathogenesis of Hepatocellular Carcinoma[M]// Molecular Genetics of Liver Neoplasia. New York: Springer, 2010: 160-174.
[14] KOBAYASHI M, IKEDA K, HOSAKA T, et al. Dysplastic nodules frequently develop into hepatocellular carcinoma in patients with chronic viral hepatitis and cirrhosis[J]. Cancer, 2006, 106(3): 636-647.
[15] IAVARONE M, MANINI MA, SANGIOVANNI A, et al. Contrast-enhanced computed tomography and ultrasound-guided liver biopsy to diagnose dysplastic liver nodules in cirrhosis[J]. Dig Liver Dis, 2013, 45(1): 43-49.
[16] OH BK, KIM YJ, PARK YN, et al. Quantitative assessment of hTERT mRNA expression in dysplastic nodules of HBV-related hepatocarcinogenesis[J]. Am J Gastroenterol, 2006, 101(4): 831-838.
[17] NG CH, CHAN SW, LEE WK, et al. Hepatocarcinogenesis of regenerative and dysplastic nodules in Chinese patients[J]. Hong Kong Med J, 2011, 17(1): 11-19.
[18] KIM TK, JANG HJ. Contrast-enhanced ultrasound in the diagnosis of nodules in liver cirrhosis[J]. World J Gastroenterol, 2014, 20(13): 3590-3596.
[19] REN S, YE ZX, ZHU LM. Pathological and imaging features of multistep process of cirrhosis nodules[J]. J Clin Hepatol, 2011, 27(4): 425-428. (in Chinese) 任崧, 叶兆祥, 朱理珉. 肝硬化结节多步癌变的病理及影像学表现[J]. 临床肝胆病杂志, 2011, 27(4): 425-428.
[20] WU B, SONG B. Nodular lesions of cirrhotic liver: imaging manifestations with pathologic correlation[J]. Chin J Bases Clin Gen Surg, 2003, 10(3): 288-294. (in Chinese) 吴苾, 宋彬. 肝硬变结节性病变的影像学和相关病理学表现[J]. 中国普外基础与临床杂志, 2003, 10(3): 288-294.
[21] SCHRAML C, KAUFMANN S, REMPP H, et al. Imaging of HCC-Current State of the Art[J]. Diagnostics, 2015, 5(4): 513-545.
[22] JIANG JY, LI XS, MA KS. Application of hepatobiliary-specific MRI contrast agent Gd-EOB-DTPA in preoperative evaluation of hepatobiliary patients[J]. J Clin Hepatol, 2015, 31(6): 996-998. ( in Chinese) 蒋家云, 李雪松, 马宽生.钆塞酸二钠在肝胆手术术前评估中的应用[J].临床肝胆病杂志, 2015, 31(6): 996-998.
[23] PATEL D, KELL A, SIMARD B, et al. The cell labeling efficacy, cytotoxicity and relaxivity of copper-activated MRI/PET imaging contrast agents[J]. Biomaterials, 2011, 32(4): 1167-1176.
[24] YOON KT, KIM JK, KiIMDY, et al. Role of 18F-fluorodeoxyglucose positron emission tomography in detecting extrahepatic metastasis in pretreatment staging of hepatocellular carcinoma[J]. Oncology, 2007, 72(Suppl 1): 104-110.
[25] KUHN FP, CROOK DW, MADER CE, et al. Discrimination and anatomical mapping of PET-positive lesions: comparison of CT attenuation-corrected PET images with coregistered MR and CT images in the abdomen[J]. Eur J Nucl Med Mol Imaging, 2013, 40(1): 44-51.
[26] GONG L, WEI LX, REN P, et al. Dysplastic nodules with glypican-3 positive immunostaining: a risk for early hepatocellular carcinoma[J]. PLoS One, 2014, 9(1): e87120.
[27] FU SJ, QI CY, XIAO WK, et al. Glypican-3 is a potential prognostic biomarker for hepatocellular carcinoma after curative resection[J]. Surgery, 2013, 154(3): 536-544.
[28] DI TL, FRANCHI G, PARK YN, et al. Diagnostic value of HSP70, glypican 3, and glutamine synthetase in hepatocellular nodules in cirrhosis[J]. Hepatology, 2007, 45(3): 725-734.[29] DU JL, WEI LX, WANG YL. Expression and clinicopathologic significance of GPC3 and other antibodies in well-differentiated hepatocellular carcinoma[J]. Chin J Pathol, 2011, 40(1): 11-16.( in Chinese) 杜经丽, 韦立新, 王玉兰. 磷脂酰肌醇蛋白聚糖3等抗体在高分化肝细胞肝癌中的表达及其鉴别诊断意义[J]. 中华病理学杂志, 2011, 40(1): 11-16.
[30] KONDO F. Histological features of early hepatocellular carcinomas and their developmental process: for daily practical clinical application[J]. HepatolInt, 2009, 3(1): 283-293.
[31] PARK YN, KOJIRO M, DI TL, et al. Ductular reaction is helpful in defining early stromal invasion, small hepatocellular carcinomas, and dysplastic nodules[J]. Cancer, 2007, 109(5): 915-923.
[32] JEGO G, HAZOUME A, SEIGNEURIC R, et al. Targeting heat shock proteins in cancer[J]. Cancer Lett, 2010, 332(2): 275-285.
[33] LI RK. Expressions of HSP90α, HSP70, HSP60 incolon cancer tissue and the relationship between the expressions of HSP90α, HSP70, HSP60 and the extent of tissue differentiation[J]. J Clin Exp Med, 2015, 14(9): 721-723. (in Chinese) 李如凯. 结肠癌组织中的HSP90α、HSP70、HSP60表达及其与组织分化程度的关系[J]. 临床和实验医学杂志, 2015, 14(9): 721-723.
[34] CHUMA M, SAKAMOTO M, YAMAZAKI K, et al. Expression profiling in multistage hepatocarcinogenesis: identification of HSP70 as a molecular marker of early hepatocellular carcinoma[J]. Hepatology, 2003, 37(1): 198-207.
[35] KOEHNE de GONZALEZ AK, SALOMAO MA, LAGANA SM. Current concepts in the immunohistochemical evaluation of liver tumors[J]. World J Hepatol, 2015, 7(10): 1403-1411.
[36] LI L, WANG LN, HE BW, et al.Expression of CD34 in hepatocellular carcinoma and analysis of sinusoids[J].Shaanxi Med J, 2007, 36(5): 577-579.(in Chinese) 李莉, 王莉娜, 贺伯伟, 等. CD34在肝癌发生过程中的表达及肝窦毛细血管化分析[J]. 陕西医学杂志, 2007, 36(5): 577-579.
[37] YAO S, ZHANG J, CHEN H, et al. Diagnostic value of immunohistochemical staining of GP73, GPC3, DCP, CD34, CD31, and reticulin staining in hepatocellular carcinoma[J]. J Histochem Cytochem, 2013, 61(9): 639-648.
[38] PARKY N, CHAE KJ, KIM YB, et al. Apoptosis and proliferation in hepatocarcinogenesis related to cirrhosis[J]. Cancer, 2001, 92(11): 2733-2738.
[39] NIU ZS, NIU XJ, WANG M. Management of hepatocellular carcinoma: Predictive value of immunohistochemical markers for postoperative survival[J]. World J Hepatol, 2015, 7(1): 7-27.
引证本文:JIAO JZ, LI JT, YAN SG, et al. Current research status of precancerous dysplastic nodules in hepatocellular carcinoma[J]. J Clin Hepatol, 2017, 33(5): 974-978. (in Chinese) 焦俊喆, 李京涛, 闫曙光, 等. 肝细胞癌癌前异型增生结节的研究现状[J]. 临床肝胆病杂志, 2017, 33(5): 974-978.
(本文编辑:王 莹)
Current research status of precancerous dysplastic nodules in hepatocellular carcinoma
JIAOJunzhe,LIJingtao,YANShuguang,etal.
(ShaanxiUniversityofChineseMedicine,Xianyang,Shaanxi712000,China)
Dysplastic nodule (DN) is an important stage for precancerous hepatocellular carcinoma (HCC) lesions progressing to HCC and has a very high risk of canceration. According to the difference in atypia, DN is classified into low-grade DN (LGDN) and high-grade DN (HGDN). This article summarizes the pathological features, radiological features, and biomarkers of LGDN and HGDN, briefly describes the risk of the canceration of DN into HCC, and points out that it is necessary to enhance the knowledge of DN, the precancerous HCC lesions, in clinical physicians. DN screening to identify nodules with a high risk of canceration and related intervention help to prevent the development of HCC.
carcinoma, hepatocellular; dysplastic nodule; pathological conditions, signs and symptoms; biological markers; review
10.3969/j.issn.1001-5256.2017.05.039
2016-11-22;
2016-12-21。
国家自然科学基金(81603612);陕西省科技厅课题(2012SF2-11,2014K11-02-04-06,2016SF-234);陕西省中医药管理局课题(15-JC009);北京医学奖励基金会课题(YJHYXKYJJ-276)
焦俊喆(1993-),男,主要从事肝病相关研究。
李京涛,电子信箱:lijingtao555@163.com;常占杰,电子信箱:changzhanjie@163.com。
R735.7
A
1001-5256(2017)05-0974-05

