人心房肌细胞分离方法的改良研究*
王笑宇,范忠才,周 伟,余奕言,周 涛,李妙龄△
(1.西南医科大学附属医院心内科,四川泸州 646000;2.西南医科大学心血管医学研究所,四川泸州 646000)
人心房肌细胞分离方法的改良研究*
王笑宇1,范忠才1,周 伟1,余奕言2,周 涛1,李妙龄2△
(1.西南医科大学附属医院心内科,四川泸州 646000;2.西南医科大学心血管医学研究所,四川泸州 646000)
目的 探索改良的人心房肌细胞分离方法。方法 采用两步酶消化法急性分离人心房肌细胞,采用膜片钳全细胞记录技术记录小电导钙激活钾通道。结果 该分离方法可获得数量较多的心房肌细胞,窦性心律患者可获得完整有横纹细胞320±30,慢性房颤患者可获得完整有横纹细胞230±20,比较差异有统计学意义(P<0.01)。该方法可获得大量形态完整,横纹清晰的单个人心房肌细胞,且能在所分离的心房肌细胞上记录到典型的小电导钙激活钾通道电流。结论 该试验所采用的分离方法简便,稳定有效,可获得细胞数量多和细胞质量好的单个人心房肌细胞。
电学;肌细胞,心脏;人心房肌;分离方法;膜片钳;离子通道
采用单个心肌细胞进行心律失常发病机制的研究及抗心律失常药物靶点的筛选,是目前研究的热点。这些研究均需要以单个心肌细胞为研究对象,通过膜片钳技术检测离子通道的电流变化来阐明和证实。细胞活性正常是上述研究的根本。因此,分离的心肌细胞质量好是上述研究成功的重要保证。人体标本来源珍贵,探索完善的人心房肌细胞分离方法至关重要。随着电生理研究技术的深入进展,国内外的学者都对人心房肌细胞分离方法作了相应的报道,分离方法不断改善[1-6],但在实际操作中分离出符合试验要求的细胞却并非易事。现多采用两步酶解法分离心肌细胞,但液体pH值、酶浓度、消化时间等报道不一,获得的心肌细胞质量也有所差异。本实验室从事心房颤动电生理研究多年,对心肌细胞分离方法掌握熟练。经过理论和实践相结合,能够优化出一种更为有效的适合做膜片钳试验的细胞,并在单个心房肌细胞上可观察到功能正常的小电导钙激活钾通道电流(small-conductance calcium-activated potassium channels,ISK),现报道如下。
1 材料与方法
1.1 材料
1.1.1 病例资料 选取2015年6月至2016年6月在西南医科大学附属医院接受体外循环手术患者的新鲜右心耳组织。其中,窦性心律(SR)患者15例,慢性房颤(AF)患者13例。所有受试者均签署知情同意书,术前均行常规超声心动图检查。取材获得西南医科大学附属医院伦理委员会同意,所有试验程序遵照国内相关法规和政策。
1.1.2 主要试剂 V型胶原酶、XXIV型胶原酶、牛血清清蛋白、4-羟乙基哌嗪乙磺酸 (HEPES)、乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)、牛磺酸、腺苷、甘露醇、β-羧基丁酸、SK通道特异性阻断剂(apamin)均为Sigma公司产品,试剂均为国产分析纯。
1.1.3 主要溶液 试验中所用细胞分离液,包括(1)心肌转运液(牛黄酸 10 mmol/L,腺苷 5 mmol/L,硫酸镁8 mmol/L,HEPES 10 mmol/L,磷酸二氢钾50 mmol/L,甘露醇100 mmol/L,葡萄糖140 mmol/L,用氢氧化钾调pH值至 7.4);(2)介质液(氯化钠 137 mmol/L,牛磺酸 10 mmol/L,硫酸镁 1 mmol/L,磷酸二氢钾 5 mmol/L,HEPES 5 mmol/L,葡萄糖 10 mmol/L,用氢氧化钾调pH值至 7.4);(3)心肌细胞KB液 (牛磺酸10 mmol/L,β-羧基丁酸10 mmol/L,磷酸二氢钾10 mmol/L,氯化钾 20 mmol/L,HEPES 10 mmol/L,EGTA 10 mmol/L,甘露醇5 mmol/L,葡萄糖 25 mmol/L,谷氨酸钾 70 mmol/L,清蛋白 1 mg/mL,用氢氧化钾调pH值至 7.4);(4)记录离子通道的浴液(N甲基氨基葡萄糖 140 mmol/L,氯化钾 4 mmol/L,氯化镁 1 mmol/L,葡萄糖 5 mmol/L,HEPES 10 mmol/L,用盐酸调pH值至 7.4);(5)电极液 (葡萄酸钾144 mmol/L,氯化镁 1.55 mmol/L,HEPES 10 mmol/L,EGTA 5 mmol/L)。
1.2 方法
1.2.1 人体心房肌细胞的分离
1.2.1.1 准备工作 (1)打开水浴箱,保证水浴箱的温度恒定为37 ℃左右;(2)制备酶液Ⅰ(蛋白酶5~6 U/mL,胶原酶150 U/mL,牛血清清蛋白1 mg/mL,总量5 mL,用酶介质液配制),制备酶液Ⅱ(胶原酶150 U/mL,清蛋白1 mg/mL,总量20 mL,用酶介质液配制)分装于4个玻璃小瓶中(室温);(3)心肌转运液充氧约20 min,充氧饱和后转移入20 mL玻璃小瓶后置于冰桶中送往手术室,剩余心肌转运液放置于4 ℃以备后续洗涤组织块用。
1.2.1.2 转运组织 参考李妙龄等[1]的方法并加以改进,将体外循环手术中切除的右心耳组织置于充氧饱和冰冷的心肌转运液中。转运至实验室应该越快越好,不超过10 min为佳。如果转运过程不可避免时间延长,那么保存液的温度应维持在4 ℃[2]。
1.2.1.3 洗涤组织 (1)将组织与心肌转运液置入10 cm直径的培养皿中,洗涤血液和油脂,剔除心肌组织外膜及脂肪组织;(2)200~600 mg组织足够用于分离细胞[2];(3)在4 ℃心肌转运液中将组织剪成1 mm3左右的小块。(4)整个过程保证持续充氧,不超过3 min。
1.2.1.4 消化组织 分两步组成:(1)将剪碎的组织块置于酶液Ⅰ中进行消化,整个酶消化过程均要处于水浴箱内(37 ℃左右)。若室温较低可能影响酶消化细胞,因而保持较高室温。整个过程持续充氧。一般需要消化30~50 min,消化时间因酶量、组织块大小、组织性质、温度而不同。一般在20 min左右用巴氏吸管吸取酶液于倒置相差显微镜下观察,出现单个有横纹心肌细胞时,可终止酶液Ⅰ消化。向酶液Ⅰ中加入酶介质液,吹打洗涤后去除上清液,重复该步骤1~2次。(2)将组织块置于酶液Ⅱ中消化,保持37 ℃并持续充氧,这一过程氧气保持低速、平稳,不宜充氧过快,避免气流损伤细胞。消化3~4 min有细胞出现,一般在5~8 min时出现大量细胞,低倍视野(×100)下约10个细胞,且细胞横纹清楚,可终止酶消化。消化时间依情况而定,一般不超过10 min。在有细胞的前提下,消化时间宁短勿长,时间过长细胞易受损,不适合膜片钳试验。酶液Ⅱ消化后,用酶介质液洗涤轻柔吹打,收集上清液,将组织块再转移至酶液Ⅱ。酶液Ⅱ消化重复3次,且消化时间越来越短。
1.2.1.5 保存细胞 3次消化收集的酶液500 r/min离心5 min后去除上清液,加入KB液于4 ℃保存备用, 1 h后可用于电生理试验。
1.2.1.6 心肌细胞的计数 选取SR组心房肌8例和AF组心房肌8例进行细胞计数,吸取相同体积的KB液的细胞悬液于倒置相差显微镜下,每组获得的心房肌细胞在低倍镜下(×100)观察并计数。
1.2.1.7 心肌细胞形态的鉴定 在细胞计数的同时,按细胞形态分为杆状有横纹的细胞,横纹不清晰细胞及收缩成团的细胞。
1.2.1.8 心肌细胞的活力检测 采用台盼蓝染色方法鉴定心肌细胞的活力,试验中应用0.5 mL心房肌细胞悬液加入0.5 mL的台盼蓝溶液,充分混匀后在室温下静置5 min后用吸管吸取少量细胞悬液,注入计数板小室内。在倒置相差显微镜下观察心房肌细胞核染色情况。如细胞核未被染色,提示心肌细胞存活;如细胞核被染成蓝色,提示心肌细胞死亡。用SR组4例和AF组4例测定的平均值计算细胞存活率,心房肌细胞活力(%) =(细胞总数-着色细胞数)/细胞总数×100 %。
1.2.2 电生理记录 吸取细胞悬液静置于浴槽中,10 min后待细胞贴壁后加全细胞浴液灌流5~10 min。于倒置相差显微镜下寻找呈杆状、细胞膜完整、横纹清楚、无收缩、贴壁良好的心房肌细胞进行电生理试验。试验电极采用软质玻璃管,经横式拉制仪(P-97,shutter公司,美国)拉制而成。充灌电极液后电极阻抗2~5 MΩ。采用膜片钳放大器(EPC 10.0,HEKA公司,德国)记录电流信号,用Patch master软件采集数据存储于计算机中。采样频率为10 kHz,低通滤波频率为2 kHz。

2 结 果
2.1 人心房肌细胞的计数 从心脏外科体外循环所取的心房肌组织约70~90 mg,SR组可获得完整有横纹细胞320±30,AF组可获得完整有横纹细胞230±20,两组比较差异有统计学意义(P<0.05),均适合于做膜片钳试验,见图1。
2.2 心肌细胞活力的鉴定 SR组与AF组分离的心房肌细胞,分别为(74.5±4.9)%和(71.9±3.7)%,两组比较差异无统计学意义(P>0.05),见图1。

A:两组分离获得的细胞数;B:两组分离的细胞的存活率。
图1 两组分离的细胞数和细胞存活率比较
2.3 心肌细胞形态的鉴定 该方法分离的细胞多呈杆状,有分支,两端钝圆,横纹清晰。细胞直径10~30 μm,细胞长度约50~120 μm。分离的细胞按形态可分为以下几类:第1类,细胞膜光滑完整,折光性强,横纹清楚,无收缩,是试验首选,该类细胞占60%~70%;第2类,细胞膜光滑,折光性好,有横纹,不收缩,但细胞表面有1处或多处凹陷,这类细胞也能封接并记录电流,占10%;第3类,细胞膜不光滑,细胞不完整有破损,折光性差,无横纹,易收缩,占5%~10%;第4类,另有细胞收缩成团,约占10%。后两类细胞不符合试验要求。4 ℃低温保存的细胞可存活大于12 h,具有正常的细胞电生理特性。从SR组和AF组心房组织分离获得的单个心房肌细胞,SR组细胞横纹清晰,折光性好,AF组细胞的横纹欠清晰,见图2。
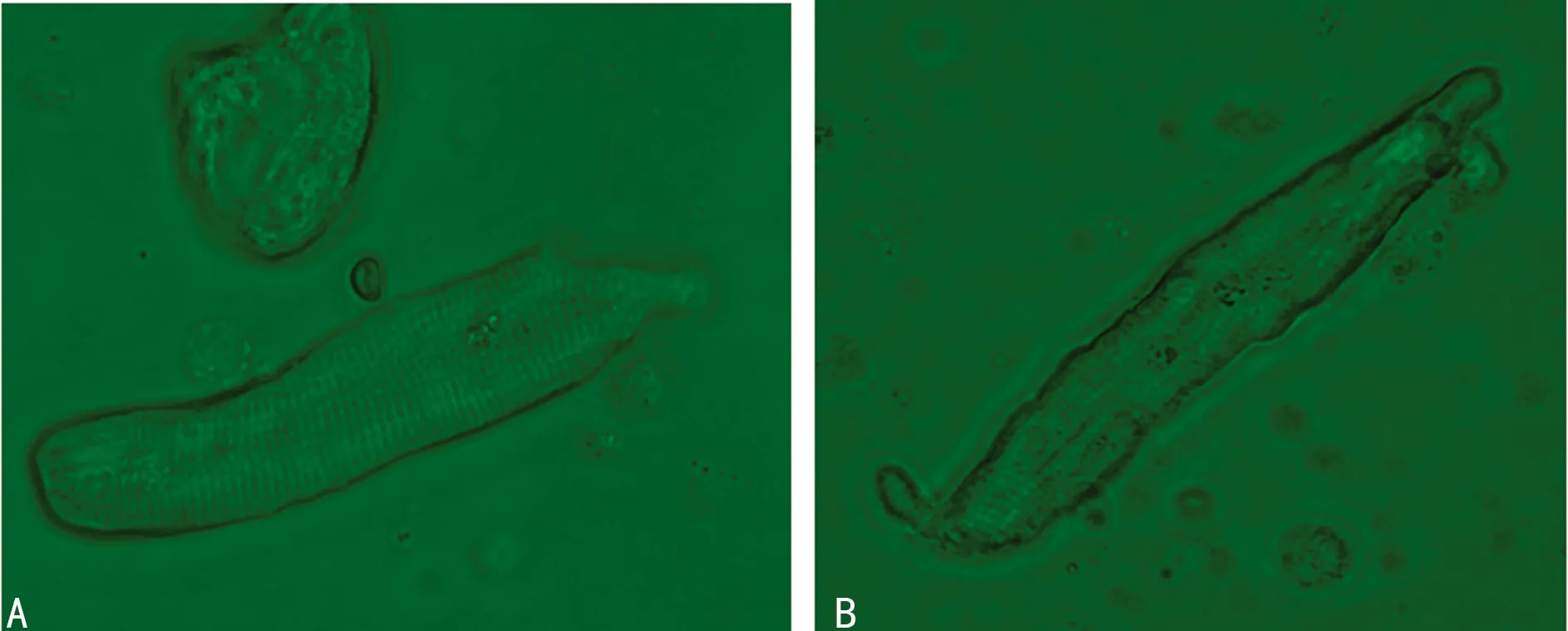
A:SR组;B:AF组。
图2 急性分离的人心房肌细胞(×400)
2.4 急性分离人心房肌细胞记录的小电导钙激活钾通道电流 本试验中电极内液的游离钙离子浓度为5×10-7mol/L,保证SK通道的激活。形成全细胞模式后,保持电位在-60 mV,指令电压从-130 mV去极化到+60 mV,持续200 ms,阶跃10 mV,可记录到一内向整流电流,在此基础上加入SK通道特异性阻断剂apamin后电流明显减小,加药前后相减的电流为SK通道电流。当指令电压在-130 mV时的电流幅值为-434 pA,加入Apamin后电流幅值为-270 pA,-130 mV的SK通道电流为-164 pA。给药前后的电流-电压关系曲线见图3,该电流具有明显的内向整流特性。
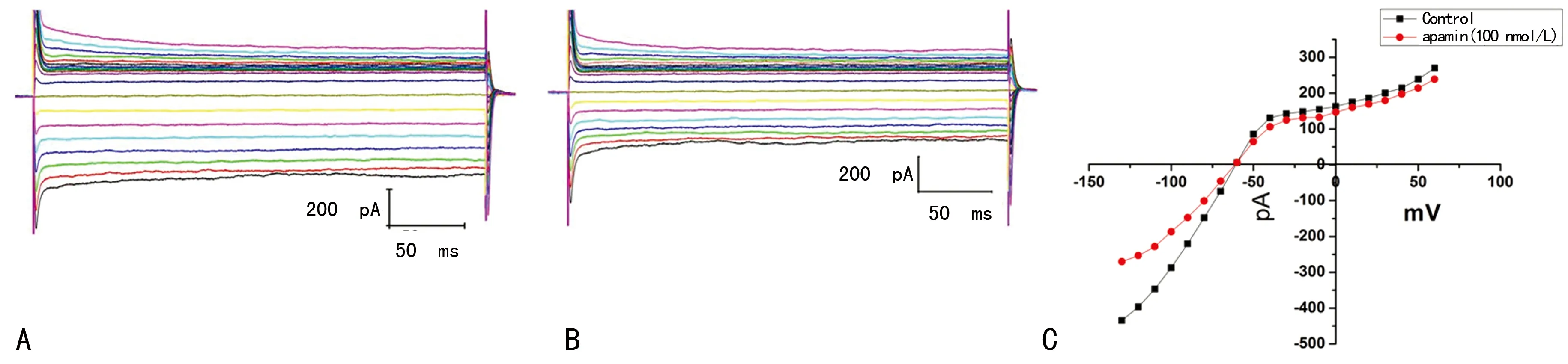
A:加apamin前;B:加apamin(100 nmol/L)后;C:SK通道的电流-电压关系曲线。
图3 人心房肌细胞上记录到的小电导钙激活钾通道
3 讨 论
采用人体心房样本进行试验具有较好的临床价值。人心房肌细胞的分离虽有较多的报道,但真正获得质量好活性正常的人心房肌细胞依然很有难度,因此获得功能正常的人心房肌细胞成为了后续很多试验的瓶颈。本文研究者从事心房肌细胞研究二十余年,通过该分离方法的改进,可以获得质量好,数量多的单个人心房肌细胞。分离细胞经常会遇到以下问题:细胞形态好,但耐钙能力差,在含钙的细胞外液中收缩死亡;耐钙但贴壁不良好,无法满足试验要求。
以上现象都与细胞质量不良和功能受损密切相关,本文提出的分离方法借鉴国内外科研者分离方法,依靠大量实践,从以下几方面严格控制条件[7]:(1)整个试验过程均需要氧饱和,转运组织至实验室这一过程由于无法充氧,要保证心肌转运液充氧充足;酶解细胞过程需维持在37 ℃;严格控制细胞分离液的pH值,分离液pH控制在7.2~7.4[8];本试验采用德国产的纯水仪(Millipore),符合试验要求:水电导在1 μs/cm以下。(2)分离时应尽量剔除结缔组织和脂肪组织,实践表明油脂和结缔组织影响酶解细胞的效果。组织块以1 mm3左右大小较佳,太大不利于酶消化。(3)酶浓度、类型、批次、保存温度、溶解程度都与分离效果有关[9-10]。根据不同年龄段的患者酶量作适当调整,调整幅度不超过10%。一般中老年患者酶量高于青年及幼儿患者。胶原酶的选择可能是分离细胞最关键的一步了。Worthington V型胶原酶已经成功分离出人心房肌细胞[11-17]。尽管Ⅱ性胶原酶也能分离出大量有活性符合试验要求的细胞,但根据实践还是推荐V型。即使在一个单一的胶原酶类型中也有不同批次表现出的显著酶活性不同。这些不同就要求研究者仔细挑选批次并测试不同批次以获得完美的分离过程。Worthington生化公司有在线可用的批次挑选工具。(http://www.worthington-biochem.com/cls/match.php)[18]。(4)严格控制消化时间,消化时间因酶量、组织块大小、患者年龄、温度有所不同。酶解过程中可能转瞬就会出现细胞,特别是酶液Ⅱ消化过程,出现大量细胞应立即中止,避免过度消化而致细胞状态不好。(5)吹打细胞应轻柔,特别是酶液Ⅱ消化阶段和离心后,尽量保持细胞的完整性。(6)早在1970年就已经发现肌细胞在含钙环境中分解,所有的细胞会挛缩或没有活性。因此分离细胞要在无钙中完成。但是生理浓度的钙离子重新引入会引起钙快速内流而致细胞死亡。这被称为“钙离子悖论现象”。改善分离环境包括通过添加牛磺酸降低pH到7.0,,还有将分离的细胞保存在配有EGTA的保存液中,这些都可以防止上述现象发生。
本试验参考李妙龄等[1]的方法,进行了改进。本方法的优点在于省略了EGTA脱钙的过程,也不需要过滤。酶用量少,对细胞损伤小。每次用蛋白酶2.5 mg,胶原酶4.5 mg。消化时间缩短,一般酶液Ⅰ消化30~40 min,酶液Ⅱ不超过10 min。酶液Ⅰ出现有横纹细胞就终止消化,保证了细胞的质量,这是实践总结。分离出的细胞有收缩成团的,但60%~70%符合试验要求,在含钙细胞外液中能够存活,可保存12 h左右。
细胞的完整性和正常的生理功能是试验的基础,应用该方法分离出的细胞可封接并且能记录到ISK电流,表明这种方法是能分离出符合膜片钳要求的细胞,具有可重复性,有利于心肌细胞相关疾病的电生理试验研究。
[1]李妙龄,曾晓荣,杨艳,等.一种改进的人体心房肌细胞分离方法[J].生理学报,2007,59(6):858-864.
[2]Voigt N,Zhou XB,Dobrev D.Isolation of human atrial myocytes for simultaneous measurements of Ca2+transients and membrane currents[J].J Vis Exp,2013(77):e50235.
[3]张荣庆,梁延春,周更须.国人单个心房肌细胞的分离及活性鉴定[J].第四军医大学学报,2000,22(2):188-190.
[4]Tian M,Dong MQ,Chiu SW,et al.Effects of the antifungal antibiotic clotrimazole on human cardiac repolarization potassium currents[J].Br J Pharmacol,2006,147(3):289-297.
[5]Cerbai E,Sartiani L,De Paoli P,et al.Isolated cardiac cells for electropharmacologieal studies[J].Pharmacol Res,2000,42(1):1-8.
[6]Voigt N,Pearman CM,Dobrev D,et al.Methods for isolating atrial cells from large mammals and humans[J].J Mol Cell Cardiol,2015(86):187-98.
[7]Bonilla IM,Sridhar A,Nishijima Y,et al.Differential effects of the peroxynitrite donor,SIN-1,on atrial and ventricular myocyte electrophysiology[J].J Cardiovasc Pharmacol,2013,61(5):401-407.
[8]Harleton E,Besana A,Comas GM,et al.Ability to induce atrial fibrillation in the peri-operative period is associated with phosphorylation-dependent inhibition of TWIK protein-related acid-sensitive potassium channel 1 (TASK-1) [J].J Biol Chem,2013,288(4):2829-2838.
[9]McCarthy RC,Breite AG,Green ML,et al.Tissue dissociation enzymes for isolating human islets for transplantation:factors to consider in setting enzyme acceptance criteria[J].Transplantation,2011,91(2):137-145.
[10]Martins RP,Kaur K,Hwang E,et al.Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation[J].Circulation,2014,129 (14):1472-1482.
[11]Dobrev D,Wettwer E,Himmel HM,et al.G-Protein beta(3)-subunit 825T allele is associated with enhanced human atrial inward rectifier potassium currents[J].Circulation,2000,102(6):692-697.
[12]Voigt N,Friedrich A,Bock M,et al.Differential phosphorylation dependent regulation of constitutively active and muscarinic receptor-activated IK,ACh channels in patients with chronic atrial fibrillation[J].Cardiovasc Res,2007,74(3):426-37.
[13]Voigt N,Rozmaritsa N,Trausch A,et al.Inhibition of IK,ACh current may contribute to clinical efficacy of class Ⅰ and class Ⅲ antiarrhythmic drugs in patients with atrial fibrillation[J].Naunyn Schmiedebergs Arch Pharmacol,2010,381(3):251-259.
[14]Dobrev D,Friedrich A,Voigt N,et al.The G protein-gated potassium current Ⅰ(K,ACh) is constitutively active in patients with chronic atrial fibrillation[J],Circulation,2005,112(24):3697-3706.
[15]Voigt N,Trausch A,Knaut M,et al.Left-to-right atrial inward rectifier potassium current gradients in patients with paroxysmal versus chronic atrial fibrillation [J].Circ Arrhythm Electrophysiol,2010,3(5):472-480.
[16]Amos GJWettwer E,Metzger F,et al.Differences between outward currents of human atrial and subepicardialventricular myocytes [J].J Physiol,1996,491(1):31-50.
[17]Feng J,Xu D,Wang Z,et al.Ultrarapid delayed rectifier current inactivation in human atrial myocytes:properties and consequences[J].Am J Physiol,1998,275(5):H1717-1725.
[18]Xu GJ,Gan TY,Tang BP,et al.Alterations in the expression of atrial calpains in electrical and structural remodeling during aging and atrial fibrillation[J].Mol Med Rep,2013,8(5):1343-1352.
An improved method for isolation of human atrial cardiomyocytes*
WangXiaoyu1,FanZhongcai1,ZhouWei1,YuYiyan2,ZhouTao1,LiMiaoling2△
(1.DepartmentofCardiology,theAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou,Sichuan646000,China; 2.KeyLaboratoryofMedicalElectrophysiology,MinistryofEducationofChina,InstituteofCardiovascularResearch,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
Objective To study an improved isolated method of single human atrial myocytes.Methods Enzyme digestion method was used to isolate single myocytes from human atrial and whole-cell patch clamp technique was used to record small conductance calcium activated potassium current.Results This method obtained a large number of atrial myocytes.The total amount of atrial myocytes in SR group was 320±30 while AF group was 230±20 and the difference was statistically significant(P<0.01).In this study,a large number of simple and striated single atrial myocytes were obtained,and a typical small-conductance calcium-activated potassium channel current was recorded on the isolated atrial myocytes.Conclusion The established isolated method is simple,stable and effective.We can acquire a large amount of single atrial myocytes with good quality.
electricity;myocytes,cardiac;human atria myocytes;isolated method;patch-clamp technique;ionic channel
术与方法·
10.3969/j.issn.1671-8348.2017.14.023
国家自然科学基金资助项目(81470022);四川省教育厅重点项目(16ZA0192);泸州市-泸州医学院联合项目(20140975)。 作者简介:王笑宇(1990-),在读硕士,主要从事心血管内科方面研究。△
,E-mail:limiaolingcc@163.com。
R972.4
A
1671-8348(2017)14-1941-03
2017-02-08
2017-03-26)

