低浓度雷公藤甲素联合顺铂对肝癌细胞HepG2活性的影响
赵东晓 陈弘磊 孟冠敏 李芳琼 王伟
低浓度雷公藤甲素联合顺铂对肝癌细胞HepG2活性的影响
赵东晓1陈弘磊2孟冠敏2李芳琼2王伟2
目的探讨低浓度雷公藤甲素与顺铂联合用药对人肝癌细胞HepG2活性的影响,及其逆转顺铂耐药的可能机制。方法将人肝癌细胞HepG2分为顺铂单用组和雷公藤甲素加顺铂联合用药组。顺铂单用组分别用浓度为0、2.5、5、10、20、40μg/mL的顺铂处理,联合用药组同时联合低浓度雷公藤甲素(12.5ng/mL)处理HepG2。CCK-8法检测HepG2细胞增殖的抑制率;流式细胞术检测细胞凋亡率和细胞内P糖蛋白的表达。结果顺铂单用组各浓度(0、2.5、5、10、20、40μg/mL)对肝癌细胞HepG2细胞活力24h的抑制率分别为0、(4.0±1.0)%、(9.7±1.1)%、(29.4±2.4)%、(47.5±2.5)%、(62.9±1.2)%,联合用药组24h抑制率分别为(4.7±1.0)%、(37.1±3.1)%、(44.1±3.5)%、(57.9±3.0)%、(66.9±2.0)%、(74.9±2.0)%,两组比较,细胞活力抑制率差异有统计学意义(P<0.01);Annexin V/PI双染法检测细胞凋亡后发现,顺铂单用组(0、5、10、40μg/mL)诱导HepG2肝癌细胞早期凋亡率分别为(4.3±0.3)%、(8.4±0.3)%、(9.6±0.3)%、(32.3±2.0)%,而联合用药组细胞早期凋亡率分别增加至(9.6±0.4)%、(16.2±0.2)%、(23.2±0.5)%、(53.0±3.6%),两组比较,细胞凋亡率差异有统计学意义(P<0.01);PE单染检测P糖蛋白后发现,顺铂单用组(0、5、10、40μg/mL)细胞内P糖蛋白表达率分别为(37.3±0.4)%、(34.2±0.5)%、(30.1±1.1)%、(34.2±2.3)%,无明显变化,而联合用药组P糖蛋白的表达率分别降低至(25.0±1.8)%、(18.6±0.7)%、(8.9±0.3)%、(1.8±0.1)%,两组P糖蛋白表达差异有统计学意义(P<0.01)。结论雷公藤甲素与顺铂联合用药可以显著抑制人肝癌HepG2的增殖并诱导凋亡,同时调节HepG2的顺铂耐药性,其作用机制可能与P糖蛋白下调相关,从而对肝癌细胞HepG2发挥抗肿瘤作用。
肝癌细胞;HepG2;雷公藤甲素;顺铂;耐药;P糖蛋白
肝癌是死亡率仅次于胃癌、食道癌的第三大常见恶性肿瘤。肝癌患者对于化疗药物的耐药是导致治疗失败、影响肝癌治愈率和远期生存率的主要原因[1]。顺铂作为肝癌的基本化疗药,是一种作用于细胞周期的非特异性药物,但易产生耐药性,其有效率只有20%~40%[2]。研究证明,由多药耐药蛋白P糖蛋白(P-glycoprotein,P-gp)介导的药物泵出增多、细胞内药物浓度降低在多种抗肿瘤药物耐药中存在,顺铂耐药也与P-gp的表达有着一定的关系[3]。雷公藤甲素(triptolide,TP)是从雷公藤中提取的活性较高的环氧二萜内酯化合物,具有良好的抗炎和抗肿瘤效果,它与目前临床应用的一些抗肿瘤药物具有协同效应,可以多靶点、多途径、交叉发挥抗肿瘤作用[4-5]。联合用药可以降低化疗药的使用量,且在保证疗效的同时,减少化疗后的不良反应,提高癌症患者的生活质量。本文研究低浓度雷公藤甲素与顺铂联合用药对人肝癌细胞HepG2活性的影响,并探讨其联合用药能否降低或逆转肝癌细胞HepG2的顺铂耐药性。
1 实验材料
1.1 细胞株及其培养肝癌细胞株HepG2由浙江省医学科学院提供,生长于含有10%小牛血清的DMEM高糖培养基;置37℃湿度饱和,含有5%CO2的培养箱中培养。
1.2 试剂与仪器雷公藤甲素购于上海源叶生物有限公司,纯度>98%(批号YY90104);顺铂购于南京制药厂有限公司(批号H20103216);胎牛血清购于杭州四季青生物工程有限公司(批号141013);DMEM高糖培养基购于美国Gibco公司(批号1694270);胰蛋白酶购于吉诺生物医药技术有限公司(批号15111801);双抗(青霉素和链霉素混合液)购于天津市灏洋生物制品科技有限责任公司(批号:20150624-078);Cell Counting Kit-8(CCK-8)购于东仁化学科技(上海)有限公司(批号GC762);Annexin V-FITC细胞凋亡试剂盒购于北京康为世纪生物科技有限公司(批号00101507);PE Mouse Anti-Human P-glycoprotein购于BD pharmingen公司(批号4269786);其它试剂均为国产或进口,纯度为分析纯。
2 实验方法
2.1 CCK-8法测定细胞活力将HepG2细胞接种于96孔板中,待细胞完全贴壁后,顺铂单用组分别加入顺铂0、2.5、5、10、20、40μg/mL,联合用药组再分别加12.5ng/mL的雷公藤甲素,共12个组,每组设3个复孔,每孔总体积200μL,培养24、48h,另设对照组不加药物培养。之后每孔加入20μL的CCK-8,继续培养3h,酶标仪570nm波长下测定吸光度(OD)值。细胞生长抑制率按以下公式计算:抑制率(%)=(对照组OD值-药物组OD值)/对照组OD值× 100%。
2.2 细胞凋亡检测在HepG2细胞中加入0、5、10、40μg/mL的顺铂或12.5ng/mL的雷公藤甲素单独及联合用药,对照组不加药物,培养24h。收集细胞,按照说明书将Annexin-V和PI加入细胞中孵育20min后,采用流式细胞术检测肿瘤细胞的凋亡。凋亡率为Annexin-V阳性细胞占所有细胞的比例。
2.3 细胞内P-gp表达的检测细胞分组、培养、加药同细胞凋亡检测步骤,不同加药处理的细胞均培养24h后收集细胞,按照说明书加入10μL PE Mouse Anti-Human P-glycoprotein后孵育15min,采用流式细胞仪检测P-gp百分比。
2.4 统计学方法每个实验重复3次,实验数据用均数±标准差() 表示,应用SPSS19.0统计软件进行处理,采用非配对双边t检验以及单因素方差分析,以P<0.05为差异有统计学意义。
3 实验结果
3.1 细胞增殖抑制试验顺铂和低浓度雷公藤甲素对人肝癌HepG2细胞均具有不同程度的抑制增殖作用,低浓度(12.5ng/mL)雷公藤甲素与顺铂联合用药后对细胞的抑制增殖作用更强,随着顺铂浓度的增加和作用时间的延长抑制率呈明显上升趋势。顺铂单用组与联合用药组细胞活力抑制率比较差异有统计学意义(P<0.01),顺铂和雷公藤甲素两药联用有较好的协同作用,见表1~2。
表1 两组HepG2肿瘤细胞抑制作用比较()
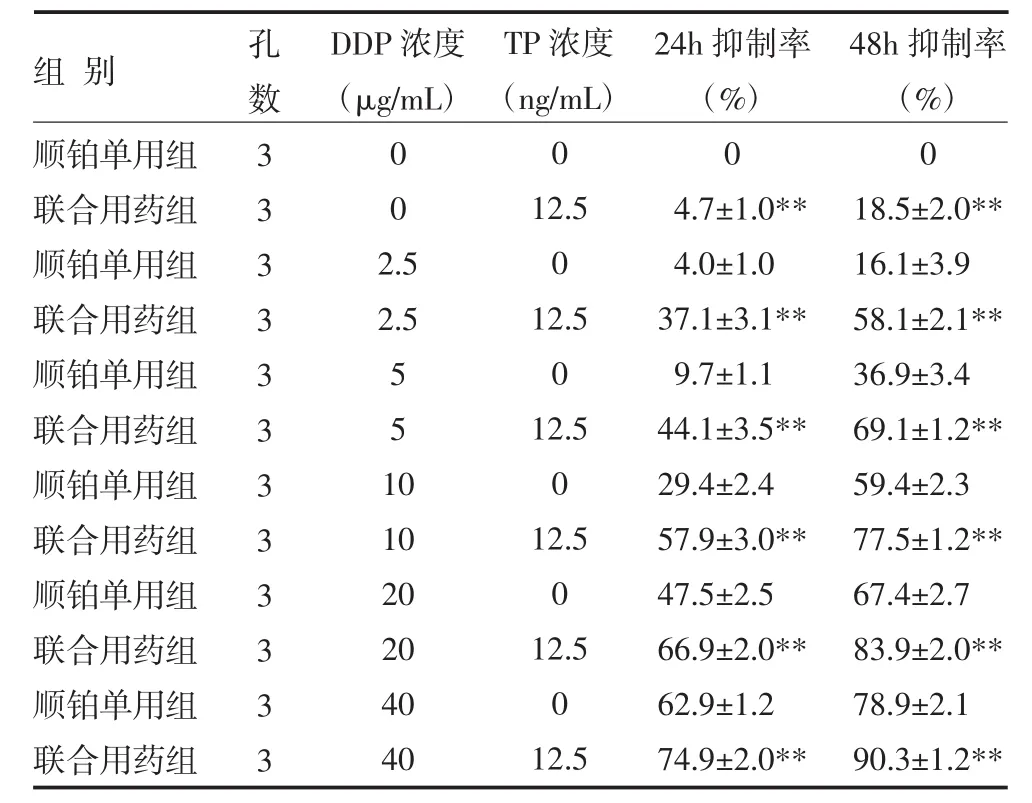
表1 两组HepG2肿瘤细胞抑制作用比较()
注:与顺铂单用组比较,**P<0.01;DDP:顺铂;TP:雷公藤甲素
组别顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组孔数3 3 3 3 3 3 3 3 3 3 3 3 DDP浓度(μg/mL)0 0 2.5 2.5 5 5 1 0 10 20 20 40 40 TP浓度(ng/mL)0 12.5 0 12.5 0 12.5 0 12.5 0 12.5 0 12.5 24h抑制率(%)0 4.7±1.0** 4.0±1.0 37.1±3.1** 9.7±1.1 44.1±3.5** 29.4±2.4 57.9±3.0** 47.5±2.5 66.9±2.0** 62.9±1.2 74.9±2.0** 48h抑制率(%)0 18.5±2.0** 16.1±3.9 58.1±2.1** 36.9±3.4 69.1±1.2** 59.4±2.3 77.5±1.2** 67.4±2.7 83.9±2.0** 78.9±2.1 90.3±1.2**

表2 CCK-8方差分析表
3.2 细胞凋亡试验采用Annexin V/PI双染法流式细胞仪检测细胞的凋亡情况,Annexin V+/PI(-)表示早期凋亡细胞,Annexin V+/PI(+)表示晚期凋亡细胞。用浓度分别为5、10、40μg/mL的顺铂对人肝癌细胞HepG2作用24h后均可引起HepG2细胞的凋亡(P<0.01);加入12.5ng/mL的雷公藤甲素与顺铂联合用药24h后,人肝癌细胞HepG2的凋亡比单独顺铂用药更显著,两组细胞凋亡率比较差异有统计学意义(P<0.01),见表3~4。
表3 两组HepG2细胞凋亡率比较()
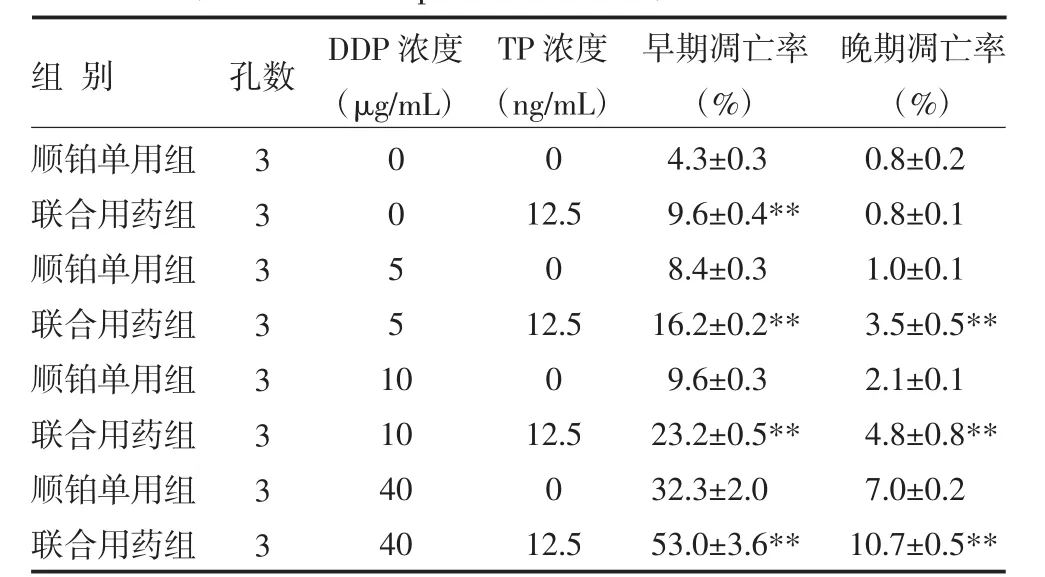
表3 两组HepG2细胞凋亡率比较()
注:与顺铂单用组比较,**P<0.01;DDP:顺铂;TP:雷公藤甲素
组别顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组孔数DDP浓度(μg/mL)3 3 3 3 3 3 3 3 0 0 5 5 1 0 10 40 40 TP浓度(ng/mL)0 12.5 0 12.5 0 12.5 0 12.5早期凋亡率(%)4.3±0.3 9.6±0.4** 8.4±0.3 16.2±0.2** 9.6±0.3 23.2±0.5** 32.3±2.0 53.0±3.6**晚期凋亡率(%)0.8±0.2 0.8±0.1 1.0±0.1 3.5±0.5** 2.1±0.1 4.8±0.8** 7.0±0.2 10.7±0.5**
3.3 P糖蛋白(P-gp)的表达用浓度分别为5、10、40μg/mL的顺铂对耐顺铂人肝癌细胞HepG2作用24h后,随着顺铂浓度的增加,P-gp的表达没有发生明显变化。加入浓度为12.5ng/mL雷公藤甲素后,与顺铂联合用药24h,采用流式细胞仪检测荧光强度检测P-gp表达。结果表明,雷公藤联合顺铂联合用药可以降低P-gp表达,并且随着顺铂浓度的增加,P-gp表达逐渐减弱,两组间细胞P-gp表达比较差异有统计学意义(P<0.01),见表5~6。
表4 细胞凋亡检测方差分析表
表5 两组HepG2细胞内P-gp表达率比较(

表5 两组HepG2细胞内P-gp表达率比较(
注:与顺铂单用组比较,**P<0.01;DDP:顺铂;TP:雷公藤甲素;P-gp:多药耐药蛋白;P-gp:P糖蛋白
组别顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组顺铂单用组联合用药组P-gp表达(%)37.3±0.4 25.0±1.8** 34.2±0.5 18.6±0.7** 30.1±1.1 8.9±0.3** 34.2±2.3 1.8±0.1**孔数DDP浓度(μg/mL)3 3 3 3 3 3 3 3 0 0 5 5 1 0 10 40 40 TP浓度(ng/mL)0 12.5 0 12.5 0 12.5 0 12.5

表6 P-gp表达方差分析表
4 讨论
肝癌是临床上最常见的恶性肿瘤之一,肝癌患者对于化疗药物的耐药是导致治疗失败、影响肝癌治愈率和远期生存率的主要原因。顺铂是肝癌的基本化疗药,长期大剂量应用顺铂常造成严重的肾损伤,且肝癌细胞逐渐耐药,失去对顺铂的敏感性[6]。
雷公藤甲素对多种肿瘤细胞具有较强的抑制作用,能明显抑制癌细胞的增殖和侵袭,其与顺铂联合用药可以逆转某些癌细胞的顺铂耐药性,如膀胱癌[7]、卵巢癌[8]、胰癌[9]和胃癌[10]等,增强其治疗效率。而顺铂和雷公藤甲素的抗癌机制不同,它们从不同方面影响肿瘤细胞的增殖和凋亡,由于两药都有毒副作用,故我们考虑是否能通过两药联用,在减少剂量的同时不减弱疗效,有效解决顺铂的耐药现象。考虑到当药物作用时间太长或者药物浓度太高时,细胞存活率普遍较低,无法体现药物的作用效果,故在药物联合用药中,选用顺铂的浓度为5、10、40μg/mL,雷公藤甲素浓度为12.5ng/mL。本研究中我们发现,无论作用24h还是48h,联合用药对HepG2细胞生长的抑制作用均比顺铂单药用药显著增强,表明低剂量的雷公藤甲素可以加强顺铂对肝癌HepG2细胞的细胞毒作用(P<0.01)。
肿瘤细胞对凋亡的耐受是也是肿瘤多药耐药的重要机制之一。肿瘤细胞的抗药性可阻止肿瘤细胞死亡程序,导致癌细胞的生存和治疗失败[11-12]。本研究发现,联合用药能够引起肝癌HepG2细胞的凋亡,呈现出明确的浓度依赖性,与顺铂单药用药比较,差别有统计学意义(P<0.01)。这一结果说明,雷公藤甲素对HepG2细胞化疗耐受的抑制作用可能是通过诱导其凋亡实现的。
膜转运蛋白是介导各种肿瘤及细菌多药耐药的最经典机制,也是目前研究较透彻的机制之一,其中P-gp外排泵的研究最为深入和广泛。P-gp能够转运诸如蒽环类、长春碱类、紫杉烷类以及表鬼臼毒素类等多数抗肿瘤药物,在多种人类肿瘤中引起了先天性与获得性的多药耐药作用[13-15]。因此,下调P-gp的功能与表达可以对P-gp相关的肿瘤多药耐药作用产生逆转,进而增加肿瘤对化疗药物的疗效。本研究发现,单用顺铂对P-gp的表达没有明显影响,而加入浓度为12.5ng/mL的雷公藤甲素与顺铂联合用药24h后,P-gp的表达随着药物浓度的增加明显减弱,说明雷公藤甲素可以逆转顺铂的耐药现象,差异有统计学意义(P<0.01)。P-gp低表达可能是雷公藤甲素诱导肝癌细胞HepG2逆转顺铂耐药的机制之一。
本研究证实低浓度雷公藤甲素联合顺铂可明显抑制肝癌细胞增殖,诱导肝癌细胞凋亡,逆转肝癌化疗多药耐药,其作用机制与抑制P-gp的表达相关。提示雷公藤甲素可能提高顺铂肝癌治疗疗效,为雷公藤甲素成为新型抗肿瘤药提供一定的理论及实验依据。但中医药抗肿瘤是多靶点、多途径的,是否还存其它靶点,有待今后进一步研究。
[1]MLynarsky L,Menachem Y,Shibolet O.Treatment of hepatocellular carcinoma:Steps forward but still a long way to go[J].World J Hepatol,2015,7(3):566-574.
[2]Shaaban S,Negm A,Ibrahim EE,et al.Chemotherapeutic agents for the treatment of hepatocellular carcinoma:efficacy and mode of action[J].Oncol Rev,2014,8(1):25-35.
[3]Liu XY,Liu SP,Jiang J,et al.Inhibition of the JNK signaling pathway increases sensitivity of hepatocellular carcinoma cells to cisplatin by down-regulating expression of P-glycoprotein[J].Eur Rev Med Pharmacol Sci,2016,20(6):1098-1108.
[4]Bukhari SN,JantanI,SeyedMA.Effects of Plants and Isolates of Celastraceae Family on Cancer Pathways[J]. Antica-ncer Agents Med Chem,2015,15(6):681-693.
[5]Wang CY,Bai XY,Wang CH.Traditional Chinese medicine:a treasured natural resource of anticancer drug research and development[J].Am J Chin Med,2014,42(3):543-559.
[6]Mazzanti R,Arena U,Tassi R.Hepatocellular carcinoma:Where are we[J].World J Exp Med,2016,6(1):21-36.
[7]Ho JN,Byun SS,Lee S,et al.Synergistic antitumor effect of triptolide and Cisplatin in Cisplatin resistant human bladder cancer cells[J].J Urol,2015,193(3):1016-1022.
[8]Zhong YY,Chen HP,Tan BZ,et al.Triptolide avoids cisplatin resistance and induces apoptosis via the reactive oxygen species/nuclear factor-κB pathway in SKOV3 platinum-resistant human ovarian cancer cells[J].Oncol Lett,2013,6(4):1084-1092.
[9]Zhu W,Li J,Wu S,et al.Triptolide cooperates with Cisplatin to induce apoptosis in gemcitabine-resistant pancreatic cancer[J].Pancreas,2012,41(7):1029-1038.
[10]Li CJ,Chu CY,Huang LH,et al.Synergistic anticancer activity of triptolide combined with cisplatin enhances apoptosis in gastric cancer in vitro and in vivo[J].Cancer Lett,2012,319(2):203-213.
[11]Mohammad RM,Muqbil I,Lowe L,et al.Broad targeting of resistance to apoptosis in cancer[J].Semin Cancer Biol,2015,35 Suppl:S78-103.
[12]Meng C,Zhu H,Song H,et al.Targets and molecular mechanisms of triptolide in cancer therapy[J].Chin J Cancer Res,2014,26(5):622-626.
[13]Wang ZC,Liu LZ,Liu XY,et al.Genetic polymorphisms of the multidrug resistance 1 gene MDR1 and the risk of hepatocellular carcinoma[J].Tumour Biol,2015,36(9):7007-7015.
[14]Hung TH,Li YH,Tseng CP,et al.Knockdown of c-MET induced apoptosis in ABCB1-overexpressed multidrug-resistance cancer cell lines[J].Cancer Gene Ther,2015,22(5):262-270.
[15]Chen BW,Chen W,Liang H,et al.Inhibition of mTORC2 Induces Cell-Cycle Arrest and Enhances the Cytotoxicity of Doxorubicin by Suppressing MDR1 Expression in HCC Cells[J].Mol Cancer Ther,2015,14(8):1805-1815.
(收稿:2016-08-30修回:2016-11-20)
Effect of Low Concentration of Triptolide Combined with Cisplatin on the Activity of Liver Cancer HepG2 Cells
ZHAO Dongxiao1,CHEN Honglei2,MENG Guanmin2,LI Fangqiong2,WANG Wei2.
1 College of Medical Technology,Zhejiang Chinese Medical University,Hangzhou(310053),China;2 Department of Clinical Laboratory, Tongde Hospital of Zhejiang Province,Hangzhou(310012),China
ObjectiveTo investigate the synergistic effect of combination regimen of triptolide and cisplatin and to explore its chemo-resistance reversal mechanism in human liver cancer cell line HepG2.MethodsThe HepG2 cells were divided to two groups:cisplatin group(2.5,5,10,20,40μg/mL)and triptolide(12.5ng/mL)combined cisplatin group.The CCK-8 test was used to estimate the inhibition of cell proliferation.Flow cytometry was applied to analyze the cell apoptosis and the expression of P-glycoprotein.ResultsCompared with the single cisplatin treated group, triptolide combined with cisplatin depressed the proliferation of HepG2 cells significantly.Cell viability inhibitory rate of HepG2cells in cisplatin group were0,(4.0±1.0)%,(9.7±1.1)%,(29.4±2.4)%,(47.5±2.5)%,(62.9±1.2)%, and combination therapy increased the inhibition rate to(4.7±1.0)%,(37.1±3.1)%,(44.1±3.5)%,(57.9±3.0)%,(66.9±2.0)%,(74.9±2.0)%,with a significant difference among them(P<0.01).Triptolide combined with different doses of cisplatin(0,5,10,40μg/mL)significantly induced cell apoptosis in HepG2.The rate of cell apoptosis was increased from(4.3±0.3)%,(8.4±0.3)%,(9.6±0.3)%,(32.3±2.0)%to(9.6±0.4)%,(16.2±0.2)%,(23.2±0.5)%,(53.0±3.6)%,respectively,with a significant difference among them(P<0.01).After combined use of triptolide,theexpression of P-glycoprotein was decreased from(37.3±0.4)%,(34.2±0.5)%,(30.1±1.1)%,(34.2±2.3)%in cisplatin group to(25.0±1.8)%,(18.6±0.7)%,(8.9±0.3)%,(1.8±0.1)%,with a significant differenceamong groups(P<0.01).ConclusionTriptolide combined with cisplatin could substantially suppress proliferation,induce apoptosis on HepG2 cellsand modulate cisplatin resistance of the human liver cancer cell line HepG2.The mechanism maybe related to the decrease of P-glycoprotein expression.
liver cancer cell;HepG2;triptolide;cisplatin;drug resistance;P-glycoprotein
浙江省科技计划项目(No.2014F10014)
1浙江中医药大学医学技术学院(杭州310053);2浙江省立同德医院检验科(杭州310012)
王伟,Tel:13857101427;E-mail:wangweihz8@163.com

