运动疲劳引起纹状体突触超微结构变化及D2DR介导的行为学干预研究
侯莉娟,成佳俐,王晓昕,张 飒,刘晓莉,乔德才
HOU Li-juan1,CHENG Jia-li1,WANG Xiao-xin1,ZHANG Sa2,LIU Xiao-li1,QIAO De-cai1
运动疲劳引起纹状体突触超微结构变化及D2DR介导的行为学干预研究
侯莉娟1,成佳俐1,王晓昕1,张 飒2,刘晓莉1,乔德才1
HOU Li-juan1,CHENG Jia-li1,WANG Xiao-xin1,ZHANG Sa2,LIU Xiao-li1,QIAO De-cai1
运动疲劳是体育运动中普遍存在的生理现象,也是影响运动员成绩水平的关键因素。1891年,Mosso教授最先开始“疲劳”的研究,提出“肌肉疲劳是独立于神经系统的外周现象”、“代谢产物二氧化碳和乳酸是降低肌肉收缩能力的主要因素”、“疲劳是机体自我保护的警觉信号”等假说[14]。1982年,第5届国际运动生物化学会议将其定义为“机体生理过程不能持续其机能在一特定水平或不能维持预定的运动强度”。近年来,随着神经科学理论和神经科学技术的迅速发展,实验证实,中枢神经系统(central nervous system,CNS)在运动疲劳产生中起到重要的调节作用,如运动疲劳后神经传导速度降低,中枢五羟色胺(5-hydroxy tryptamine,5-HT)神经递质浓度增加,大脑皮层神经元兴奋性降低[11,23,36]等,并提出“运动疲劳是大脑保护性抑制的结果”、“运动疲劳导致肌肉收缩能力的下降是CNS不能发放有效驱动的结果”,推测运动疲劳产生机制与大脑皮层及基底神经节等神经元电活动改变有关[35,42]。
基底神经节是大脑皮层下神经核团的总称,主要包括纹状体、苍白球、黑质和丘脑底核等[2],通过直接通路、间接通路和超直接通路实现运动功能调控。其中,纹状体是基底神经节运动信息的主要输入核团[9],在运动调控中扮演重要角色。纹状体根据功能及神经元投射关系分为背侧部和腹侧部,背侧纹状体又分为背内侧部(dorsomedial striatum,DMS)与背外侧部(dorsolateral striatum,DLS)[38,41,44]。DMS对目的性行为的获得与执行至关重要[45],而接受前额皮层感觉运动区投射的DLS,对学习行为和习惯性行为调控至关重要。DLS损毁后主体具有目的性行为能力,但习惯性行为反应受到阻碍[17]。DLS接受黑质致密部(substantia nigra pars compacta,SNc)DA(dopamine,DA)能纤维投射,构成黑质-纹状体DA能通路,对直接通路/间接通路的兴奋/抑制起调节作用[40]。
当有运动疲劳发生时,机体不仅出现运动能力的下降,同时也伴随技术动作的失误,以及协调性、灵活性及精确性等降低[13,20]。提示,运动疲劳发生时,黑质-纹状体DA神经系统对直接通路和间接通路的调节平衡被打破,机体运动控制功能受到影响。本实验室前期实验观察到运动疲劳后大鼠纹状体外侧深部区域神经元自发放电频率增加,兴奋性增强[5],即刻早期基因c-jun蛋白表达增强[1],且纹状体5-HT和DA含量显著增高,D2DR表达量显著增加[1]。提示,DA可能与D2DR结合后激活间接通路,直接/间接通路平衡被打破。因此,本研究从纹状体背外侧部的超微结构入手,探讨运动疲劳后黑质-纹状体DA神经系统在运动疲劳中枢机制中的调节作用。
1 材料和方法
1.1 实验动物及分组
雄性Wistar 大鼠( 230~270 g),由北京华阜康生物科技股份有限公司提供[SCXK(京)2012-0001]。大鼠分笼饲养,自由饮食,自然光照,室内温度20℃~25℃,湿度45%~50%。大鼠适应性饲养3 d后,按照采样时间点随机分为6个组,对照组(control group,CG),一次性力竭运动组(1-day fatigue group,1FG),3 d重复力竭组(3-day fatigue group,3FG),7 d力竭运动即刻组(7-day fatigue group,7FG),7 d力竭运动24 h恢复组(24-hour recovery,24RG)和48 h恢复组(48-hour recovery group,48RG)。各组内分别进行透射电镜实验(n=18)、免疫组化实验(n=18)及行为学实验(n=18),共54只大鼠。

图1 测试实验流程Figure1. Experimental Protocol
1.2 实验动物模型的建立
大鼠进行1周适应性训练后,建立7 d力竭跑台(DSPT-202)运动疲劳模型。模型建立采用本实验室改良的Bedford递增负荷运动方案,负荷分为3级:一级运动速度8.2 m/min,运动时间15 min;二级速度15 m/min,运动时间15 min;三级速度为20 m/min,运动至力竭;连续进行7 d。CG组大鼠置于跑台中自然安静状态。大鼠力竭标准为动物不能维持预定跑速,滞留于跑道后挡板不动,使用光、电、声刺激驱赶仍无效,并伴有呼吸急促,俯卧跑台,垂头不起等行为表现。
1.3 纹状体背外侧部突触超微结构的电镜实验
各采样时间点用10%水合氯醛溶液腹腔注射麻醉,37℃生理盐水和4℃的4%多聚甲醛左心室-升主动脉灌注固定,参照鼠脑图谱切取右侧纹状体背外侧部,将其修整为1 mm3的组织块并置于4%戊二醛溶液中固定后浸洗、脱水、浸透、包埋、聚合、切片与染色后在透射电子显微镜(Hitachi H-7650)下观察[16],每组选取20个视野在60 000×和20 000×镜下拍照编号。ImageJ测量突触活性区长度、突触后致密物(postsynaptic density,PSD)厚度、突触间隙宽度等指标[18,30]。突触活性区长度和突触后膜致密物质厚度参照Guldner方法[18,26],突触间隙宽度用多点平均法测量(图2)。
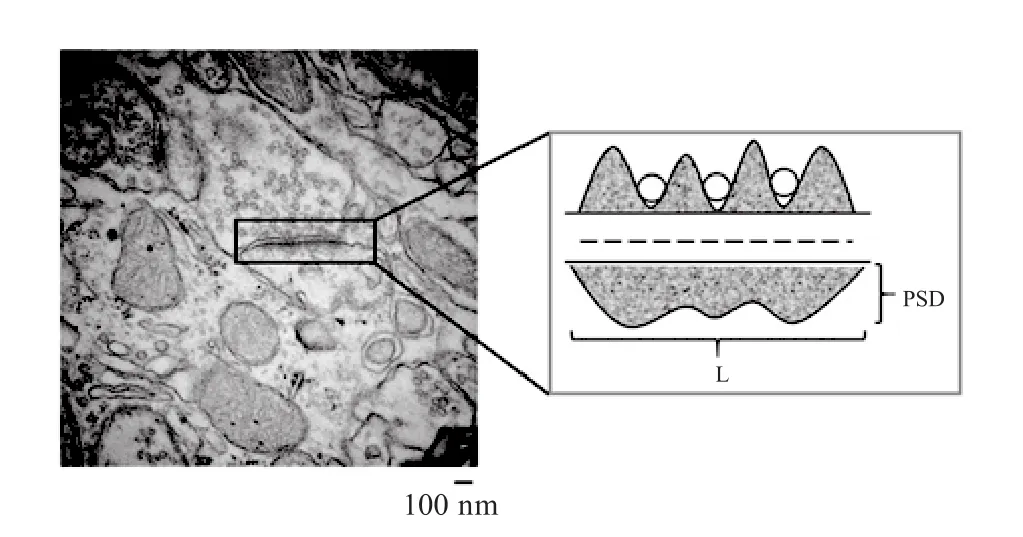
图2 突触参数测量Figure2. Parameter Measurement of Synaptic
1.4 PSD-95蛋白表达检测的免疫组织化学实验
各采样时间点麻醉灌流后快速取出脑组织块4%多聚甲醛中固定24 h后脱水、包埋、修块、切片、贴片、抗原修复、免疫组织染色、显色及透明[19],奥林巴斯BX51型显微镜进行图像采集,Image-Pro Plus 6.0软件统计分析免疫阳性细胞平均光密度(average opticaldensity,AOD)值。
1.5 大鼠自主活动能力评价及参数评估
大鼠自主活动能力采用旷场实验(open fi eld test,OFT)评价[10]。实验装置长×宽×高为100 cm×100 cm×40 cm,四壁白底部黑,放置于光强度20 Lux无背景噪音室内,数码摄像机固定于装置正上方80 cm,Smart 3.0软件记录大鼠旷场行为活动60 min。干预选取D2DR拮抗剂Sulpiride(Sigma,40 mg/kg)和D2DR激动剂Quinpirole(Sigma,0.03 mg/kg)进行[28],时间为每次力竭运动前30 min经腹腔注射[33]。实验设计采用双盲法,同时对每次重复力竭运动的时间进行记录。
1.6 统计学分析
采用SPSS 20.0统计软件进行统计学分析,结果以均值±标准差(±SD)表示。超微结构和行为学组间均数的比较采用方差分析(One-Way ANOVA),选择LSD/ Tamhane´s T2检验对组间均值差异进行比较,显著性水平为P<0.05。免疫组化结果比较采用独立样本t检验(independent-Samples T test),以P<0.05表示差异具有显著性意义。
2 结果
2.1 运动疲劳对大鼠纹状体背外侧部突触超微结构的影响
纹状体背外侧部能够观察到对称性突触和不对称性突触,纹状体背外侧部主要接受中脑黑质致密部DA能神经元投射,形成黑质-纹状体 DA 能通路,同时,纹状体背外侧部还接受感觉运动皮层谷氨酸(glutamate,Glu)能投射,构成皮层-纹状体Glu能通路,两条通路共同参与随意运动和身体姿势的控制[7,24,44],且这两者都形成兴奋性突触,即不对称性突触。因此,本研究选取不对称性突触进行统计、测量与分析。
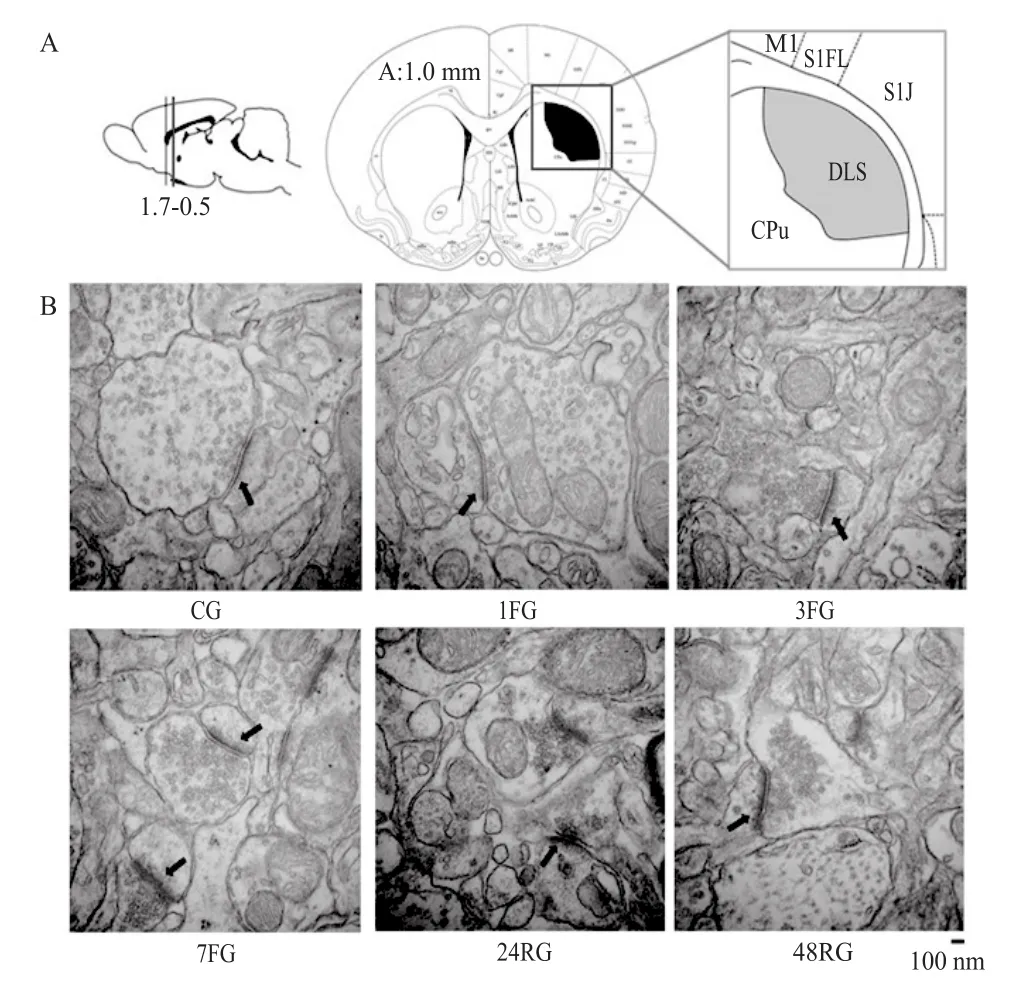
图 3 各组大鼠DLS区突触超微结构 (60 000×)Figure3. Synaptic Ultrastructure in Rats’ DLS(60 000×)
透射电子显微镜结果显示(图3、表1),3FG、7FG、24RG和48RG组与1FG组比较,突触间隙显著增大(P<0.01);3FG和7FG组与CG和1FG组相比致密物厚度显著降低(P<0.05);而各组大鼠DLS区活性区长度未见显著性差异(P>0.05)。

表1 各组大鼠DLS区突触界面结构参数Table1 Synaptic Structure Parameters in Rats’ DLS (nm)
2.2 运动疲劳对大鼠纹状体背外侧部PSD-95的影响
免疫组织化学结果阳性细胞呈现棕黄色(图4),表2可以看出,24RG组纹状体PSD-95蛋白表达与 CG、1FG组相比明显增加,且差异显著(P<0.05)。Person相关性检验显示,各组大鼠状体背外侧部PSD厚度变化与PSD-95蛋白表达量未显示显著差异(P>0.05)。

图4 各组大鼠DLS区PSD-95蛋白表达 (400×)Figure4. Expression of PSD-95 in DLS (400×)

表2 各组大鼠纹状体背外侧PSD-95蛋白表达水平比较Table2 Comparison of PSD-95 Expression Levels in DLS
2.3 重复力竭运动对大鼠自主活动能力的影响
行为学数据显示(表3),随着运动强度增加,各组大鼠运动总距离越来越短,但在恢复期又逐渐恢复到安静水平。与1FG组大鼠相比,7FG组大鼠运动最大速度显著升高(P<0.05);与CG组相比,各组大鼠运动平均速度显著降低(P<0.05);与1FG组大鼠相比,7FG和24RG组大鼠平均速度显著降低(P<0.05);与7FG组大鼠相比,48RG组大鼠平均速度显著升高(P<0.05)。
2.4 D2DR拮抗剂和激动剂干预对运动疲劳大鼠自主活动能力的影响
注射D2DR拮抗剂后,大鼠力竭运动时间(103±4.14 min)较对照组(147.33±5.63 min)显著降低(P<0.01),而D2DR激动剂干预后力竭运动时间(189.33±6.23 min)则显著增加(P<0.01)。大鼠在旷场中的活动区域集中在角落和边缘,60 min正常大鼠运动距离约为159 m,D2DR拮抗剂干预后大鼠活动减少,CG组运动距离降低52.3%(P<0.01),1FG和48RG组运动距离降低50.34%(P<0.05)和20.72%(P<0.05;图5)。

表3 力竭运动对大鼠自主活动能力的影响Table3 Effect of Exercise on Locomotor Behavior in Rats
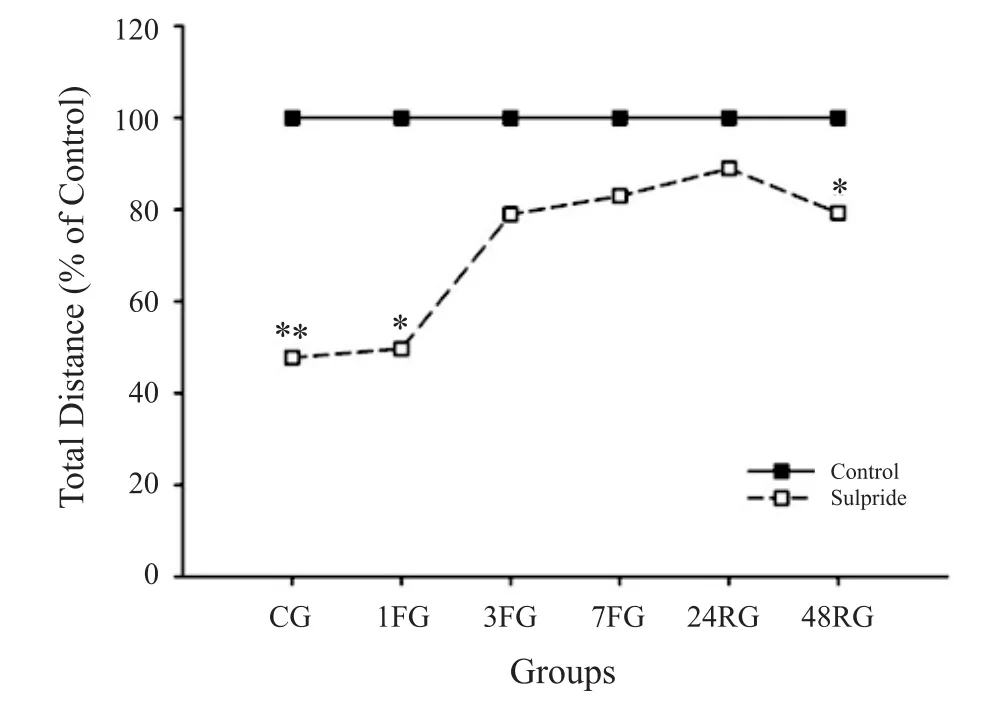
图5 D2DR拮抗剂干预对各组大鼠运动距离的影响Figure5. Effect of D2DR Antagonist of Exercise Distance in Rats
行为学数据显示(表4),7FG组大鼠D2DR拮抗剂干预后运动最大速度显著降低(P<0.05),而激动剂干预后最大速度升高,但差异不具有显著性(P>0.05)。

表4 D2DR拮抗剂和激动剂干预对各组大鼠最大速度影响Table4 D2DR Intervention Role of Max Speed in Rats
3 讨论
3.1 运动对纹状体突触超微结构及相关蛋白表达的影响
纹状体是基底神经节中接受传入信息的主要核团,参与随意运动的程序编制与执行,在调节运动方向、顺序、速度和幅度、运动可塑性,如习惯形成和条件行为等方面发挥作用[40]。当有运动疲劳发生时,机体运动能力下降,伴随技术动作失误,协调性、灵活性及精确性受到影响[13,20],
实验证明,DA本身或其激动剂能延迟疲劳,中枢DA减少可能加速疲劳产生[22],而耐力训练可通过增加D2DR和加强黑质-纹状体DA神经传导来提升运动能力[31],提示,运动疲劳发生时,黑质-纹状体DA神经系统在运动疲劳中枢机制中起着重要的调节作用。前期实验观察到,运动疲劳后大鼠纹状体外侧深部区域神经元自发放电频率增加,兴奋性增强[5],且这一区域神经元即刻早期基因c-jun蛋白表达增强[1],提示,纹状体背外侧区域在运动中发挥重要作用。
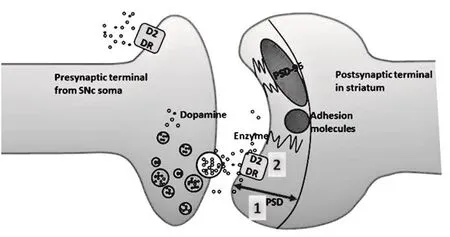
图6 突触传递效能影响因素示意图Figure6. Effect Factors of Synaptic Transmission
本研究发现,运动疲劳后纹状体背外侧部PSD厚度变小,而突触传递效能的改变与 PSD 的形态密切相关。PSD位于突触后膜是影响突触可塑性的重要细胞骨架结构,它包含神经递质受体、细胞粘附蛋白、衔接分子、信号酶和细胞骨架蛋白5类蛋白[12],其中,PSD-95是膜结合鸟苷酸激酶家族的重要成员,也是细胞骨架蛋白的主要成分[3]。本研究发现,PSD-95在运动疲劳后的改变与PSD的变化没有相关性,提示,PSD-95蛋白不是造成运动疲劳后PSD厚度变化的原因。
研究发现,D2DR基因敲除小鼠在各种环境中运动时间减少,活动量较低,D2DR造成其运动功能障碍[30]。也有研究表明,衰老动物丧失的快速发起运动能力(反应时增加)与纹状体D2DR密度减少相关[32],提示,D2DR介导的PSD厚度改变可能是运动疲劳发生的靶点,黑质-纹状体通路可塑性参与了这一变化的调节。
3.2 D2DR在纹状体-黑质通路运动控制中的机制探讨
纹状体内95%的神经元是γ-氨基丁酸能中型多棘神经元(medium spiny neuron,MSN),它们接受黑质DA能神经纤维投射。DA对参与直接通路的纹状体传出神经元(主要含D1受体)具有兴奋作用,使原本易化运动的直接通路产生兴奋效应;对参与间接通路的纹状体传出神经元(主要含D2受体)具有抑制作用,使原本抑制运动的间接通路产生去抑制效应,两条通路的最终结果都是易化运动。研究发现,黑质致密部 DA能神经元渐进性丢失是引发 PD患者或动物模型基底神经节调节功能紊乱的主要原因之一[6,7,37]。越来越多的证据表明,纹状体D2DR在调节运动控制、适应和妥协行为的神经通路中起到了重要作用[16]。
在实验室的前期研究中,通过电刺激前脑内侧束,观察了运动疲劳大鼠纹状体神经元诱发放电变化特征,结果表明,运动疲劳后纹状体诱发放电的频率达到最大值的刺激阈强度增加,黑质致密区的DA能神经系统主要通过D2DR的作用对纹状体的电活动进行调节,提示,D2DR参与了运动疲劳后纹状体放电活动的改变机制[4]。运动疲劳后,D1DR受体拮抗剂诱导纹状体神经元由单放电向爆发式放电转变,而D2DR受体拮抗剂则对纹状体神经元活动的抑制性增强[1],说明D2DR参与了运动疲劳中枢机制调节活动。
2010年,Jackson等人[25]注射D2DR激动剂使PD狨猴运动障碍明显逆转且自发活动增加,当激动剂与L-dopa联合使用时,明显改善运动功能障碍且不抑制L-dopa的治疗作用。PD模型动物纹状体MSNs树突棘形态结构发生异常改变,且与运动功能障碍的出现具有一致性[29];而一定强度跑台或跑轮运动干预可显著逆转PD模型动物树突棘数量和密度丢失,并改善其运动功能[43]。PD患者纹状体组织尸检结果发现,纹状体MSNs存在树突棘丢失现象,树突分枝数量、树突长度及树突棘密度均显著降低[39]。Zhang Y等[46]研究证明,6-OHDA偏侧损毁大鼠纹状体MSNs胞体远端和近端树突上树突棘约丢失40%。Caroline Fasano等[15]研究发现,在MSNs单细胞培养实验中,用激动剂quinpirole激活D2DR可使MSNs主树突上每50μm增加树突棘54%并促进MSN树突表达,提示,D2DR可以作为纹状体MSNs树突棘结构重塑治疗PD的潜在靶点之一。
有研究表明,药物激活大鼠纹状体 D2DR导致大鼠产生刻板行为综合征(重复嗅探和啃咬行为,并伴随有多动症),阻断纹状体 D2DR使大鼠产生明显肌肉僵硬[27]。前期研究观察到,D2DR拮抗剂Spiperone对运动疲劳后纹状体神经元的抑制作用加强[21],同时,运动疲劳后,纹状体5-HT和DA含量显著增高,D2DR受体表达量显著增加[1],提示,DA可能与D2DR结合后激活间接通路,打破直接/间接通路的平衡。本研究观察到,注射D2DR拮抗剂大鼠力竭时间减少,而注射D2DR激动剂后大鼠力竭时间延长,且大鼠运动最大速度呈现与力竭时间相同的趋势。这与前期研究结果相一致。本研究发现,运动疲劳后大鼠自主活动能力降低,早期动物迷宫实验发现,背侧纹状体在对刺激反应的执行中极其重要[8],本研究发现的运动疲劳后大鼠的自主活动能力降低可能与运动疲劳后背侧纹状体突触传递效能降低有关。结合D2DR拮抗剂和激动剂干预造成的大鼠行为能力变化,说明D2DR的调节作用可能与黑质-纹状体DA能微环路的突触可塑性有关,提示,D2DR可作为改善运动疲劳的重要靶点。
4 结论
运动疲劳后黑质-纹状体超微结构发生变化,突触传递效能降低。PSD厚度随着运动疲劳程度的加深而逐渐减小,突触间隙在一次力竭运动后显著降低。运动疲劳后PSD-95蛋白表达发生改变。同时,运动疲劳使大鼠自主活动能力降低,D2DR拮抗剂干预加深这一作用,而D2DR激动剂干预可缓解这种能力的降低,提示,D2DR的调节作用与黑质-纹状体DA能微环路突触可塑性有关,可作为改善运动疲劳的干预靶点。
[1] 侯莉娟,刘晓莉,乔德才. DA受体对运动疲劳后纹状体神经元信号转导调节作用的研究[J]. 西安体育学院学报,2011,28(1):79-82.
[2] 李国彰. 神经生理学[M]. 北京:人民卫生出版社,2007:282.
[3] 廖家万,周兴海. 突触后致密物与突触可塑性[J]. 河南医学高等专科学校学报,2007,19(3):288-291.
[4] 刘晓莉,吴迪,乔德才,等. 电刺激前脑内侧束对运动疲劳大鼠纹状体神经元诱发电活动的影响[J]. 西安体育学院学报,2012,29(1):72-77.
[5] 乔德才,侯莉娟,何德富,等. 运动疲劳对大鼠新纹状体神经元电活动的影响[J]. 中国运动医学杂志,2005,24(6):37-41.
[6] 周明珠,刘振国,干静,等. 帕金森病患者运动并发症的调查分析[J]. 中华神经科杂志,2008,41(11):744-747.
[7] BAMFORD N S,ROBINSON S,PALMITER R D,et al. Dopamine modulates release from corticostriatal terminals[J]. J Neurosci,2004,24(43):9541-9552.
[8] BELIN D,JONKMAN S,DICKINSON A,et al. Parallel and interactive learning processes within the basal ganglia:Relevance for the understanding of addiction[J]. Behav Brain Res,2009,199(1):89-102.
[9] BOLAM J P,HANLEY J J,BOOTH P A C,et al. Synaptic organisation of the basal ganglia[J]. J Anat,2000,196(4):527-542.
[10] BRUDEVOLD F,REDA A,AASENDEN R,et al. Activation of postsynaptic D2 dopamine receptors in the rat dorsolateral striatum prevents the amnestic effect of systemically administered neuroleptics[J]. Behav Brain Res,2015,281(10):283-289.
[11] CRABTREE D R,CHAMBERS E S,HARDWICK R M,et al. The effects of high-intensity exercise on neural responses to images of food[J]. Am J Clin Nutr,2014,99(2):258-267.
[12] DE B A,FIORE G. Postsynaptic density scaffolding proteins at excitatory synapse and disorders of synaptic plasticity:implications for human behavior pathologies[J]. Int Rev Neurobiol,2004,59:221-254.
[13] DEVAN B D,HONG N S,MCDONALD R J. Parallel associative processing in the dorsal striatum:Segregation of stimulus–response and cognitive control subregions[J]. Neurobiol Learn Mem,2011,96(96):95-120.
[14] EDWARDS R H. Human muscle function and fatigue[J]. Ciba Found Symp,2008,82:1-18.
[15] FASANO C,BOURQUE M J,LAPOINTE G,et al. Dopamine facilitates dendritic spine formation by cultured striatal medium spiny neurons through both D1 and D2 dopamine receptors[J]. Neuropharmacol,2013,67(3):432-443.
[16] GHAHREMANI D G,LEE B,ROBERTSON C L,et al. Striatal dopamine D2/D3receptors mediate response inhibition and related activity in frontostriatal neural circuitry in humans[J]. J Neurosci,2012,32(21):7316-7324.
[17] GRAYBIEL A M. Habits,rituals,and the evaluative Brain[J]. Annu Rev Neurosci,2008,31(31):359-387.
[18] GÜLDNER F H,INGHAM C A. Increase in postsynaptic density material in optic target neurons of the rat suprachiasmatic nucleus after bilateral enucleation[J]. Neurosci Lett,1980,17(1-2):27-31.
[19] HAFNER A S,PENN A C,GRILLOBOSCH D,et al. Lengthening of the stargazin cytoplasmic tail increases synaptic transmission by promoting interaction to deeper domains of PSD-95[J]. Neuron,2015,86(2):475-489.
[20] HASSANLOUEI H,ARENDT-NIELSEN L,KERSTING U G,et al. Effect of exercise-induced fatigue on postural control of the knee[J]. J Electromyogr Kinesiol,2012,22(3):342-347.
[21] HATTORI S,LI Q,MATSUI N,et al. Treadmill running test for evaluating locomotor activity after 6-OHDA lesions and dopaminergic cell grafts in the rat[J]. Brain Res Bull,1993,31(3-4):433-435.
[22] HEYES M P,GAMETT E S,COATES G. Central dopaminergic activity influences rats ability to exercise[J]. Life Sci,1985,36(7):671-677.
[23] HIDEAKI I,YUSUKE N. Effect of lactate accumulation during exercise-induced muscle fatigue on the sensorimotor cortex[J]. J Phys Ther Sci,2013,25(12):1637-1642.
[24] HUANG Y X,LUO W F,LI D,et al. CSC counteracts l -DOPA-induced overactivity of the corticostriatal synaptic ultrastructure and function in 6-OHDA-lesioned rats[J]. Brain Res,2011,1376(3):113-121.
[25] JACKSON M J,ANDREE T H,HANSARD M,et al. The dopamine D2 receptor partial agonist aplindore improves motor def icits in MPTP-treated common marmosets alone and combined with L-dopa[J]. J Neural Transm,2010,117(1):55-67.
[26] JONES D G,CALVERLEY R K. Frequency of occurrence of perforated synapses in developing rat neocortex[J]. Neurosci Lett,1991,129(2):189-192.
[27] KAPUR S,ZIPURSKY R,JONES C,et al. Relationship between dopamine D2occupancy,clinical response,and side effects:A double-blind PET study of fi rst-episode schizophrenia[J]. Am J Psychiatry,2000,157(4):514-520.
[28] KEELER J F,PRETSELL D O,ROBBINS T W. Functional implications of dopamine D1 vs. D2 receptors:A ‘prepare and select’ model of the striatal direct vs. indirect pathways[J]. Neurosci,2014,282:156-175.
[29] KIM W,IM M J,PARK C H,et al. Remodeling of the dendritic structure of the striatal medium spiny neurons accompanies behavioral recovery in a mouse model of Parkinson’s disease[J]. Neurosci Lett,2013,557:95-100.
[30] KOBAYASHI A,PARKER R L,WRIGHT A P,et al. lynx1 supports neuronal health in mouse dorsal striatum during aging:an ultrastructural investigation[J]. J Mol Neurosci,2014,53(3):525-536.
[31] MACRAE P G,SPIRDUSO W W,WALTERS T J,et al. Endurance training effects on striatal D2 dopamine receptor binding and striatal dopamine metabolites in presenescent older rats[J]. Psychopharmacol,1987,92(2):236-240.
[32] MACRAE P G,SPIRDUSO W W,WILCOX R E. Reaction time and nigrostriatal dopamine function:the effects of age and practice[J]. Brain Res,1988,451(1-2):139-146.
[33] MIZUCHI A,KITAGAWA N,MIYACHI Y. Regional distribution of sultopride and sulpiride in rat brain measured by radioimmunoassay[J]. Psychopharmacol,1983,81(3):195-198.
[34] NAKAMURA T,SATO A,KITSUKAWA T,et al. Distinct motor impairments of dopamine D1 and D2 receptor knockout mice revealed by three types of motor behavior[J]. Front Integr Neurosci,2014,8:56.
[35] NARDONE R,HÖLLER Y,BRIGO F,et al. Fatigue-induced motor cortex excitability changes in subjects with spinal cord injury[J]. Brain Res Bull,2013,99(5):9-12.
[36] NYBO L,SECHER N H. Cerebral perturbations provoked by prolonged exercise[J]. Prog Neurobiol,2004,72(4):223-261.
[37] OGINSKY M F,RODGERS E W,CLARK M C,et al. D2 receptors receive paracrine neurotransmission and are consistently targeted to a subset of synaptic structures in an identif i ed neuron of the crustacean stomatogastric nervous system[J]. J Comp Neurol,2010,518(3):255-276.
[38] POLDRACK R A,PACKARD M G. Competition among multiple memory systems:Converging evidence from animal and human brain studies[J]. Neuropsychologia,2003,41(3):245-251.
[39] STEPHENS B,MUELLER A J,SHERING A F,et al. Evidence of a breakdown of corticostriatal connections in Parkinson’s disease[J]. Neuroscience,2005,132(3):741-754.
[40] SURMEIER D J,DING J,DAY M,et al. D1 and D2 dopamine-receptor modulation of striatal glutamatergic signaling in striatal medium spiny neurons[J]. Trends Neurosci,2007,30(5):228-235.
[41] TAKAKUSAKI K,SAITOH K,HARADA H,et al. Role of basal ganglia-brainstem pathways in the control of motor behaviors[J]. Neurosci Res,2004,50(2):137-151.
[43] TOY W A,PETZINGER G M,LEYSHON B J,et al. Treadmill exercise reverses dendritic spine loss in direct and indirect striatal medium spiny neurons in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) mouse model of Parkinson’s disease[J]. Neurobiol Dis,2014,63:201-209.
[44] YIN H H,KNOWLTON B J,BALLEINE B W. Inactivation of dorsolateral striatum enhances sensitivity to changes in the action–outcome contingency in instrumental conditioning[J]. Behav Brain Res,2006,166(2):189-196.
[45] YIN H H,KNOWLTON B J,BALLEINE B W. Lesions of dorsolateral striatum preserve outcome expectancy but disrupt habit formation in instrumental learning[J]. Eur J Neurosci,2004,19(1):181-189.
[46] ZHANG Y,MEREDITH G E,MENDOZA-ELIASN,et al.Aberrant restoration of Spines and their synapses in L-DOPA-induced dyskinesia:Involvement of corticostriatal but not thalamostriatal synapses [J].J Neurosci,2013,33(28):11655-11667.
Exercise-induced Fatigue Inf l uenced Striatal Neuron’s Synaptic Ultrastructure and D2DR Intervention Role in Rat
目的:观察运动疲劳后大鼠纹状体背外侧部(DLS)突触超微结构变化及D2DR干预对大鼠自主活动能力的影响,探讨黑质-纹状体通路在运动疲劳中枢调控中的作用。方法:Wistar大鼠建立运动疲劳模型,分为对照组(CG)、一次性力竭运动组(1FG)、3 d重复力竭组(3FG)、7 d力竭运动即刻组(7FG)、7 d力竭运动24 h恢复组(24RG)和7 d力竭运动48 h恢复组(48RG)。采用透射电子显微镜观察DLS突触超微结构变化,免疫组化检测PSD-95蛋白表达情况,并对其与超微结构相关性进行分析;采用D2DR拮抗剂、激动剂干预大鼠自主运动能力,对其旷场行为进行分析。结果:1)与CG组相比,1FG组DLS突触间隙显著减小(P<0.01),3FG和7FG组较CG和1FG组致密物厚度显著减小(P<0.05);2) 24RG组PSD-95蛋白表达较CG和1FG组显著增加 (P<0.05);3)各组大鼠运动总距离随运动强度增加而减少,且可恢复至安静水平。注射D2DR拮抗剂后力竭时间显著缩短(P<0.01),而激动剂干预后力竭时间显著增加(P<0.01)。结论:PSD厚度随着运动疲劳程度加深逐渐减小;运动疲劳影响PSD-95蛋白表达,但其与运动疲劳程度没有相关性;运动疲劳使大鼠自主活动能力降低,D2DR拮抗剂干预加深这一作用,而D2DR激动剂可缓解大鼠活动能力的降低,提示,D2DR的调节作用与黑质-纹状体DA能微环路突触可塑性有关,D2DR可作为改善运动疲劳的靶点。
运动疲劳;纹状体;突触可塑性;受体干预;PSD-95蛋白
Objective:Through investigating dorsolateral striatum (DLS) synaptic ultrastructural change and D2DR antagonist/agonist effect on autonomic activity in exercise-induced fatigue rats,explore the central regulation role of substantia nigra striatum pathway. Methodology:Male Wistar rats were randomly divided into control group (CG),1-day fatigue group (1FG),3-day fatigue group (3FG),7-day fatigue group (7FG),24-hour recovery group (24RG) and 48-hour recovery group (48RG). The synaptic ultrastructure was observed by transmission electron microscopy,the expression of PSD-95 protein was detected by immunohistochemistry and the correlation between ultrastructure and PSD-95 was analyzed. D2DR antagonist and agonist were used to interfere the autonomic exercise of rats with Open Field Test. Results:(1) The width of synaptic clefts of DLS decreased significantly in 1FG compared with CG(P<0.01),and the density of 3FG and 7FG decreased signif i cantly(P<0.05) compared with CG and 1FG;(2)Compared with CG and 1FG,expression of PSD-95 protein in 24RG was significantly increased(P<0.05);(3) The total exercise distance of each group decreased gradually with the increase of exercise intensity,and the rest returned to a quiet level. Rats exhaustion time was signif i cantly shortened after injection of D2DR antagonist(P<0.01),while the agonist intervention signif i cantly increased the exhaustion time(P<0.01). Conclusions:PSD-95 has no correlation with the degree of exercise-induced fatigue,while exercise-induced fatigue reduced the ability of rats’ autonomic activity. D2DR antagonist intervention made the exercise-induced fatigue condition deeply while D2DR agonist has convers role. The regulation of D2DR may be related to synaptic plasticity of dopaminergic microcirculation in the substantia nigra striatum,it suggests that D2DR can be selected as an important target for regulation exercise-induced fatigue.
exercise-induced fatigue;striatum;synaptic plasticity;receptor intervention;PSD-95
G804.7
A
1000-677X(2017)06-0062-07
10. 16469/j. css. 201706006
2017-01-09;
2017-05-21
国家自然科学基金资助项目(31401018)。
侯莉娟,女,副教授,博士,主要研究方向为运动神经调控,E-mail:houlj@bnu.edu.cn;成佳俐,女,在读硕士研究生,主要研究方向为运动神经调控,E-mail:201421070016@mail.bnu.edu.cn;乔德才,男,教授,博士,主要研究方向为运动神经调控,E-mail:decaiq@bnu. edu.cn。
1.北京师范大学 体育与运动学院,北京 100875;2.国家生物医学分析中心,北京 100850
1.Beijing Normal University,Beijing 100875,China;2.National Center of Biomedical Analysis,Beijing 100850,China.

