啮齿类动物注意定势转移任务研究进展
侯兰伟,孙宏伟,王钢,连波,姜能志,孙琳,*
( 潍坊医学院1. 心理学系; 2. 认知神经重点实验室; 3. 生物科学与技术学院,山东潍坊 261053)
研究进展
啮齿类动物注意定势转移任务研究进展
侯兰伟1,孙宏伟1,王钢2,连波3,姜能志1,孙琳1,2*
( 潍坊医学院1. 心理学系; 2. 认知神经重点实验室; 3. 生物科学与技术学院,山东潍坊 261053)
认知是前额叶执行功能的重要组成部分,其过程主要包括注意定势的组建、维持和转移,而认知的行为学表现结果不仅受到外在的注意定势转移任务(attentional set-shifting task,ASST)检测方法的影响,同时还受到内在特定脑区及特定神经递质的调控。因此本综述回顾了有关ASST检测认知灵活性的发展历程,分析了啮齿类动物ASST的检测方法、原理及检测方法之间的异同,并系统地总结了不同脑区在认知过程中的作用及多种神经递质包括多巴胺,乙酰胆碱,去甲肾上腺素,5-羟色胺等在ASST过程中所扮演的重要角色,详细地阐明了目前有关ASST检测认知灵活性的发展现状,亟待解决的问题及未来发展趋势,为进一步挖掘认知灵活性的调控机制和影响因素提供重要的理论依据。
注意定势转移任务;啮齿类动物;多巴胺;乙酰胆碱;5-羟色胺;去甲肾上腺素
认知灵活性是一种灵活的转换心理表征及将注意定势转换到能够适应变化的或不可预测的情景中的能力,其本质是研究被试者能否产生协调有序而有目的性的行为及对认知过程进行良好的控制和调节。而ASST主要通过检测受试者的注意定势转移能力来反映受试者的认知灵活性,最早可追溯到1920年精神分裂症病人认知能力检测的规划、排序、分类任务试验[1]。 在人类研究中,ASST主要用于收集人类神经病变有关疾病的认知障碍信息;而在灵长类动物实验中,则可增强研究者对额叶皮质系统行为灵活性的神经化学基础的认识[2]。随后ASST用来研究啮齿类动物注意定势转移能力[3]。这项任务利用啮齿类动物先天的觅食习惯,引入可供辨别因素,以能否正确寻找并挖掘碗中的食物为判断标准来检测啮齿类动物注意定势转移能力。目前,检测啮齿类动物注意定势转移能力最常用的实验是由Birrell提出的七阶段测试法[3],Fox[4]和Liston[5]提出的五阶段检测法及Bissonette提出的4-内维度辨别(intradimensional acquisition, ID)检测法[6]。
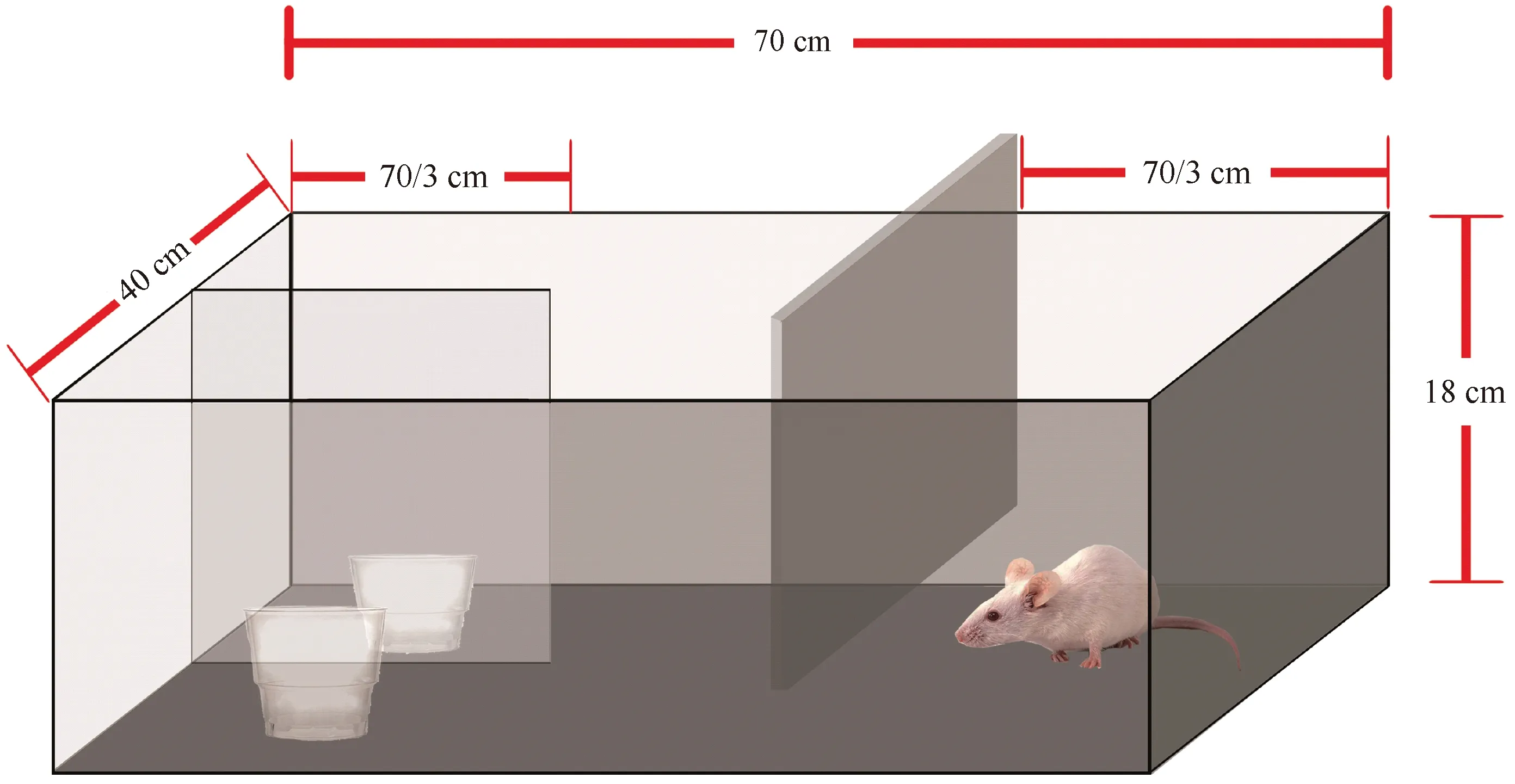
图1 七阶段测试法检测装置Fig.1 Ilustration of the detection device of 7-stage task program
1 啮齿类动物ASST方法介绍
1.1 ASST的基本步骤
适应期在笼内训练大鼠挖掘碗中的奖赏物。随后训练期将大鼠放置在ASST特定装置中(如图1),训练大鼠挖掘用木屑作为填充物并有奖赏食物的碗,直到大鼠出现稳定的正确挖掘行为。测试期包括简单辨别(simple discrimination,SD)、复杂辨别(compound discrimination,CD)、第一次逆转学习(reversal learning 1,REV1)、内维度辨别(intradi mensional shift,IDS)、第二次逆转学习(reversal learning 2,REV2)、外维度辨别(extradimensional shift,EDS)及第三次逆转学习(reversal learning 3,REV3)七个阶段。每个辨别阶段均需连续六次正确挖掘方可进入下一测试阶段。
1.2 ASST测试阶段顺序的探究
七阶段测试中:SD阶段,大鼠学会用单一相关维度(气味)进行辨别,指引大鼠形成用该维度辨别的能力;CD阶段引入另一不相关维度(填充物),强化大鼠用气味维度进行辨别;REV1阶段将气味维度进行逆转,相关辨别维度不变,旨在抑制前阶段形成的刺激优势,也进一步加强大鼠用相关维度进行辨别的注意定势;ID阶段引入相同性质的新维度刺激替代原先的维度刺激,相关辨别维度仍不变,检测前阶段注意定势组建程度;REV2阶段,相关维度的目标性气味刺激与非目标性气味刺激互换,相关性辨别维度仍不变,旨在抑制刺激优势,加强组建注意定势;ED阶段,新的维度刺激重新被引入,且相关性辨别维度与非相关性辨别维度互换,旨在指引大鼠完成注意定势转移;REV3阶段,原先的目标性刺激与非目标性刺激互换,相关性辨别维度不变,不仅强化注意定势,还可证明ED阶段的表现缺陷并非偶然事件,而是实验程序中正常表现。在测试过程中,记录潜伏期(大鼠进入测试区到出现挖掘行为的时间)和完成某阶段的试验次数及正确与否。(见图1)
五阶段ASST检测法,检测程序依次包括:SD、CD、ID、REV和ED五个阶段。由于不同检测阶段间的顺序关系和逆转学习次数存在差异,故动物更容易形成注意定势的组建。而在4-ID测试程序中,得到的行为学结果也与七阶段检测不同,因此研究者可根据自己的实验设计及要求合理选择检测方法。
2 大鼠、小鼠ASST中的行为表现差异
在检测小鼠注意定势转移能力时,正常组小鼠在ID和ED阶段并没有表现出差异[7],表明小鼠在该检测程序中没有组建注意定势及实验组小鼠在ED阶段的表现缺陷是不具有参考意义的。然而在Bissonette[6]的研究中发现,小鼠在4-ID检测程序中可以组建注意定势,这表明需要更多ID阶段来组建注意定势。在利用气味和放置碗的平台质地两个辨别维度的实验中,小鼠也组建了注意定势,提示在后续小鼠ASST测试中可尝试利用平台质地和气味两种辨别维度来检测注意定势转移能力。
3 不同脑区病变对ASST的影响
后顶叶皮质病变导致大鼠ED阶段行为表现受损,但并不影响REV阶段的表现[4];扣带回病变则会导致大鼠ID阶段行为表现受损,且导致大鼠无法组建注意定势[5];纹状体病变主要影响大鼠注意定势的组建且使之在REV阶段行为表现受损[8],而基底前脑受损则会导致大鼠REV阶段行为表现受损[9];内侧前额叶病变的大鼠能够组建注意定势,但注意定势转移受损[10];眶部前额叶(orbital prefrontal cortex,OFC)病变的大鼠表现出REV、注意定势组建及注意定势转移阶段受损[11]。
4 认知相关性神经递质的研究
4.1 多巴胺
多巴胺(dopamine,DA)主要调节啮齿类动物逆转学习的灵活性。在大鼠纹状体中注射少许D2受体激动剂,可减少前额叶(prefrontal cortex,PFC)DA的输出,而PFC的病变则进一步导致纹状体的损伤,使大鼠REV阶段行为受损[12,13]。PFC的DA在认知过程中的功能大致呈倒置的“U”型,即DA功能低下(精神分裂症大鼠模型)或是亢进均(Δ-9-四氢大麻酚)都可造成大鼠在ASST检测过程中注意定势转移能力的下降[14-16]。大鼠自食甲基苯丙胺21 d,会降低PFC中DA传导水平,大鼠在ED阶段表现显著受损,但不影响REV阶段的表现;而大剂量腹腔注射甲基苯丙胺会导致PFC的DA水平下降,使得大鼠REV阶段行为受损[17]。给予精神分裂症大鼠腹腔注射Δ-9-四氢大麻酚,可提高PFC的DA水平,导致大鼠REV阶段和ID阶段表现受损[18]。
4.2 乙酰胆碱
乙酰胆碱(acetylcholine,ACh)介导大鼠注意定势组建、转移及REV阶段的行为表现,故ACh水平的降低会导致大鼠REV阶段和ED阶段的表现受损[14-19]。然而通过东莨菪硷阻断胆碱能系统,可导致大鼠在REV和ED阶段的表现受损[20]。GSK189254通过阻断组胺H3受体,提高阿尔兹海默病模型PFC的Ach水平,促进大鼠在REV和ED阶段的表现[21]。而通过急性腹腔注射尼古丁提高α7nAChR受体活性,可促进ACh的利用率,明显改善大鼠在ID阶段和ED阶段的行为表现[19]。并且在精神分裂症的大鼠模型中,α7nAChR激动剂SSR-180711可改善由腹侧海马微量注射河豚毒素导致大鼠在ED阶段的行为的损伤[22]。此外,老年大鼠模型伴有显著ED和REV两阶段受损,但是通过注射胆碱酯酶拮抗剂他克林(可水解的ACh),改善衰老引起的大鼠在REV阶段的行为缺陷[24]。
4.3 去甲肾上腺素
去甲肾上腺素(norepinephrine,NA)主要与DA及五羟色胺(serotonin,5-HT)相互作用介导大鼠在REV阶段的行为表现。短期注射高剂量的NA再摄取拮抗剂托墨西汀可提高大鼠PFC中NA和DA的输出水平,并改善由抗DβH皂草素引起的注意定势转移受损[24,25]。通过α2-肾上腺素能受体拮抗剂阿替美唑[26]或NA再摄取拮抗剂地昔帕明[27]提高大鼠PFC的NA水平,可改善大鼠在REV和ED阶段的表现,这可能是由于PFC输出的NA并作用于其他部位而出现的结果,或者通过NA的作用提高DA水平或是增强5-HT的释放,提高大鼠在REV和ED阶段的行为表现[28]。此外,NA可独立作用于大鼠注意定势的转移。有研究显示,抗DβH皂草素可降低PFC的NA水平[24,29],或者6-OH-DA抑制NA投射系统向PFC投射[30],都可损伤大鼠注意定势的转移而不会影响大鼠在ASST中其他阶段的表现。
4.4 5-羟色胺
5-HT主要介导大鼠在REV及注意定势转移阶段的受损。慢性不可预知性应激会导致大鼠在REV和ED阶段受损,5-HT再摄取抑制剂依他普仑可以改善此模型大鼠ED阶段的受损表现[31];束缚性应激则导致大鼠ED阶段行为受损,给予5-HT(7)受体拮抗剂SB-269970可改善此阶段[32]。西酞普兰给药后可提高5-HT水平并改善大鼠由慢性间断性冷刺激导致REV阶段受损和整体辨别学习能力的下降[33]。亚急性注射5-HT受体拮抗剂SB-399885-T可提高OFC中5-HT的水平,并可提高大鼠整体的辨别学习能力,尤其是REV和ED阶段[34],但急性注射此药(30 mg/kg)隔天后检测发现并不提高大鼠在ASST测试中的表现[35]。
5 未来的发展
ASST是研究与额叶认知有关的包括精神分裂症、帕金森症、阿尔茨海默病及注意缺陷多动症等多种神经退行性疾病的检测工具。由于啮齿类动物和人类有着本质的物种差异,行为学检测只能提供表观的行为表现,以后需要依据更多的电生理学检测特定脑区神经电活动来评估认知灵活性。并且日后要挖掘多种神经递质之间协同/拮抗或是串联/并联作用及各神经递质构建的认知网络机制。认知的研究已经逐渐从行为学的探讨到解剖学定位转移,神经化学递质的调节,但是认知神经功能网络极其复杂,是否具有其他非认知区脑区部位的参与,神经递质在认知过程中扮演的角色如何,仍需专业学者更进一步地探索与阐明。
[1] Vigotsky LS, Kasanin JJ. Thought in schizophrenia [J]. Arch Neurol Psychiatry, 1934, 31: 63-70.
[2] Robbins TW, James M, Owen AM. A study of performance on tests from the CANTAB battery sensitive to frontal lobe dysfunction in a large sample of normal volunteers: implications for theories of executive functioning and cognitive aging. Cambridge Neuropsychological Test Automated Battery [J]. J Int Neuropsychol Soc, 1998, 4(5): 474-490.
[3] Birrell JM, Brown VJ. Birrell JM, et al. Medial frontal cortex mediates perceptual attentional set shifting in the rat [J]. J Neurosci, 2000, 20: 4320-4324.
[4] Fox MT, Barense MD, Baxter MG. Perceptual attentional set-shifting is impaired in rats with neurotoxic lesions of posterior parietal cortex [J]. J Neurosci, 2003, 23: 676-681.
[5] Liston C, Miller MM, Goldwater DS, et al. Stress-induced alterations in prefrontal cortical dendritic morphology predict selective impairments in perceptual attentional set-shifting [J]. J Neurosci, 2006, 26(30): 7870-7874.
[6] Bissonette GB, Martins GJ, Franz TM, et al. Double dissociation of the effects of medial and orbital prefrontal cortical lesions on attentional and affective shifts in mice [J]. J Neurosci, 2008, 28, 44: 11124-11130.
[7] Brooks SP, Betteridge H, Trueman RC, et al. Selective extra-dimensional set shifting deficit in a knock-in mouse model of Huntington’s disease [J]. Brain Res Bull, 2006, 69(4): 452-457.
[8] Izquierdo A, Belcher AM, Scott, L et al. Reversal-specific learning impairments after a binge regimen of methamphetamine in rats: possible involvement of striatal dopamine [J]. Neuropsychopharmacology, 2010, 35(2): 505-514.
[9] Tait DS, Brown VJ. Lesions of the basal forebrain impair reversal learning but not shifting of attentional set in rats [J]. Behav Brain Res, 2008, 187(1): 100-108.
[10] Tait DS, Marston HM, Shahid M, et al. Asenapine restores cognitive flexibility in rats with medial prefrontal cortex lesions [J]. Psychopharmacology (Berl), 2009, 202(1-3): 295-306.
[11] Chase AE, Tait DS, Brown VJ. Lesions of the orbital prefrontal cortex impair the formation of attentional set in rats [J]. Eur J Neurosci, 2012, 36(3): 2368-2375.
[12] Bach ME, SimpsonEH, Kahn L, et al. Transient and selective overexpression of D2 receptors in the striatum causes persistent deficits in conditional associative learning [J]. Proc Natl Acad Sci U S A, 2008, 105(41): 16027-16032.
[13] Goto Y, Grace AA. Dopaminergic modulation of limbic and cortical drive of nucleus accumbens in goal-directed behavior [J]. Nat Neurosci, 2005, 8(6): 805-812.
[14] Mattay VS, Goldberg TE, Fera F, et al. Catechol O-methyltransferase val158-met genotype and individual variation in the brain response to amphetamine [J]. Proc Natl Acad Sci U S A, 2003, 100(10): 6186-6191.
[15] Vijayraghavan S, Wang M, Birnbaum SG, et al. Inverted-U dopamine D1 receptor actions on prefrontal neurons engaged in working memory [J]. Nat Neurosci, 2007, 10(3): 376-384.
[16] Berridge CW, Shumsky JS, Andrzejewski ME, et al. Differential sensitivity to psychostimulants across prefrontal cognitive tasks: differential involvement of noradrenergic α1- and α2-receptors [J]. Biol Psychiatry, 2012, 71(5): 467-473.
[17] Parsegian A, Glen WB, Lavin A, et al. Methamphetamine self-administration produces attentional set-shifting deficits and alters prefrontal cortical neurophysiology in rats [J]. Biol Psychiatry, 2011, 69(3): 253-259.
[18] Jentsch JD, Andrusiak E, Tran A, et al. Delta 9-tetrahydrocannabinol increases prefrontal cortical catecholaminergic utilization and impairs spatial working memory in the rat: blockade of dopaminergic effects with HA966 [J]. Neuropsychopharmacology, 1997, 16(6): 426-432.
[19] Allison C, Shoaib M. Nicotine improves performance in an attentional set shifting task in rats [J]. Neuropharmacology, 2013, 64: 314-320.
[20] Chen KC, Baxter MG, Rodefer JS. Central blockade of muscarinic cholinergic receptors disrupts affective and attentional set-shifting [J]. Eur J Neurosci, 2004, 20(4): 1081-1088.
[21] Medhurst AD, Atkins AR, Beresford IJ, et al. GSK189254, a novel H3 receptor antagonist that binds to histamine H3 receptors in Alzheimer's disease brain and improves cognitive performance in preclinical models [J]. J Pharmacol Exp Ther, 2007, 321(3): 1032-1045.
[22] Wallace TL, Callahan PM, Tehim A, et al. RG3487, a novel nicotinic α7receptor partial agonist, improves cognition and sensorimotor gating in rodents [J]. J Pharmacol Exp Ther, 2011, 336(1): 242-253.
[23] Tait DS, Chase EA, Brown VJ. Tacrine improves reversal learning in older rats [J]. Neuropharmacology, 2013, 73: 284-289.
[24] Newman LA, Darling J, McGaughy J. Atomoxetine reverses attentional deficits produced by noradrenergic deafferentation of medial prefrontal cortex [J]. Psychopharmacology (Berl), 2008, 200(1): 39-50.
[25] Bymaster FP, Katner JS, Nelson DL, et al. Atomoxetine increases extracellular levels of norepinephrine and dopamine in prefrontal cortex of rat: a potential mechanism for efficacy in attention deficit/hyperactivity disorder [J]. Neuropsychopharmacology, 2002, 27(5): 699-711.
[26] Lapiz MD, Morilak DA. Noradrenergic modulation of cognitive function in rat medial prefrontal cortex as measured by attentional set shifting capability [J]. Neuroscience, 2006 137(3): 1039-1049.
[27] Lapiz MD, Bondi CO, Morilak DA. Chronic treatment with desipramine improves cognitive performance of rats in an attentional set-shifting test [J]. Neuropsychopharmacology, 2007, 32(5): 1000-1010.
[28] Gobert A, Rivet JM, Cistarelli L, et al. α2-α adrenergic receptor blockade markedly potentiates duloxetine- and fluoxetine-induced increases in noradrenaline, dopamine, and serotonin levels in the frontal cortex of freely moving rats [J]. J Neurochem, 1997, 69(6): 2616-2619.
[29] McGaughy J, Ross RS, Eichenbaum H. Noradrenergic, but not cholinergic, deafferentation of prefrontal cortex impairs attentional set-shifting [J]. Neuroscience, 2008, 153(1): 63-71.
[30] Tait DS, Brown VJ, Farovik A, et al. Lesions of the dorsal noradrenergic bundle impair attentional set-shifting in the rat [J]. Eur J Neurosci, 2007, 25(12): 3719-3724.
[31] Bondi CO, Rodriguez G, Gould GG, et al. Chronic unpredictable stress induces a cognitive deficit and anxiety-like behavior in rats that is prevented by chronic antidepressant drug treatment [J]. Neuropsychopharmacology, 2008, 33(2): 320-331.
[32] Nikiforuk A. Selective blockade of 5-HT7 receptors facilitates attentional set-shifting in stressed and control rats [J]. Behav Brain Res, 2012, 226(1): 118-123.
[33] Lapiz-Bluhm MD, Soto-Pina AE, Hensler JG, et al. Chronic intermittent cold stress and serotonin depletion induce deficits of reversal learning in an attentional set-shifting test in rats [J]. Psychopharmacology (Berl), 2009, 202(1-3): 329-341.
[34] Hatcher PD, Brown VJ, Tait DS, et al. 5-HT6 receptor antagonists improve performance in an attentional set shifting task in rats [J]. Psychopharmacology (Berl), 2005, 181(2): 253-259.
[35] Burnham KE, Baxter MG, Bainton JR, et al. Activation of 5-HT(6) receptors facilitates attentional set shifting [J]. Psychopharmacology (Berl), 2010, 208(1): 13-21.
Research progress of the attentional set-shifting task in rodents
HOU Lan-wei1, SUN Hong-wei1, WANG Gang2, LIAN Bo3, JIANG Neng-zhi1, SUN Lin1, 2*
(1. Department of Psychology; 2. Laboratory for Cognitive Neuroscience; 3. School of Bioscience and Technology, Weifang Medical University, Shandong,Weifang 261053,China)
Attentional set-shifting tasks are used as a measure of human fronto-executive function. the cognitive processes involved in forming an attentional set, maintaining an attentional set and shifting an attentional set are vulnerable to dysfunction arising from a number of human neurological disorders (such as attentional deficit/hyperactivity disorder, depression, schizophrenia) and neurodegenerative diseases (such as Parkinson’s, Huntington’s, Alzheimer’s diseases). Recently, researches on rodents mainly continue to illustrate normal rats which are caused by different operating different performance in the attentional set-shifting tasks. And also there are few studies committed to observe the adaptability of the rats in attentional set-shifting tasks as well as different performance between species of rodents in attentional set shifting tasks. In addition, these results have elucidated the roles of multiple neurotransmitters in the manifestation of cognitive processes. This review focuses on the methodology of the attentional set-shifting tasks and the role of the neurotransmitter in cognitive processes.
Attentional set shifting task(ASST); Rodents; Dopamine; Acetylcholine; 5-serotonin; Norepinephrine
SUN Lin. E-mail: linsun2013@wfmc.edu.cn
山东省优秀中青年科学家科研奖励基金计划项目(编号:BS2014YY043);山东省自然科学基金项目(编号:ZR2014CL012);潍坊医学院科技创新研究基金项目(编号:K1301011);潍坊医学院教育教学改革与研究基金项目(编号:2015Y024)。
侯兰伟(1996-),男,专业:心理应激及物质成瘾实验动物病理模型及行为学研究。E-mail: weilanhou2014wfmc@163.com
孙琳,女,讲师,博士研究生,研究方向:心理应激及物质成瘾的脑机制及药物研究。E-mail: linsun2013@wfmc.edu.cn
Q95-33
A
1005-4847(2017)03-0340-05
10.3969/j.issn.1005-4847.2017.03.020
2016-08-29

