餐厨垃圾厌氧发酵制氢技术的研究进展
刘新媛,鲍振博,彭锦星,杨磊,施煜,刘华
(天津农学院 工程技术学院,天津 300384)
餐厨垃圾厌氧发酵制氢技术的研究进展
刘新媛,鲍振博,彭锦星,杨磊,施煜,刘华
(天津农学院 工程技术学院,天津 300384)
餐厨垃圾厌氧发酵制氢技术实现了城市固体废弃物向清洁能源的转化,有利于餐厨垃圾的资源化利用。本文介绍了厌氧发酵制氢机理,从产氢菌、工艺运行参数和抑制因子三方面讨论了餐厨垃圾发酵过程的影响因素。餐厨垃圾发酵制氢工艺已达到中试试验规模,但如何实现该工艺的高效稳定连续运行仍是研究热点。
餐厨垃圾;制氢;厌氧发酵;工艺调控;抑制因子
餐厨垃圾是生活垃圾的重要组成部分,其排放量大、含水率高且富含多种有机物和无机物,极易腐坏变质,引发严重的环境问题,餐厨垃圾的处理处置是对城市固体废弃物管理的极大挑战。另一方面,餐厨垃圾也是重要的生物质资源,通过厌氧发酵技术将餐厨垃圾转化为可再生能源物质,也实现了餐厨废弃物的减量化、稳定化处理。传统厌氧发酵技术注重提高有机质向甲烷的转化效率,而忽略了发酵中间产物——氢气的收集。氢气作为单位质量热值最高的气体,其燃烧无温室气体产生,是最理想的清洁燃料,开发高效无污染的氢能可有效缓解传统化石燃料资源紧缺的现状及化石燃料引起的大气污染现象。目前,氢气仍然主要采用高耗能、高技术要求、低产率的制备方法,如化学法、电解法、水煤气变换法及水蒸气重整法等,利用这些技术将氢元素从化合态的水或烃类物质中分离而得到单质氢,并且部分制氢原料本身即为可直接利用的燃料[1]。与传统的制氢技术相比,餐厨垃圾厌氧发酵制氢技术即有利于有机废弃物的资源化利用,也有助于高效低能耗制氢技术的开发。
餐厨垃圾厌氧发酵制氢技术属于生物制氢技术领域,主要过程为在厌氧或缺氧条件下利用产氢微生物等多种微生物共同作用,将餐厨垃圾中复杂的有机物水解酸化,同时产生氢气和二氧化碳等发酵气体。与所有生物发酵过程相同,餐厨垃圾厌氧发酵制氢过程也受到产氢菌种类及接种污泥预处理方式、发酵工艺运行参数和抑制因子等影响[2]。
本文将从生物制氢原理、餐厨垃圾发酵制氢工艺的影响因素以及餐厨垃圾发酵制氢技术的研究规模等方面,介绍餐厨垃圾厌氧发酵制氢技术的研究进展。
1 生物制氢的原理
生物制氢的过程是氢离子得电子转化为氢气的酶催化反应,实现这一过程的主要代谢途径包括以下 3种:(1)丙酮酸脱羧产氢途径;(2)辅酶I(NADH)氧化还原平衡调节的产氢作用;(3)产氢产乙酸菌的产氢作用[3]。产氢微生物是生物制氢的功能菌群,在餐厨垃圾发酵系统中,常见的产氢菌有梭状芽孢杆菌属(Clostridium)、肠杆菌科(Enterobacteriacea)、拟杆菌属(Bacteroides)和嗜热厌氧菌属(Thermoanaerobium)等。产氢菌中含有催化氢离子得电子的酶系统,氢酶主要有固氮酶、Ni-Fe氢化酶和 Fe-Fe氢化酶等,其中Fe-Fe氢化酶和 Ni-Fe氢化酶的产氢活性较高,但二者也可能催化产氢的逆反应而导致吸氢反应的发生[4]。所以,在高效产氢的发酵系统中,不仅需要维持较高的产氢菌丰度,也要创造适宜氢酶催化产氢的环境。
餐厨垃圾中包含大量碳水化合物、蛋白质和脂类等复杂有机物,在厌氧发酵过程中,复杂有机物经过水解酸化转化为小分子物质。有机物厌氧发酵产氢过程中,氢元素无法完全以氢气的形式释放,大量氢元素仍以化合态的形式存在于各种脂肪酸中。根据末端代谢产物种类的不同,厌氧发酵制氢代谢类型主要有乙酸型发酵、丁酸型发酵和乙醇型发酵[5-6]。以葡萄糖为例,葡萄糖产氢的乙酸、丁酸和乙醇型发酵分别如式 1~式 3所示。由式1~式3可知,1 mol葡萄糖发酵产氢,通过乙酸型发酵可产生4 mol氢气,而通过丁酸和乙醇型发酵只能生成2 mol氢气。所以,乙酸型发酵的厌氧发酵制氢过程可显著提高氢气产率。此外,Sun等人发现了以2,3-丁二醇和乙醇为主要代谢产物的产氢发酵途径[7]。

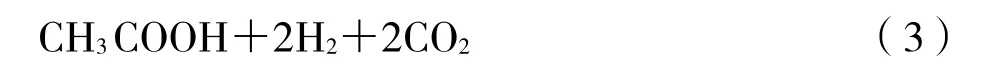
然而,有机物厌氧发酵过程中也存在不产氢甚至消耗氢气的代谢过程,如丙酸型发酵、乳酸型发酵、同型产乙酸过程及嗜氢产甲烷过程等[8-9]。当液相代谢产物中只含有丙酸、乳酸等成分时,有机物中的氢元素将无法转移到氢气中。当气相中检测到一定浓度的甲烷,则通常难以顺利收集到高浓度氢气。
餐厨垃圾中的各种有机物在厌氧发酵时也会出现产氢和耗氢的代谢过程,为了维持一定的氢气产率,需要采取措施以促进高效制氢的代谢途径并控制耗氢的代谢过程。所以,有必要了解餐厨垃圾厌氧发酵制氢的主要影响因素及其作用方式。
2 餐厨垃圾发酵产氢的影响因素
2.1 产氢菌的种类
产氢菌是将有机物转化为氢气的主体,其种类、数量和产氢特性直接影响着发酵产氢系统的运行性能。目前,已分离、纯化出多种产氢菌,并研究了产氢菌的形态特征、生理生化特性及产氢特性。Clostridium属的菌株通常是革兰氏阳性、杆状的专性厌氧菌,能形成孢子,其中,丙酮丁醇梭菌(Clostridium acetobutylicum)纯培养的氢气产率分别为2.0 mol/mol葡萄糖[10]。而肠杆菌属(Enterobacter)的菌株通常是革兰氏阴性、杆状的兼性厌氧菌。据报道,阴沟肠杆菌(Enterobacter cloacae)的氢气产率约为707 mL/L[7]。产气肠杆菌(Enterobacter aerogenes)和丁酸梭菌(Clostridium butyricum)混合培养处理苹果渣水解液和粗甘油的混合底物,氢气产率达26.07 mmol/L底物[11]。嗜热厌氧杆菌属(Thermoanaerobacterium)主要存在于高温产氢体系中,能形成孢子,通常为革兰氏阳性菌,其中热解糖热厌氧杆菌(Thermoanaerobacterium thermosaccharolyticum)的氢气产率为2.5 mol/mol葡萄糖[12]。
大量文献利用部分产氢菌能够形成孢子的特性,采用极端环境条件处理接种污泥,以灭活非产氢菌和耗氢菌并富集产氢菌。常见的接种污泥预处理方式有热处理、曝气预处理、酸处理、碱处理、化学药剂处理、超声、冻融等处理方式[13]。然而,接种污泥预处理方式会灭活部分无法形成孢子的产氢菌,如 Enterobacter属,从而降低了产氢菌的多样性,不利用发酵系统的稳定性。在餐厨垃圾两相发酵产氢产甲烷的研究中,Chu等人接种未处理的消化污泥,通过工艺运行参数控制成功地筛选出产氢菌[14]。此外,还有部分研究直接利用发酵底物的土著微生物中的产氢菌,不外加接种污泥[15]。
2.2 发酵工艺运行参数
2.2.1 温度
发酵温度是产氢酶促反应的关键影响因素,在发酵产氢效率、代谢途径和微生物群落结构上均有影响。发酵产氢的最适温度一般可分为中温(35~37 ℃)和高温两种(55~60 ℃),另外少数研究中的极高温度条件(70 ℃左右)也有良好的产氢效果[16],然而极高温度消耗过多能源、极大地增加制氢成本。高温发酵条件有利于提高有机物水解程度、提高产氢效率以及杀灭病原菌等优点,而中温发酵工艺的耗能较少,有害代谢产物较少。
2.2.2 pH值
发酵体系的pH值也是氢气产率、底物降解效率、微生物群落结构的关键影响因素,通常产氢反应器适宜的pH值在5.0~6.0之间。在长期运行的餐厨垃圾发酵反应器中,用碱液冲击,即将pH值提高到12.5维持1 d,氢气产率可提高1倍[17]。这是由于产氢菌在强碱环境中形成孢子,而其他杂菌被灭活。此外,初始pH值对发酵类型有较大影响。研究表明,pH值在4.5~6.0时,倾向于出现乙酸型发酵和丁酸型发酵,而在中性和较高的pH值条件下,易出现乙醇型发酵和丙酸性发酵[15]。
2.2.3 水力停留时间(HRT)
在餐厨垃圾发酵产氢工艺中,HRT通常在1~2 d。HRT过短则反应不充分,HRT过长则反应器体积过大,并且较长的HRT可能造成产氢反应器中甲烷菌的累积。在餐厨垃圾两相厌氧发酵产氢产甲烷工艺中,产氢阶段处于较低的 pH值环境和较短的HRT能有效地分离产氢阶段和产甲烷阶段[14]。
2.2.4 营养配比
产氢微生物的生长和繁殖应按需求供给碳源、氮源、磷源和各种微量元素,所以发酵底物的营养配比应较为合理。餐厨废物发酵产氢连续性试验中,当碳氮比(C/N)为20时,氢气产率最高,并且液相代谢产物中乳酸、丙酸和戊酸的含量较低[8]。棕榈油厂废物产氢试验中,氢气产率最高时的C/N和碳磷比(C/P)分别为74和559[17]。不同研究中得到不同的最佳C/N和C/P,可能是由于发酵体系中的优势微生物的种类不同。厌氧发酵过程中,重金属等微量元素含量过高将对微生物产生毒性,含量过低则影响微生物的正常代谢。以牧草堆肥为接种物,餐厨废物发酵产氢的最佳Fe2+浓度为 132 mg/L,相应的氢气产率为 77 mL/g[18]。
餐厨垃圾的有机质浓度、C/N和 C/P相对较高,厌氧发酵过程中极易过酸而造成发酵产氢工艺运行失败。部分研究采用混合发酵技术来调节发酵底物的营养配比,其中C/N和C/P较低的污泥和畜禽粪便常用来与餐厨垃圾混合发酵。餐厨垃圾和剩余污泥混合时,当餐厨垃圾占发酵底物挥发性固体总量的 85%时,氢气产率达 106.4 mL/g,高于餐厨垃圾单独发酵[19]。
2.3 产氢抑制因子
2.3.1 氢气
在厌氧发酵过程中,长链脂肪酸、挥发酸、氨基酸和碳水化合物等物质发生厌氧氧化产氢产乙酸反应,从热力学角度讲,该反应只有在氢气分压较低时才能发生[20]。试验证明,向产氢反应器中通入氮气或者采用强化搅拌的措施,使溶解性氢气逸出,能够大幅提高氢气产率[21]。然而,增强搅拌会大幅增加运行费用,充氮气则会降低产气中氢气浓度,不利于后续的分离利用,仍需要开发更经济有效的降低氢气分压的方法。
2.3.2 氧气
由于产氢菌多为专性厌氧菌或兼性厌氧菌,其中专性厌氧菌对氧气十分敏感,氧气影响其生长和代谢。为了使专性厌氧菌发挥产氢作用,应控制氧气浓度,使用气密性良好的反应器。兼性厌氧菌的敏感度较低,通常认为兼性厌氧菌具有更强的适应性,更利于发酵产氢系统的稳定性。事实上,氧气主要是通过使氢酶发生不可逆的抑制而发挥作用,多数兼性厌氧产氢菌对氧分压有较强的耐受性,能够快速去除进入发酵基质中的少量氧气,所以细菌本身能够为氢酶提供保护,并且兼性厌氧菌也有利于帮助与其混合的专性厌氧菌在有氧的条件下进行产氢代谢[13]。
2.3.3 氨氮
厌氧发酵过程中,氨氮的生成主要来自蛋白质、含氮脂类以及核酸的降解过程,由于这些高分子化合物不断降解,氨氮不断产生。产氢发酵过程需要一定的氨氮,然而氨氮浓度过高也会抑制氢气的产生。据报道,氨氮浓度低于2 000 mg/L时,氨氮对氢气产量和产率的影响较小[22]。此外,氨氮在维持发酵系统pH值方面发挥一定作用。
2.3.4 液相代谢产物
有机物厌氧发酵产氢反应体系中,伴随着氢气的生成,液相中乙醇和挥发性脂肪酸(VFA)的含量也会增加。VFA的产生将导致发酵液的pH值降低,而乙醇浓度过高将影响产氢微生物的生长,代谢产物的累积将降低产氢效率。葡萄糖发酵产氢试验中,分别向发酵体系中外加300 mmol/L的乙醇、乙酸、丙酸和丁酸,氢气产量从274 mL分别降低了156.0、225.2、252.5和248.4 mL,说明液相代谢产物对产氢过程具有较强的抑制作用[23]。为防止液相代谢产物的累积,应控制好HRT和有机负荷率,既要防止代谢产物快速生成,也要将代谢产物从发酵系统中及时排出。
3 餐厨垃圾发酵制氢工艺的发展前景和展望
目前,餐厨垃圾发酵制氢的研究已经达到了中试试验水平,已有很多成功运行的实例。Lee等人运行两相厌氧发酵产氢产甲烷系统处理餐厨垃圾,产氢和产甲烷反应器体积分别为500 L和2 300 L,均接种厌氧污泥,在中温条件下发酵,两相反应器的产气量可分别达2 500~2 800 L/d和13 000~15 000 L/d,氢气和甲烷在生物气中所占的比例分别为60%和81%~83%[24]。Ren等运行糖蜜废水发酵产氢工艺,产氢反应器的有效容积为1.48 m3,该反应器连续运行200 d,最大日产氢量达 5.57 m3/(m3·d)[25]。
餐厨垃圾发酵产氢工艺的影响因素较多,较难高效稳定运行,连续性运行的报道仍然较少。所以,对于餐厨垃圾发酵产氢工艺,在工艺控制,参数优化、优势产氢微生物丰度的维持等方向仍是具有一定研究意义。此外,连续流搅拌反应器使用最为广泛,而该反应器无法有效地分离水力停留时间和污泥停留时间,产氢微生物流失严重,有机负荷率较低,产氢效率较低。近年来,研究人员将高效厌氧发酵反应器应用于厌氧发酵制氢技术中,其中利用升流式厌氧污泥床工艺处理有机废水,可大幅提高产氢效率[20]。如果开发餐厨垃圾高效厌氧发酵产氢反应器,将在提高氢气产率、降低搅拌耗能、降低成本等方面取得突破,有利于餐厨垃圾产氢工艺的工业化应用。
[1] Bičáková O,Straka P. Production of hydrogen from renewable resources and its effectiveness[J]. International Journal of Hydrogen Energy,2012,37(16):11563-11578.
[2] 王步江,樊秀花,周娜. 发酵条件对蛋白核小球藻脂肪含量的影响[J]. 天津农学院学报,2012,19(1):34-37.
[3] 李宇亮,李小明,郭亮,等. 污泥发酵制氢技术的现状和展望[J]. 中国沼气,2008,26(1):3-7.
[4] Mathews J,Wang G. Metabolic pathway engineering for enhanced biohydrogen production [J]. International Journal of Hydrogen Energy,2009,34(17):7404-7416.
[5] Liu X Y,Zhang H,Yong-Feng L I. Influences of hydraulic retention time on the ethanol type fermentation hydrogen prouduction system in a hybrid anaerobic baffled reactor[J].Environmental Science,2014,35(6):2433-2438.
[6] Ratti R P,Delforno T P,Okada D Y,et al. Bacterial communities in thermophilic H2-producing reactors investigated using 16S rRNA 454 pyrosequencing[J].Microbiological Research,2015,173:10-17.
[7] Sun L, Huang A, Gu W, et al. Hydrogen production by Enterobacter cloacae isolated from sugar refinery sludge [J].International Journal of Hydrogen Energy,2015,40(3):1402-1407.
[8] Kim D H,Kim S H,Kim K Y,et al. Experience of a pilot-scale hydrogen-producing anaerobic sequencingbatch reactor (ASBR) treating food waste[J]. International Journal of Hydrogen Energy,2010,35(4):1590-1594.
[9] Ray S,Saady N M C,Lalman J A. Diverting electron fluxes to hydrogen in mixed anaerobic communities fed with glucose and unsaturated C18long chain fatty acids[J].Journal of Environmental Engineering-Asce,2010,136(6):568-575.
[10] Chin H L,Chen Z S,Chou C P. Fedbatch operation using Clostridium acetobutylicum suspension culture as biocatalyst for enhancing hydrogen production[J].Biotechnology Progress,2003,19(2):383-388.
[11] Pachapur V L,Sarma S J,Brar S K,et al. Biohydrogen production by co-fermentation of crude glyserol and apple pomace hydrolysate using co-culture of Enterobacter aerogenes and Clostridium butyricum[J]. Bioresource Technology,2015,193:297-306.
[12] Singh S,Sarma P M,Lal B. Biohydrogen production by Thermoanaerobacterium thermosaccharolyticum TERI S7 from oil reservoir flow pipeline[J]. International Journal of Hydrogen Energy,2014,39(9):4206-4214.
[13] Wong Y M,Wu T Y,Juan J C. A review of sustainable hydrogen production using seed sludge via dark fermentation[J]. Renewable and Sustainable Energy Reviews,2014,34(34):417-482.
[14] Chu C F,Li Y Y,Xu K Q,et al. A pH- and temperaturephased two-stage process for hydrogen and methane production from food waste[J]. International Journal of Hydrogen Energy,2008,33(18):4739-4746.
[15] Cappai G,Gioannis G D,Friargiu M,et al. An experimental study on fermentative H2production from food waste as affected by pH[J]. Waste Management,2014,34(8):1510-1519.
[16] Kongjan P,Min B,Angelidaki I. Biohydrogen production from xylose at extreme thermophilic temperatures(70 ℃)by mixed culture fermentation [J]. Water Research,2009,43(5):1414-1424.
[17] O-Thong S,Prasertsan P,Intrasungkha N, et al.Optimization of simultaneous thermophilic fermentative hydrogen production and COD reduction from palm oil mill effluent by Thermoanaerobacterium-rich sludge[J].International Journal of Hydrogen Energy,2008,33(4):1221-1231.
[18] Lay J J,Fan K S,Hwang J I,et al. Factors affecting hydrogen production from food wastes by Clostridium-rich composts[J]. Journal of Environmental Engineering,2005,131(4):595-602.
[19] Liu X Y,Li R Y,Ji M,et al. Hydrogen and methane production by co-digestion of waste activated sludge and food waste in the two-stage fermentation process:Substrate conversion and energy yield[J]. Bioresource Technology,2013,146:317-323.
[20] Kongjan P,Jariyaboon R,O-Thong S. Anaerobic digestion of skim latex serum (SLS) for hydrogen and methane production using a two-stage process in a series of up-flow anaerobic sludge blanket (UASB) reactor [J].International Journal of Hydrogen Energy,2014,39(33):19343-19348.
[21] Guo X M,Trably E,Latrille E,et al. Hydrogen production from agricultural waste by dark fermentation: a review[J].International Journal of Hydrogen Energy,2010,35(19):10660-10673.
[22] Salerno M B,Park W,Zuo Y,et al. Inhibition of biohydrogen production by ammonia[J]. Water Research,2006,40(6):1167-1172.
[23] Wang B,Wan W,Wang J. Inhibitory effect of ethanol,acetic acid, propionic acid and butyric acid on fermentative hydrogen production[J]. International Journal of Hydrogen Energy,2008,33(23):7013-7019.
[24] Lee Y W,Chung J. Bioproduction of hydrogen from food waste by pilot-scale combined hydrogen/methane fermentation[J]. International Journal of Hydrogen Energy,2010,35(21):11746-11755.
[25] Ren N Q,Li J Z,Li B K,et al. Biohydrogen production from molasses by anaerobic fermentation with a pilot-scale bioreactor system[J]. International Journal of Hydrogen Energy,2006,31(15):2147-2157.
责任编辑:杨霞
Review of Biohydrogen Production by Anaerobic Fermentation of Food Waste
LIU Xin-yuan, BAO Zhen-bo, PENG Jin-xing, YANG Lei, SHI Yu, LIU Hua
(College of Engineering and Technology, Tianjin Agricultural University, Tianjin 300384, China)
Anaerobic biohydrogen production from food waste converts municipal waste to clear energy and thus this technology is benefit for the resource recycling of food waste. This paper introduced the mechanisms of biohydrogen production, and discussed the influence factors of anaerobic biohydrogen production on the aspects of hydrogen production bacteria, operational parameters and inhibitors. The pilot-scale study of biohydrogen production process from food waste had already been reported,while it was still attractive to obtain the high-efficient, stable and continuous-operational performance for hydrogen production process from food waste.
food waste; hydrogen production; anaerobic fermentation; process control; inhibitors
X705
:A
2016-06-17
天津农学院实验教学中心改革项目“气相色谱仪测定甲烷浓度的功能开发”(2015SY015)
刘新媛(1987-),女,天津市人,讲师,博士,主要从事固体废弃物厌氧发酵和再生利用方面的研究。E-mail:liuxinyuan11@163.com。
1008-5394(2017)02-0095-05

