灸法早期干预对5XFAD转基因小鼠β淀粉样蛋白1-40表达的影响
余静,包烨华,张永生,楚佳梅
(1.杭州市中医院,杭州 310007;2.浙江中医药大学,杭州 310053)
灸法早期干预对5XFAD转基因小鼠β淀粉样蛋白1-40表达的影响
余静1,包烨华1,张永生2,楚佳梅1
(1.杭州市中医院,杭州 310007;2.浙江中医药大学,杭州 310053)
目的探讨灸法早期干预对阿尔茨海默病模型(AD)小鼠脑内Aβ1-40的影响,对艾灸防治AD的作用机制进行探讨。方法PCR法鉴定转基因AD传代小鼠的基因表型,选取1.5月龄雌性转基因阳性Tg6799小鼠随机分为模型组9只和治疗组8只,同龄、同背景的C57BL/6J野生型雌性小鼠9只为正常组。治疗组进行双侧心俞、肾俞麦粒灸治疗,治疗结束后,应用免疫组化法检测小鼠额叶皮层及海马区Aβ1-40的表达水平。结果与模型组比较,治疗组小鼠大脑额叶皮层和海马区Aβ1-40表达明显减少(P<0.01,P<0.05)。结论艾灸疗法早期干预可减少AD模型小鼠脑内Aβ1-40的表达,延缓AD病理过程的进展。
阿尔茨海默病;5XFAD转基因小鼠;麦粒灸;早期干预;β淀粉样蛋白1-40
阿尔茨海默病(Alzheimer's disease,AD)是一种渐进性的神经系统退行性疾病,由德国神经解剖学家和精神病医生Alois Alzheimer于1906年首次发现并报道[1]。AD发生的比例约占痴呆的 60%~70%,是痴呆中最常见的一种形式[2-4],其起病隐匿,病程呈进行性恶化,记忆障碍是该病早期最突出的症状,随着病情的发展,逐渐出现其他认知功能障碍,精神、行为障碍和日常生活能力下降等[5-6]。随着老龄化社会的到来,AD的发病率不断上升,成为老年人病亡率的第4位,严重威胁着人类健康和社会发展[7-8],因此 AD的早期研究、早期防控、对症治疗具有很大意义[9]。目前,尚缺乏安全、有效、经济的AD治疗药物,西药如盐酸美金刚、盐酸多奈哌齐均为单一作用靶点,长期使用不良反应明显[10-13]。随着科学的发展,医学发展也开始着重于以预防为主,传承了中医学“治未病”的重要思想[14-16]。艾灸疗法作为中医特色疗法,具有延年益寿、保健及预防疾病的功效[17-19]。研究发现艾灸能调节内分泌系统、免疫系统、自由基代谢等,提高机体的抗病能力[20-23]。研究表明,Aβ1-40寡聚体能够通过激活 N-甲基-D-天冬氨酸受体,导致在组建突触后膜致密体和在突触囊泡转运中起着核心与重要作用的 PSD95(postsynaptic density protein 95,PSD95)和发动机蛋白(motor proteins, MP)的降解,扰乱突触的可塑性和完整性,并且能够加重 Tau蛋白的过度磷酸化,影响 AD小鼠早期行为记忆功能[24]。本实验通过观察在AD病理早期介入麦粒灸治疗对可以共同表达5个家族性阿尔茨海默病(familial Alzheimer's disease,FAD)基因突变的 5XFAD转基因小鼠脑内β淀粉样蛋白1-40(β-amyloid protein1-40,Aβ1-40)表达的影响,对艾灸防治AD的作用机制进行探讨。
1 材料与方法
1.1 实验动物
B6SJL-Tg(APPSwFlLon,PSEN1*M146L*L286V)6799 Vas/J品系转基因AD小鼠杂合体种鼠4只,由中科院上海生命科学院生化所景乃禾研究员惠赠,配种鼠由中科院上海实验动物中心/上海斯莱克实验动物有限公司提供[SCXK(沪)2007-0005]。饲养于浙江中医药大学动物实验研究中心 SPF级转基因动物室,并进行保种、繁衍后代。繁殖体系为雄性的杂合子小鼠与野生型雌性小鼠交配。出生的子代小鼠在3~4星期后剪尾鉴定。本研究中动物实验严格遵循实验动物伦理审查所依据的动物保护原则、动物福利原则、伦理原则和综合性科学评估原则。
1.2 主要试剂及仪器
1.2.1 主要试剂
艾绒(中国汉医艾绒);琼脂糖凝胶、溴乙锭(EB)(上海生工生物工程有限公司);10%水合氯醛(批号02030,上海化学试剂有限公司);PBS磷酸盐缓冲液(ZLI-9062)(北京中杉金桥生物技术有限公司);兔抗Aβ1-40(批号为 bs-0877R,北京博奥森生物技术有限公司);SP试剂盒(批号为 13152A10,北京中杉金桥生物技术有限公司);浓缩型 DAB试剂盒(ZLI-9032)(批号为60882801,北京中杉金桥生物技术有限公司)。
1.2.2 主要仪器
PTC-200 PCR扩增仪(Biorad公司);台式冷冻离心机(Thermo公司);脱水机STP120(Micron公司);包埋机 AP280-2(Micron公司);切片机 HM335E(Micron公司)。
1.3 方法
1.3.1 PCR法鉴定APP/PS1转基因小鼠基因表型
繁殖所产生雌性后代共29只,3周龄时剪取小鼠鼠尾(约 0.5 cm)放入 1.5 mL离心管内。每管中加入 0.5 mL裂解液,56℃转动 2 h以上或过夜。离心20 min,取上清,加入等体积异丙醇混匀,放置30 min; 12000 rmp离心10 min,沉淀DNA。琼脂糖凝胶电泳检测 DNA片段,制备2%琼脂糖凝胶加溴化乙锭5 μL,加入扩增后 DNA10 μL,120 V,30 min 电泳,观察PCR产物长度。
1.3.2 动物分组和治疗方法
PCR检测结束后,共有APP/PS1双转基因鉴定结果为阳性的雌性小鼠17只,1.5月龄时将17只雌性小鼠按随机数字表随机分为模型组和治疗组(模型组9只,治疗组8只)。同龄、同背景的C57BL/6J阴性纯合子(野生型)雌性小鼠9只(1.5月龄)为正常组。
1.5 月龄时开始进行治疗。治疗组,人工固定小鼠,以麦粒大小圆锥形艾炷(直径5 mm,高8 mm)灸双侧心俞穴和肾俞穴,艾炷燃烧至3/5,即去除,每次灸1壮,每壮时间约25~30 s。正常组和模型组给予抓取、固定及放置未燃烧的艾炷等刺激。小鼠治疗时间均为每日1次,10次为1个疗程,共治疗9个疗程,疗程之间间隔2 d(治疗全部结束后小鼠为5月龄)。在治疗过程中,治疗组小鼠死亡1只,模型组死亡2只,考虑是因体质虚弱而死亡。
1.3.3 样本取材处理
治疗结束后,各组小鼠腹腔注射 10%水合氯醛(0.3 mL/100 g)进行麻醉,打开胸腔,经升主动脉及左心室灌注生理盐水及 4%多聚甲醛,灌注固定后断头,完整取出小鼠脑,置4%多聚甲醛中固定24 h后常规石蜡包埋。包埋完成后,于每只小鼠脑组织包埋蜡块视交叉前、后连续冠状切片。
1.4 观察指标
免疫组化法检测Aβ1-40表达。石蜡切片脱蜡至水,3%H2O2孵育10 min;PBS洗 5 min×3次。滴加封闭用正常山羊血清孵育1 h,倾弃,勿洗,滴加适合浓度稀释的一抗(Aβ1-401:150),移至 4℃冰箱孵育过夜。次日 PBS冲洗,滴加二抗,37℃孵育1 h,PBS洗5 min×3次。滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37℃孵育1 h,PBS冲洗5 min×3次;滴加DAB显色剂,显微镜下观察显色情况,苏木素复染,脱水,树脂封片,显微镜观察。采用Carl Zeiss Imaging Systems图像分析仪拍照,每张切片海马区和额叶皮层各取 6个视野(×40),采用计算机图像分析软件Image Pro-plus5.0进行分析,测量其阳性面积(area)、总光密度值(Integrated optical density, IOD)并进行汇总。
1.5 统计学方法
采用SPSSl7.0对数据进行统计分析,各组数据结果描述均以均数±标准差表示。多组间比较采用单因素方差分析(One-Way-ANOVA),组间两两比较,方差齐时采用LSD检验;方差不齐,采用Dunnett’s T3检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 APP/PS1转基因小鼠基因表型鉴定结果
本实验所用的 APP/PS1双转基因小鼠表型稳定,PCR法鉴定子代小鼠基因型,PCR产物长度为Tg(APP),转基因 377bp,野生型324bp;Tg(PS1),转基因 608bp,野生型324bp。
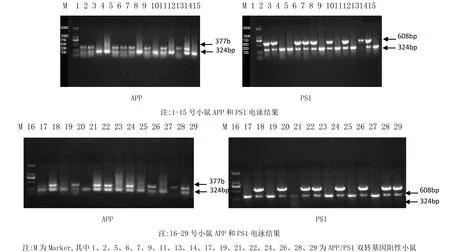
图1 PCR法鉴定APP/PS1转基因小鼠的凝胶电泳分析
所生雌性子代小鼠共29只,其中PCR产物长度为Tg(APP)377bp、Tg(PS1)608bp的APP/PS1双转基因阳性雌性小鼠17只作为本次实验的研究对象,随机分组为模型组(9只)和治疗组(8只)。
2.2 各组小鼠额叶皮层及海马区Aβ1-40表达的变化
各组小鼠海马区和额叶皮层均可见棕黄色阳性表达,反应部位位于细胞胞浆和胞膜,细胞核呈阴性。与正常组比较,模型组小鼠额叶皮层及海马区Aβ1-40表达阳性面积明显增加,差异显著(P<0.01),总光密度值增高(P<0.01);与模型组比较,艾灸治疗后,治疗组小鼠海马区 Aβ1-40表达显著下降(P<0.01),额叶皮层Aβ1-40表达的阳性面积和总光密度值也明显减少(P<0.05,P<0.01);与正常组比较;治疗组小鼠脑内Aβ1-40表达水平无显著性差异(P>0.05),见图2、图3、图4。
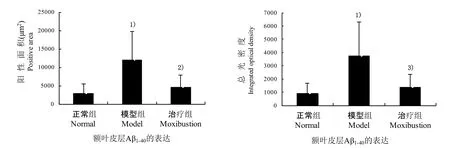
图2 各组小鼠额叶皮层Aβ1-40表达的阳性面积和总光密度比较

图3 各组小鼠海马区Aβ1-40表达的阳性面积和总光密度比较
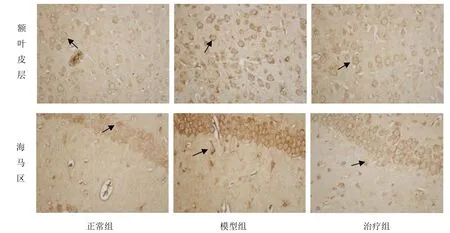
图4 各组小鼠额叶皮层及海马区Aβ1-40表达(免疫组化,×40,箭头示Aβ1-40阳性细胞)
3 讨论
β-淀粉样蛋白(β-amyloid protein,Aβ)异常堆积形成的老年斑(senile plaque,SP)是AD的主要病理特征之一[25]。目前AD的病因及发病机制尚未完全阐明,Hardy JA等[26]提出的“淀粉样蛋白级联假说”是目前较为公认的AD发病机制学说。该学说认为Aβ的产生与清除失衡引起的Aβ沉积是AD病理改变过程的始发因素和中心环节,可以引起氧化应激、轴突损伤和突触丢失等一系列级联反应,最终造成神经元死亡,导致痴呆[27-29]。目前很多国内外研究都论证了这一学说,并证明 Aβ可以激活细胞炎症因子引起神经炎症反应,诱发tau蛋白磷酸化,诱导细胞凋亡,抑制海马长时程增强,破坏突触可塑性[30-31],因此减少或消除 Aβ的形成和沉积,增加 Aβ的清除,延缓或抑制细胞凋亡的发生是研究筛选防治AD的重要趋势[32]。Aβ作为AD病理过程的一种触发分子,它是由淀粉样前体蛋白(amyloid precursor protein,APP)通过蛋白酶水解途径裂解而来[33]。在病理情况下,APP在β分泌酶和γ分泌酶的先后作用下形成 Aβ,根据切割位点不同,可形成不同长度的Aβ,一般由39~43个氨基酸组成,其中最常见的类型是 Aβ1-40和 Aβ1-42[34]。Aβ1-42具有很强的聚集能力,神经毒性大,是老年斑的主要成份,但其本身并不能形成成熟的老年斑块,只有在Aβ1-40聚集的作用下,才能形成成熟的具有神经毒性的老年斑[35]。Aβ1-40可经过血脑屏障转运进入脑,促进 Aβ1-42的积聚,加速 Aβ引起的 AD病理过程[36]。大脑皮质和海马的突触损伤是AD脑内另一个突出的神经病理学改变,在AD早期即可出现。在AD脑中,突触数量减少较神经元丧失更显著,研究发现,不论是可溶性的Aβ1-40还是不可溶性的Aβ1-40与AD脑内的突触损伤均有着很强的相关性,且引起突触损伤的相关性要大于 Aβ1-42[37]。θ节律被认为是与学习记忆密切相关的脑电波,实验研究表明,Aβ1-40隔阂内注射后,不仅可以引起胆碱能神经元及谷氨酸能神经元的大量丢失,抑制突触之间的传递联系,还可以引起海马区θ节律的紊乱,从而造成学习记忆能力功能下降[38]。本研究所选用的5XFAD(familial Alzheimer's disease,FAD)转基因小鼠可共表达β-APP Swedish突变(K670N,M671L)、Florida突变(I716V)、London突变(V717I)以及突变的早老素蛋白 1(Presinilinl,PS1)M146L、L286V 5个突变位点的基因突变,可全面、快速地模拟AD的病理过程和行为学特征[39]。5XFAD转基因小鼠能够在短期内产生APP、大量的Aβ沉积、神经胶质细胞增生,并随年龄的增加逐渐加重,逐渐出现神经元死亡、行为学异常[40]。其中Tg6799模型鼠在1.5月龄时脑内已经开始出现 Aβ1-42的聚积,随后逐渐发生Aβ1-40的显著聚积,在2月龄时,开始出现明显可见的淀粉样蛋白沉积物和胶质细胞过度增生的神经炎性反应,另研究表明,在4~5月龄时,5XFAD转基因小鼠开始表现出空间认知功能障碍[39,41]。因此,本研究选择在5XFAD转基因1.5月龄时介入麦粒灸治疗,探讨艾灸早期干预对AD病理过程进展的影响。
阿尔茨海默病属中医学“痴呆”“愚痴”“善忘”“郁证”等范畴[42-44],中医学认为“心主神明”“脑为元神之府”,《素问·灵兰秘典论》:“肾者,作强之官,伎巧出焉。”故中医学认为痴呆的发病与心、脑、肾关系密切,肾精不足、髓海空虚是其常见病因[45-47],治疗上常以培补肾元、填精益髓、健脾养心、补虚扶正为主[48]。艾灸作为传统特色疗法,已有数千年历史。在身体尚未出现病症之前或者还处于初发病阶段,采用艾灸疗法,可通过艾叶辛温之性,激发人体经络之气,温阳补虚,以达到补益人体正气,防病保健“治未病”的目的[49]。现代医学研究表明,艾绒燃烧过程中辐射的近红外线可穿透机体组织,诱导局部肌肉产生热休克蛋白,激活机体的免疫系统,达到治病强身健体的作用[50]。此外,有研究表明,艾灸可以阻止海马线粒体膜电位的耗散,抑制神经元凋亡,抑制氧化应激,改善脑能量的代谢障碍[51]。因此本研究选用心俞、肾俞进行麦粒灸法早期干预,利用艾灸灸火热力对机体的温热刺激结合两穴调节脏腑功能的作用以期达到养心安神、填精益髓之功。
随着疾病医学向健康医学的转变,医学发展的方向也逐渐转向预防为主,医学的重点将是“防患于未然”“防微杜渐”,传承了中医学“治未病”的重要思想。“治未病”思想被历代医家奉为行医治病的最佳境界,包含着未病先防、既病防变及瘥后防复三种观念。在疾病发生之前,看见疾病征兆,提前介入中医传统治疗,可预防疾病的进一步传变[52]。本研究在5XFAD转基因小鼠1.5月龄时脑内刚开始发生Aβ聚集的AD病理过程早期介入麦粒灸治疗,通过艾灸治疗后,与模型组比较,治疗组小鼠额叶皮层和海马区Aβ1-40的表达明显减少。研究结果表明,艾灸治疗AD的机制可能是通过早期抑制Aβ1-40的产生,进一步影响Aβ积聚形成成熟的具有神经毒性的产物,从而延缓 AD病理过程进展,达到“既病防变”的目的。
[1]Graeber MB, Mehraein P. Reanalysis of the first case of Alzheimer’s disease[J].Eur Ar ch Psy chiatry ClinNeurosci, 1999,249(Suppl 3):10-13.
[2]陈以丽.痴呆与轻度认知障碍的流行病学、发病机制和诊治分析[J].临床合理用药杂志,2017,(1):172-173.
[3]臧少敏.老年性痴呆的社区护理干预研究[J].护理实践与研究,2015,12(12):20-22.
[4]冯亚青,田瑞振,孙占用,等.阿尔茨海默病和血管性痴呆患者精神行为症状的特点[J].中华老年医学杂志,2006,25(2):132-133.
[5]Mendiola-Precoma J, Berumen LC, Padilla K,et al.Therapies for prevention and treatment of Alzheimer’s disease[J].Biomed Res Int, 2016:2589276.
[6]Kar S, Slowikowski SP, Westaway D,et al. Interactions between beta-amyloid and central cholinergic neurons:implications for Alzheimer’s disease[J].J Ps ychiatry Neurosci, 2004,29(6):427-441.
[7]宋筱靓.老年性痴呆病因病机探析[J].辽宁中医药大学学报,2008,10(6):70-71.
[8]官红霞,陈明达,王翔.五行学说在老年痴呆病人情志护理中的应用[J].护理研究(中旬版),2010,24(5):1290-1291.
[9]杨林,刘科,朱叶萌,等.阿尔茨海默病转基因小鼠模型在中药研究领域的应用进展[J].实验动物学,2015,32(4):59-62.
[10]余梦瑶,许晓燕,江南,等.阿尔茨海默症痰湿蕴结与β-淀粉样肽聚集及自噬相关性探讨[J].中华中医药杂志,2016,31(9):3632-3635.
[11]钱燕静,甄军丽,卫东锋,等.参芪益智颗粒对5XFAD转基因小鼠学习记忆能力和脑内β淀粉样蛋白1-42含量的影响[J].中国中医药信息杂志,2016,23(5):51-56.
[12]黄振东.观察盐酸美金刚治疗老年帕金森病痴呆患者的临床疗效及不良反应[J].中国实用医药,2014,9(18):136-137.
[13]苏秋霞,黄宝君,陈良树,等.盐酸美金刚联合盐酸多奈哌齐治疗阿尔茨海默病的临床疗效研究[J].基层医学论坛,2017,21(22):2928-2930.
[14]陈平清.中医“治未病”在社区卫生服务中的应用分析[J].中国医药指南,2012,10(26):607-608.
[15]吴翠霞.心脑血管动脉硬化症的中医治未病临床分析[J].医学信息,2013,26(3):91.
[16]游焕章.治未病在中医临床上的应用思路构建[J].中国中医药现代远程教育,2014,12(16):129-130.
[17]韩丽,赵百孝,刘铜华,等.艾灸防病保健与“长寿基因”SIRT1[J].中华中医药杂志,2015,(6):2023-2025.
[18]刘玉平.艾灸神阙在康复保健中的应用[J].中国民间疗法,2003,11(4):17-18.
[19]尹改珍,李晶.浅谈艾灸保健[J].新疆中医药,1998,16(4):24-26.
[20]姜美驰,梁静,王静蓉,等.艾灸对 AD大鼠学习记忆能力及海马Aβ、IL-1β、IL-2表达的影响[J].上海针灸杂志,2016,35(7):870-875.
[21]沈晓明,杜元灏,胡玲,等.针灸治疗更年期综合征及其机制研究近况[J].天津中医药,2003,20(4):82-84.
[22]武凤琴,陈庆伟,王茎,等.艾灸调节机体免疫功能的研究进展[J].中医药临床杂志,201,(4):454-456.
[23]詹振吉,王健.艾灸对机体免疫系统的影响[J].中医学报,2016,(3):449-452.
[24]张严.Aβ1-40寡聚体对阿尔茨海默病小鼠磷脂酰肌醇-3激酶/蛋白激酶 B信号通路的影响[D].遵义医学院,2012:21-24.
[25]García-Osta A, Cuadrado-Tejedor M. Advanced assay monitoring APP-carboxyl-terminal fragments as markers of APP processing in Alzheimer disease mouse models[J].Methods Mol Biol,2016,1303:117-123.
[26]Hardy JA, Higgins GA. Alzheimer’s disease: the amyloid cascade hypothesis[J].Science, 1992,256(5054):184-185.
[27]Cummings JL, Zhong K, Kinney JW,et al. Doubleblind, placebo-controlled, proof-of-concept trial of bexarotene Xin moderate Alzheimer’s disease[J].Alzheimers Res Ther, 2016,8:4.
[28]Storey E, Cappai R. The amyloid precursor protein of Alzheimer s disease and the Aβ peptide[J].Neuropathol Appl Neurobiol, 1999,25(2):81-97.
[29]刘炫君,杨国帅.β淀粉样蛋白所致的炎症反应在阿尔茨海默病中的作用机制[J].医学综述,2016,22(24):4803-4806.
[30]Lindhagen-Persson M, Brännström K, Vestling M,et al.Amyloid-β oligomer specificity mediated by the IgM isotype--implications for a specific protective mechanism exerted by endogenous auto-antibodies[J].PLoS One,2010,5(11):e13928.
[31]Zhao L, ZhaoY, Wan Q,et al. Urinary kallidinogenase for the treatment of cerebral arterial stenosis[J].Drug Des Devel Ther, 2015,9:5595-5600.
[32]于淼,谢宁,关慧波,等.地黄饮子对 AD模型大鼠脑内Aβ生成的干预机制[J].中华中医药杂志,2016,31(6):2281-2284.
[33]Schönherr C, Bien J, Isbert S,et a l. Generation of aggregation prone N-terminally truncated amyloid β peptides by meprin β depends on the sequence specificity at the cleavage site[J].Mol Neur odegener,2016,11:19.
[34]尹文超,曹云鹏.β淀粉样蛋白与阿尔茨海默病的新观点[J].国际神经病学神经外科学杂志,2015,42(5):455-458.
[35]张学福,曾昭毅,蒋乃昌.拟AD模型大鼠学习记忆障碍和海马CA1区Aβ1-40和nNOS的表达[J].赣南医学院学报,2007,27(1):3-6.
[36]Teich AF, Arancio O. Is the amyloid hypothesis of Alzheimer’s disease therapeutically relevant?[J].Biochem J, 2012,446(2):165-177.
[37]Lue LF, Kuo YM, Roher AE,et al. Soluble amyloid beta peptide concentration as a predictor of synaptic change in Alzheimer’s disease[J].Am J Pathol, 1999,155(3):853-862.
[38]Colom LV, Castañeda MT, Bañuelos C,et al. Medial septal beta-amyloid 1-40 injections alter septo-hippocampal anatomy and function[J].Neurobiol Aging, 2010,31(1):46-57.
[39]Oakley H, Cole SL, Logan S,et al. Intraneuronal betaamyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer’s disease mutations: potential factors in amyloid plaque formation[J].J Neurosci, 2006,26(40):10129-10140.
[40]Mariani MM, Malm T, Lamb R,et al. Neuronallydirected effects of RXR activation in a mouse model of Alzheimer’s disease[J].Sci Rep, 2017,7:42270.
[41]Wang Q, Xiao B, Cui S,et al. Triptolide treatment reduces Alzheimer’s disease (AD)-like pathology through inhibition of BACE1 in a transgenic mouse model of AD[J].Dis Model Mech, 2014,7(12):1385-1395.
[42]苏志诚,阮时宝,褚克丹,等.中医方剂治疗阿尔茨海默病的进展研究[J].中医临床研究,2017,9(8):138-141.
[43]石莹莹,胡晓灵.阿尔茨海默病的中医文献研究[J].新疆中医药,2017,35(1):63-66.
[44]侯江淇,郭蕾,张俊龙.阿尔茨海默病中医辨治探析[J].辽宁中医杂志,2017,(2):262-264.
[45]富雪婷,王尧,巴哈尔·哈德尔.中医对阿尔茨海默病的病机研究[J].新疆中医药,2016,34(4):133-135.
[46]刘文奇.阿尔茨海默病的中医辨治[J].中国社区医师,2016,32(33):14-15.
[47]杨琼芬.阿尔茨海默病的中医证治述要[J].新疆中医药,2016,34(1):59-60.
[48]谷巍,金晓仙,张燕军,等.针刺治疗阿尔茨海默病临床观察[J].中国针灸,2014,34(12):1156-1160.
[49]杨俊丽,郭文海,张婷,等.灸法在中医“治未病”中的意义[J].中医药信息,2012,29(6):86-88.
[50]曹云燕,蔡圣朝,袁卫华,等.督脉伏灸治未病的理论探讨及临床应用[J].上海针灸杂志,2012,31(10):771-772.
[51]沈洁,艾炳蔚,沈梅红.艾灸对亚健康状态的防治作用[J].中国医药导报,2016,36(13):91-92.
[52]齐文升,方药中.浅谈对《金匮要略》治未病的认识及临床运用[J].中医研究,1993,6(1):15-17.
Effect of Early Moxibustion Intervention on the Expression of Amyloid β-protein1-40in 5XFAD Transgenic Mice
YU Jing1,BAO Y e-hua1,ZHANG Y ong-sheng2,CHU Jia-mei1.1.Hangzhou Hosp ital o f T raditional Chinese Medicine,Hangzhou310007,China; 2.Zhejiang University of Traditional Chinese Medicine,Hangzhou310053,China
ObjectiveTo explore effect of early moxibustion intervention on cerebral Aβ1-40in a mouse model of Alzheimer disease (AD) and the mechanism of action of moxibusion in preventing and treating AD. Method Gene phenotype in transgenic AD passage mice was identified using PCR. One and a half-month-old female Tg6799 transgenic mice were randomly allocated, including nine mice to a model group and eight mice to a treatment group.Nine C57BL/6J wild type female mice of the same age and background constituted a normal control group.Wheat-grain-sized moxa cone moxibustion on bilateral points Xinshu(BL15) and Shenshu(BL23) was given to the treatment group. After the completion of treatment, Aβ1-40expression in mouse frontal cortex and hippocampal region was determined using the immunohistochemical method.ResultAβ1-40expression in mouse frontal cortex and hippocampal region decreased significantly in the treatment group compared with the model group (P<0.01,P< 0.05).ConclusionEarly moxibustion intervention can decrease cerebral Aβ1-40expression and delay AD pathological process in a mouse model of AD.
Alzheimer disease; 5XFAD transgenic mice; Wheat-grain-sized moxa cone moxibustion; Early intervention; Amyloid β-protein1-40
R2-03
A
2017-03-12
1005-0957(2017)10-1253-07
10.13460/j.issn.1005-0957.2017.10.1253
浙江省自然科学基金项目(LY13H270002)
余静(1989—),女,医师,硕士,Email:zegnajing@163.com
包烨华(1972—),女,主任医师,硕士,研究方向为针灸治疗脑功能障碍性疾病的基础与临床研究,Email:13336101400@163.com

