利用mRNA差异显示技术筛选线果芥抗旱相关基因
朱燕飞,陈全家,曲延英
(新疆农业大学农业生物技术重点实验室,乌鲁木齐 830052)
利用mRNA差异显示技术筛选线果芥抗旱相关基因
朱燕飞,陈全家,曲延英
(新疆农业大学农业生物技术重点实验室,乌鲁木齐 830052)
目的十字花科短命植物线果芥在新疆干旱环境下生长,具有较强的抗旱性,研究十字花科短命植物线果芥的抗旱机制。为进一步了解线果芥的抗旱机理和从野生植物资源中发掘一些优异的抗逆基因奠定基础。方法用20% PEG6000处理3~4周的线果芥幼苗,分别提取0、3、6、9、12、24及48 h的线果芥叶片总RNA。用mRNA差异显示技术筛选差异表达的基因。结果使用80对引物组合共筛选获得差异片段18个,分别命名为DF1-DF18,其中表达上调的有12个,下调的有6个。按照基因的功能可以划分为6大类:基础代谢、转录因子、抗病相关、假想蛋白、未知蛋白和光周期蛋白。其中以基础代谢相关基因最多。对其中的DF-2、DF-6及DF-14进行高盐和干旱胁迫下的表达模式分析,这三个基因均受干旱和盐调控表达。结论从短命植物线果芥中筛选了18个抗旱相关的基因,并对其中的3个基因进行表达模式分析,的确受干旱和盐胁迫的诱导表达。
线果芥;抗旱;mRNA差异显示
0 引 言
【研究意义】 干旱严重影响植物的生长发育及产量,近年来,全球每年因干旱引起的粮食减产越来越频繁。如何让农作物免受或者减轻受灾程度,是人类亟待解决的问题。筛选抗旱关键基因并利用转基因技术,增强作物的抗旱性,是解决此问题的一条有效途径。【前人研究进展】 线果芥属于十字花科线果芥属,是早春短命植物。线果芥属有8种,产中欧,地中海地区,中亚;我国有1种,产新疆、西藏。线果芥(C.planisiliquaFisch.et.Mey.),为十字花科类草本植物。高30~60 cm,下部被单毛,上部无毛。茎直立,不分枝。种子淡黑褐色,短圆形,长约1.5 mm,除种脐端外,有窄边,种脐色重;子叶缘倚胚根。花期5~6月。生长在低山带砾石的山坡及干河床等地方,海拔900~1 000 m。目前对短命植物的研究主要集中在种群分类[1,2],繁殖生态[3,4],光合效率[5],种子生物学[6]等方面。线果芥在Schulz(1936)系统中归属于芸苔族,孙稚颖等[7]发现线果芥的染色体基数为7,形态特征和舟果芥属和菘蓝属相近。赵博[8]利用DNA序列研究结果发现线果芥与厚壁芥,舟果芥和菘蓝的亲缘关系较近,应该归于菘蓝。对于其内在基因资源挖掘方面比较少。近几年才开始对其相关抗逆基因进行克隆。许春华[9]对线果芥等在内的六种短命植物进行PEG6000模拟干旱胁迫发现,线果芥具有较强的抗旱性。陈琴[10,11]利用同源基因克隆技术克隆了线果芥的CpHRD转录因子基因,并转化了烟草。对相关抗旱生理指标的鉴定发现,转CpHRD基因烟草的抗旱性显著提高。自从Liang 等(Liang and Pardee,1992)[12]发明了 DDRT—PCR 技术后,该技术由于具有快速、简单、所需RNA量少,重复性好等优点而被广泛用于分离克隆真核生物差异表达的基因。 该技术目前已广泛应用于生物技术各个领域,如农业、植物[13-14]、动物[15]、医学[16]、菌类等,涉及基因诱导表达、杂种优势机理、植物抗逆性、发育分子机理、基因克隆等方面的研究,已成功分离到数百种基因。【本研究切入点】目前对线果芥抗旱基因的分离和利用方面的报道很少。为充分发掘和利用其抗旱基因资源,需要从分子水平上对其抗旱机理进行研究。研究利用mRNA差异显示技术筛选线果芥抗旱相关基因。【拟解决的关键问题】研究采用mRNA差异显示技术对不同处理条件下的线果芥差异表达基因进行分离,回收,二次PCR后测序,同源性比对分析等,发掘其中的耐旱基因核心片段,为进一步克隆线果芥中全长的抗旱基因和作物抗逆育种提供一定的候选基因。
1 材料与方法
1.1 材 料
线果芥种子来源于新疆农业大学植物教研室,实验室种植收获的种子。
RevertAidTMFirstStrand cDNA SynthesisKit购自Thermo Scientific公司,TRNzol Reagent ,PCR试剂,普通琼脂糖凝胶DNA回收试剂盒,Marker2000都购自天根。引物合成及测序均由北京华大基因完成。
1.2方法
1.2.1处理
将线果芥种子播种于蛭石∶珍珠岩∶土为1∶2∶3的土壤中,在温度为25/23℃,光照为4 000 lx的培养室内培养,待其生长到3~4周时,即有5~8片真叶时,用20%的PEG6000浇灌,进行模拟干旱胁迫处理、NaCl模拟盐胁迫处理,分别采集胁迫0、3、6、9、12和24 h的线果芥幼苗叶片。用液氮速冻后,置于-70℃的冰箱中保存。
1.2.2 总RNA提取与纯化
用天根的Trizol植物提取试剂盒,参照说明书进行。利用DNaseⅠ试剂盒去除RNA中的DNA。然后用1.2%的琼脂糖凝胶电泳检测 RNA 的质量。
1.2.3 RNA反转录及mRNA差异显示
使用反转录试剂盒,参照说明书进行。取2 μg RNA,用四条锚定引物,反转录合成 cDNA 第一链。表1
反转录产物稀释5倍后,取2 μL模板cDNA,80对PCR 扩增引物由 4条锚定引物和20条随机引物组合而成。反应体系20 μL包括:10×ExTaqBuffer ( Mg2+plus ) 2 μL,2.5 mmol/L dNTP 1 μL,10 mmol/L锚定引物1 μL,10 mmol/L随机引物 1 μL,2.5 U/μL ExTaq酶0.25 μL, ddH2O 12.75 μL。扩增程序为: 94℃预变性 5 min; 94℃变性 30 s,56℃退火 45 s,72℃延伸 1.25 min,35个循环; 72℃ 10 min。采用 6%变性聚丙烯酰胺凝胶检测,显色后拍照并记录。表2
1.2.4 差异片段回收纯化、克隆测序
采用煮沸法回收差异片段[17],回收的差异片段用 10 μL 双蒸水溶解,取 4 μL 作为模板以相同的扩增条件和引物进行二次扩增,扩增产物经 1.2% 琼脂糖凝胶电泳分离,采用天根的琼脂糖凝胶试剂盒回收 DNA 条带,与 pMD19-T载体 16℃ 过夜连接,而后转化到大肠杆菌感受态 DH5α中,使用氨苄青霉素对含有重组质粒的菌落进行筛选和摇菌培养,然后使用基因对应的扩增引物或者 M13 + /-引物进行菌液 PCR 检验阳性重组子。对阳性克隆送上海生工测序。
表1 mRNA差异显示锚定引物
Table 1 The anchor primers sequences for mRNA differetial display

引物名称Primername引物序列5’-3’Sequence5’-3’M1ACGACTCACTATAGGGCTTTTTTTTTTTTVAM2ACGACTCACTATAGGGCTTTTTTTTTTTTVCM3ACGACTCACTATAGGGCTTTTTTTTTTTTVGM4ACGACTCACTATAGGGCTTTTTTTTTTTTVT
表2 mRNA 差异显示随机引物
Table 2 The random primers sequences for mRNA differetial display

引物名称Primername引物序列5’-3’Sequence5’-3’R1ACAATTTCACACAGGACGACTCCAAGR2ACAATTTCACACAGGAGCTAGCATGGR3ACAATTTCACACAGGAGCTAGCATGGR4ACAATTTCACACAGGAGCTAGCAGACR5ACAATTTCACACAGGAATGGTAGTCTR6ACAATTTCACACAGGAATGGTAGTCTR7ACAATTTCACACAGGATGGATTGGTCR8ACAATTTCACACAGGATGGTAAAGGGR9ACAATTTCACACAGGATAAGACTAGCR10ACAATTTCACACAGGAGATCTCAGACR11ACAATTTCACACAGGAACGCTAGTGTR12ACAATTTCACACAGGAGGTACTAAGGR13ACAATTTCACACAGGAGTTGCACCATR14ACAATTTCACACAGGATCCATGACTCR15ACAATTTCACACAGGACTTTCTACCCR16ACAATTTCACACAGGATCGGTCATAGR17ACAATTTCACACAGGACTGCTAGGTAR18ACAATTTCACACAGGATGATGCTACCR19ACAATTTCACACAGGATTTTGGCTCCR20ACAATTTCACACAGGATCGATACAGG
1.2.5 差异片段的同源性
利用DNAman软件(version 5.2;Lynnon Biosoft)去除载体序列;然后用 NCBI 网站上 Blast n软件对差异片段进行同源性比对分析。利用最相近的序列进行生物学功能注释。
1.2.6 干旱和盐处理下DF-2、DF-6、DF-14的基因表达
使用7 500 Fast Real-Time PCR System,用SYBR Green Ⅰ荧光染料法检测线果芥幼苗在20% PEG6000和200 Mm NaCl处理下不同时间段的基因转录表达水平。
反应体系参照Fast SYBR Green Master Mix ABI Applied Biosystems试剂盒说明书进行配制,每个反应3次重复。引物如下:DF-2-F:TACATACTTCACCACCACATAATCC,DF-2-R:GGTCAAGAATGGTCAGAAAGG;DF-6-F:GCAATCATCAGGCATCCACG,DF-6-R:TGACATTCCACCCGAAACAA;DF-14-F:TGCTTTCGCTGGTGTTATCT,DF-14-R:GGAAGCTGTGGAGGAAACTAC.Actin-F:TGACGGAGAATTAGGGTTCGA,Actin-R:CCGTGTCAGGATTGGGTAATTT.反应体系中含有10 μL Fast SYBR Green Master Mix(2×),引物各0.4 μL,稀释的cDNA模板2 μL,灭菌水7.2 μL,总体系20 μL。反应程序为95℃酶的激活20 s,95℃变性3 s,60℃退火延伸30 s,40个循环。
1.3 数据处理
反应结束后做溶解曲线以及利用2-ΔΔCt法分析数据。结果绘制成柱状图。
2 结果与分析
2.1 总RNA提取
RNA电泳检测结果,28S和18S两条带的亮度呈现出 2∶1 的比例; 紫外分光光度计检测 OD260/ OD280值在 1.9~2.0,说明 RNA质量较高,适用于后续分析。图1
2.2 差异显示
研究表明,在80个引物组合中,锚定引物 Oligo( dT)M2组成的引物对扩增出的差异条带最多,效果最好。挑选表达量增加或者减少的条带回收,测序,得到18条重复性较好的差异条带。条带大小基本为150~300 bp,其中有两条为414和559 bp的条带。所得条带平均长度为231 bp, 二次扩增特异性较好的片段有18条,其中克隆测序的有18条。图2
2.3 功能分类
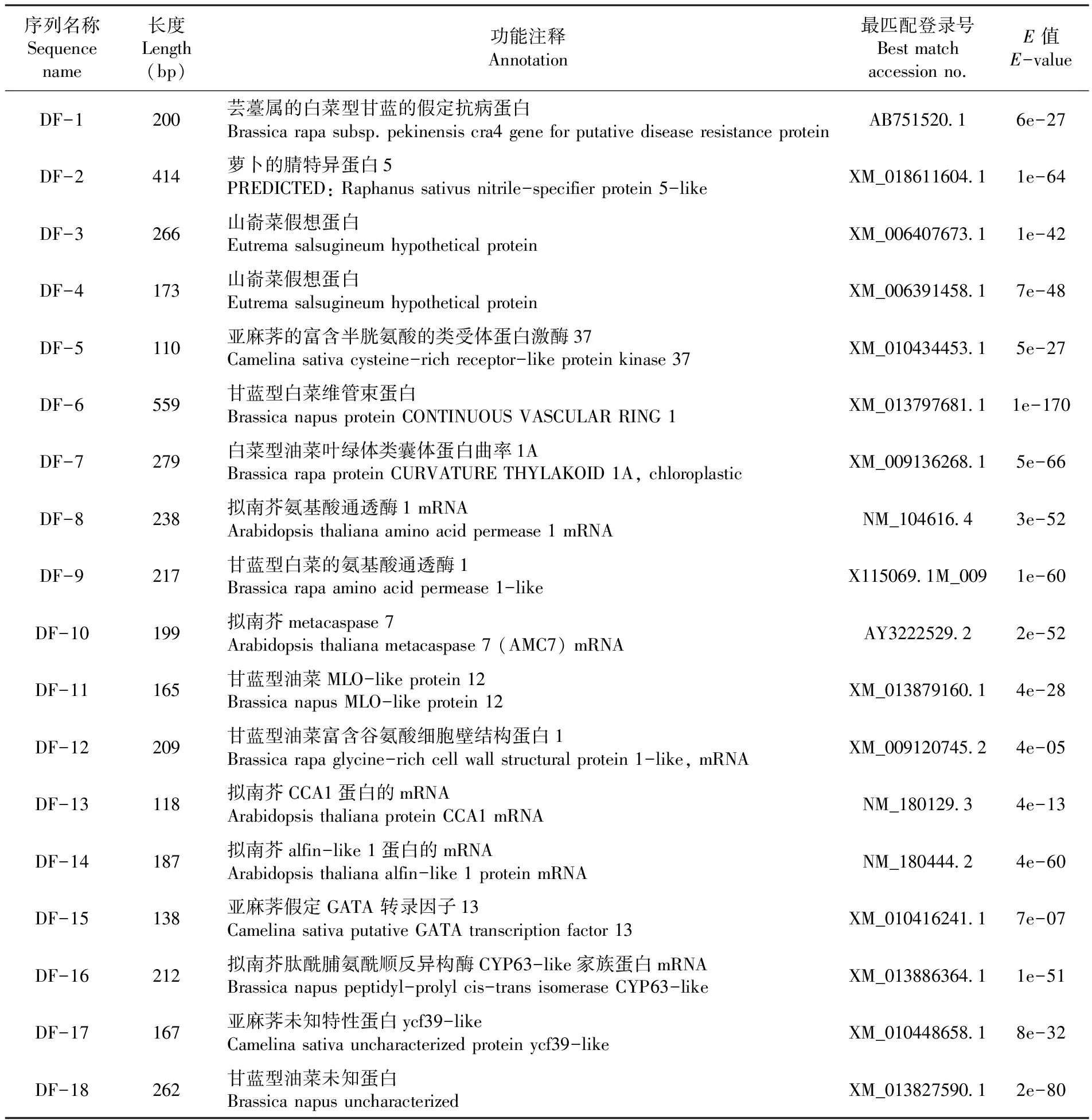
二次回收测序的18个条带经过NCBI序列相似性比对,可以分为以下几类:(1)假想蛋白相关片段3个,芸薹属的白菜型甘蓝的假定抗病蛋白DF-1,山萮菜假想蛋白DF-3、DF-4。(2)基础代谢相关片段7个,亚麻荠的富含半胱氨酸的类受体蛋白激酶37 ,DF-5,白菜型甘蓝维管束蛋白DF-6,白菜型油菜叶绿体类囊体蛋白曲率1A ,DF-7。拟南芥氨基酸通透酶1 mRNA, DF-8,甘蓝型白菜的氨基酸通透酶1 ,DF-9。拟南芥肽酰脯氨酰顺反异构酶CYP63-like家族蛋白mRNA, DF-16,甘蓝型油菜富含谷氨酸细胞壁结构蛋白1,DF-12。(3)抗病相关蛋白3个,萝卜的腈特异蛋白5,DF-2,拟南芥AMC7,DF-10和甘蓝型油菜MLO-like protein 12,DF-11。(4)未知蛋白2个,DF-17和DF-18。(5)光周期相关2个,拟南芥光周期相关的蛋白CCA1,DF-13。亚麻荠假定GATA转录因子13,DF-15,在拟南芥中假定的GATA转录因子13有可能对光响应基因具有调控作用。(6)转录因子1个,拟南芥alfin-like 1蛋白相似的片段DF-14。表3,图3

图1 线果芥总RNA 电泳图
Fig.1 Total RNA electrophoresis of C.planisiliqua
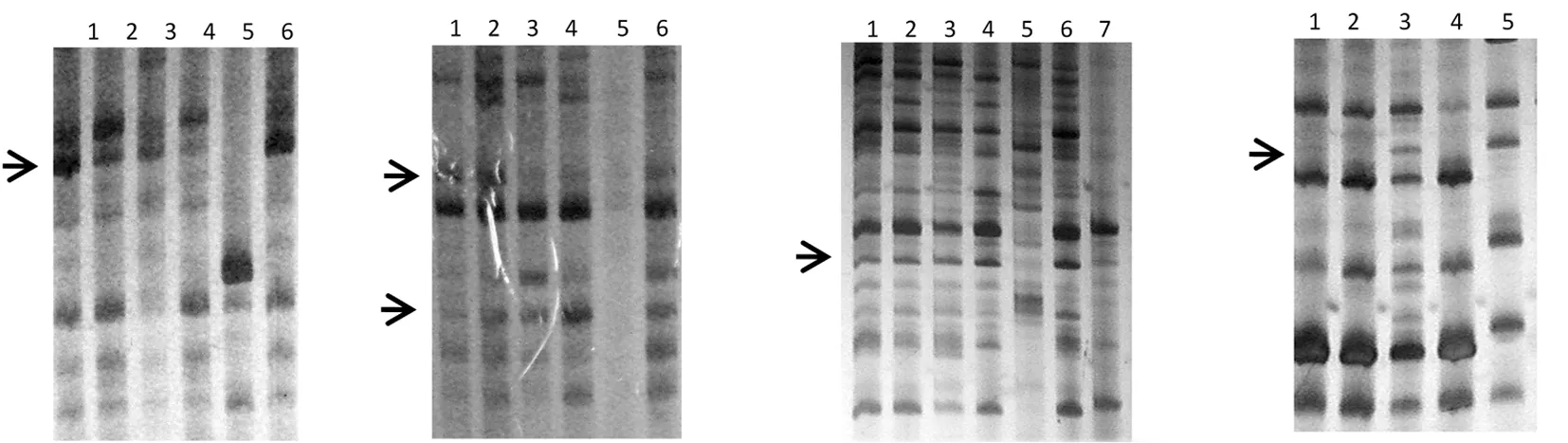
Note: 1:ck 2:3 h 3:6 h 4:9 h 5:12h 6:24 h 7:48 h
图2 部分cDNA 差异条带的6%PAGE电泳检测结果
Fig.2 Partical cDNA differential bands dected on 6% denaturing polyacrylamide-urea gel
表3 DFs 序列与 NCBI 核酸序列数据库的 BLAST 序列比对
Table 3 Similarity of DFs to known genes by BLAST search against NCBI nucleotide database
序列名称Sequencename长度Length(bp)功能注释Annotation最匹配登录号Bestmatchaccessionno.E值E-valueDF-1200芸薹属的白菜型甘蓝的假定抗病蛋白Brassicarapasubsp.pekinensiscra4geneforputativediseaseresistanceproteinAB75152016e-27DF-2414萝卜的腈特异蛋白5PREDICTED:Raphanussativusnitrile-specifierprotein5-likeXM_01861160411e-64DF-3266山嵛菜假想蛋白EutremasalsugineumhypotheticalproteinXM_00640767311e-42DF-4173山嵛菜假想蛋白EutremasalsugineumhypotheticalproteinXM_00639145817e-48DF-5110亚麻荠的富含半胱氨酸的类受体蛋白激酶37Camelinasativacysteine-richreceptor-likeproteinkinase37XM_01043445315e-27DF-6559甘蓝型白菜维管束蛋白BrassicanapusproteinCONTINUOUSVASCULARRING1XM_01379768111e-170DF-7279白菜型油菜叶绿体类囊体蛋白曲率1ABrassicarapaproteinCURVATURETHYLAKOID1A,chloroplasticXM_00913626815e-66DF-8238拟南芥氨基酸通透酶1mRNAArabidopsisthalianaaminoacidpermease1mRNANM_10461643e-52DF-9217甘蓝型白菜的氨基酸通透酶1Brassicarapaaminoacidpermease1-likeX1150691M_0091e-60DF-10199拟南芥metacaspase7Arabidopsisthalianametacaspase7(AMC7)mRNAAY322252922e-52DF-11165甘蓝型油菜MLO-likeprotein12BrassicanapusMLO-likeprotein12XM_01387916014e-28DF-12209甘蓝型油菜富含谷氨酸细胞壁结构蛋白1Brassicarapaglycine-richcellwallstructuralprotein1-like,mRNAXM_00912074524e-05DF-13118拟南芥CCA1蛋白的mRNAArabidopsisthalianaproteinCCA1mRNANM_18012934e-13DF-14187拟南芥alfin-like1蛋白的mRNAArabidopsisthalianaalfin-like1proteinmRNANM_18044424e-60DF-15138亚麻荠假定GATA转录因子13CamelinasativaputativeGATAtranscriptionfactor13XM_01041624117e-07DF-16212拟南芥肽酰脯氨酰顺反异构酶CYP63-like家族蛋白mRNABrassicanapuspeptidyl-prolylcis-transisomeraseCYP63-likeXM_01388636411e-51DF-17167亚麻荠未知特性蛋白ycf39-likeCamelinasativauncharacterizedproteinycf39-likeXM_01044865818e-32DF-18262甘蓝型油菜未知蛋白BrassicanapusuncharacterizedXM_01382759012e-80
图3 功能分类及所占比例
Fig.3 Functional classification and proportion
2.4 部分基因在干旱和盐胁迫下的表达
研究表明,在PEG6000胁迫处理下,DF-2、DF-14随着时间,动态上调表达,DF-2在9 h表达量达到相对最高值,DF-14在6 h表达量相对最高。DF-6表达受PEG6000下调。
在盐胁迫下,DF-2和DF-14随着时间都是动态上调表达,都在24 h表达量相对最高,DF-6在3 h表达量最高,随后就低于对照。说明DF-2、DF-14对盐的胁迫响应速度要比DF-6的速度慢。说明DF-2、DF-6、DF-14的表达的确是受干旱和盐诱导表达的。图4

图4 DF-2、DF-6、DF-14的荧光定量表达
Fig.4 The expression of DF-2、DF-6、DF-14 under different treatments dected by qRT-PCR
3 讨 论
线果芥为新疆特有的短命植物,长期生活在干旱的沙漠,砾石边缘。长期进化过程中,适应了干旱的生活环境。对其自身的抗逆机理尚缺乏认识。利用mRNA差异显示技术对其抗旱基因的筛选。
从所筛的基因可以看出,基因的片段普遍偏小,对于基因的下一步研究,有一定的困难,要挑选功能未知,长一点的片段进行下一步研究。锚定引物 Oligo(dT)M2的随机组合所得到的差异条带最多。从所筛选的30个条带中二次回收,克隆测序的为18条,阳性率为60%。
从发现的基因分类来说,基础代谢所占的比例最高,有38.89%,其次是假想蛋白和抗病蛋白所占比例都为16.67%, 未知蛋白与光周期蛋白所占比例相同,都为11.11%,转录因子所占比例最小,为5.56%。从这一结果也说明植物在响应干旱胁迫时,有相关蛋白激酶,维管束蛋白,光合作用,氨基酸通透酶,顺反异构酶,细胞壁结构蛋白,转录因子的参与。但是光周期和抗病相关蛋白也有响应,这个较少发现。植物的抗逆性机理是交叉胁迫的,有些基因可以参与植物的生物胁迫及非生物胁迫。其中基础代谢相关的基因研究的比较多,因此抗病蛋白,假想蛋白,未知蛋白及转录因子具有进一步的研究意义。
富含半胱氨酸的类受体激酶(cysteine-rich receptor-like kinase,CRK) 又被称为 DUF26(domain of unknown function 26) 类受体激酶, 是类受体激酶(receptor-like kinase,RLK) 中的一大类。RLK是植物体中许多信号识别传递途径中的关键质膜受体。通过磷酸化作用参与胞内信号传递。近几年研究发现 CRK 参与了植物的抗病及抗逆反应。张秀娟[18]发现拟南芥的CRK45 通过调节 ABA 的生物合成而调控着拟南芥对非生物胁迫如干旱、高盐以及 ABA 的响应;同时,CRK45 也参与了拟南芥对生物胁迫的应答,在依赖水杨酸的抗病信号途径中,CRK45 位于 NPR1 的下游,在转录水平上受到转录因子 NPR1 和 WRKY70 的调控。拟南芥的AtCRK36 受非生物胁迫的诱导[19],在细胞内AtCRK36 与AtCRK45 在质膜结合,体外实验中,AtCRK36 可 使AtCRK45磷酸化,进而引发下游逆境胁迫相关基因的表达。因此,AtCRK45 与AtCRK36 在植物细胞内共同作用,并参与应答 ABA 和渗透胁迫信号的负调控反应[20-21]。实验筛选得到的DF-5片段在植物响应干旱胁迫中表达,说明在线果芥响应干旱胁迫中起作用。
Alfin-like 转录因子属于植物同源结构域(PHD结构域)转录因子家族。拟南芥Alfin-like 家族共有7个Alfin-like 基因。
对于Alfinlike转录因子的功能研究比较少,最早发现其在抗逆方面的功能是从苜蓿的差显中发现Alfin转录因子能够提高转基因苜蓿的耐盐能力[22-23]。其次在拟南芥中研究发现,AL6在植物响应低磷胁迫时有助于植物根毛的生长[24]。AL6和AL7共同作用,也会影响拟南芥种子在渗透胁迫和盐胁迫下种子的发芽率[25]。AL7在植物耐盐胁迫中起负调控作用,在盐胁迫下,过表达转基因株系的根变短,al7突变体的根反而伸长[26]。AL5过表达株系显著提高了植物的抗旱,耐盐和耐冷胁迫能力。而al5突变体的耐逆能力都低于野生型[27]。
从其它物种中的研究发现,从白菜中通过同源克隆得到的15条BrAL TFs研究发现,这些转录因子中有10条对生物胁迫的病菌产生抗病性,同时全部的ALs 转录因子对植物的非生物逆境产生抗逆性,说明ALs在大白菜响应生物和非生物胁迫中增强植物的抗逆性[28]。从水稻中克隆的植物同源结构域 (PHD)-finger 家族转录因子 OsPHD1 的过量表达可提高水稻的耐逆性能。过表达 Os PHD1 基因使转基因株系对低温、高盐和干旱胁迫的耐受性分别提高 43.3%、60%和 25%,且在后代中获得稳定遗传[29]。在萝卜中的研究发现,萝卜的ALs也对干旱、低温和高盐有所响应[30]。
因此,线果芥中的DF-14片段在线果芥抗旱途径中发挥作用,上调表达,但具体调控机理尚不清楚,需要对转录因子DF-14做进一步的抗逆功能研究。
对其中的DF-2(PREDICTED: Raphanus sativus nitrile-specifier protein 5-like,萝卜的腈特异蛋白5),DF-6(Brassica napus protein CONTINUOUS VASCULAR RING 1,甘蓝型白菜维管束蛋白)DF-14( Arabidopsis thaliana alfin-like 1 protein mRNA,拟南芥alfin-like 1蛋白的mRNA)荧光定量研究发现都是受干旱和盐的胁迫诱导表达,其中在干旱和盐的胁迫下,转录因子和抗病蛋白的表达量都响应胁迫,表达上调,但是基础代谢受到影响,在干旱胁迫下,维管束蛋白下调表达,而在盐胁迫下,短暂的上调表达后也是下调表达的。说明在逆境胁迫下,植物会启动一些转录因子及抗病蛋白来应对逆境,同时植物的自身代谢速度降低,生长发育受到影响(抑制)。
4 结 论
4.1 对十字花科短命植物线果芥属线果芥干旱胁迫下的mRNA差异显示分析,共筛选获得18条受干旱诱导或抑制表达的基因片段。其中基础代谢、假想蛋白、抗病蛋白、未知蛋白、光周期蛋白及转录因子所占比例分别为38.89%、16.67%、16.67%、11.11%、11.11%和5.56%。
4.2 DF-2、DF-4及DF-16的确受干旱和盐胁迫的诱导表达。为线果芥中的转录因子,基础代谢及抗病蛋白的基因克隆及功能验证打下前期基础,也为新疆特有的野生抗逆植物资源的发掘提供理论依据。
References)
[1] 李岩, 冯缨, 刘斌,等. 新疆十字花科短命植物系统发育关系及分化时间[J]. 干旱区研究, 2014, 31(6):1 100-1 108.
LI Yan, FENG Ying, LIU Bin, et al. (2014). Phylogenetic Relationships and Divergence Time of Brassicaceae Ephemeral Plants in Xinjiang [J].AridZoneResearch, 31(6):1,100-1,108. (in Chinese)
[2] 罗宁, 刘尊驰, 于航,等. 古尔班通古特沙漠南部植物多样性的区域差异[J]. 生态学报, 2016, 36(12):3 572-3 581.
LUO Ning, LIU Zun-chi, YU Hang, et al. (2016). Regional differences in plant diversity in the southern Gurbantonggut desert [J].ActaEcologicaSinica, 36(12): 3,572-3,581.(in Chinese)
[3] 刘晓风. 十字花科短命植物生殖生态学研究[D]. 乌鲁木齐:新疆农业大学硕士毕业论文, 2007.
LIU Xiao-feng. (2007).TheReproductiveEcologyonSomeEphemeralSpeciesofBrassicaceae[D]. Master Thesis. Xinjiang Agricultural University, Urumqi.(in Chinese)
[4] 陶冶, 张元明, 周晓兵,等. 类短命植物粗柄独尾草器官生物量分配与估测[J]. 干旱区研究, 2012, 29(1):93-100.
TAO Ye, ZHANG Yuan-ming, ZHOU Xiao-bing, et al. (2012). Allocation and Estimation of Organ Biomass of Eremurus inderiensis [J] .AridZoneResearch, 29(1): 93-100.(in Chinese)
[5] 郝秀英, 王卉, 张萍,等. 温度对托里阿魏(Ferulakrylovii)和骆驼蓬(Peganumharmala)的呼吸及光合作用的影响[J]. 中国沙漠, 2015, 35(4):912-916.
HAO Xiu-ying, WANG Hui, ZHANG Ping, et al. (2015). Effect of temperature on respiration and phoosynthesis inFerulakrylovii andPeganumharmala[J].JournalofDesearch, 35(4):912-916. (in Chinese)
[6] 邹杰, 吕光辉, 王曼,等. 古尔班通古特沙漠短命植物种子萌发生态分析[J]. 新疆农业科学, 2013, 50(5):917-923.
ZOU Jie, LÜ Guang-hui, WANG Man, et al. (2013). Analysis on Germination Characteristics of Ephemeral Plant in Gurbantunggut Desert in Xinjiang [J].XinjiangAgriculturalSciences, 50(5):917-923. (in Chinese)
[7] 孙稚颖.中国十字花科植物部分属种的系统学研究 [D].济南:山东师范大学博士学位论文,2006.
SUN Zhi-ying. (2006).SystematicStudiesonPartialGeneraandSpeciesofBrassicaceaefromChina[D]. PhD Thesis. Shandong Normal University, Jinan.(in Chinese)
[8] 赵博. 十字花科植物分子系统发育研究[D]. 武汉:武汉大学博士学位论文, 2010.
ZHAO Bo. (2010).AnalysisofphylogeneticrelationshipsofBrassicaceaespeciesbasedonChs,AdcandrbcLSequences[D]. PhD Thesis. Wuhan University, Wuhan.(in Chinese)
[9] 许春华. 两种短命植物抗旱性评价及其机理研究[D]. 乌鲁木齐:新疆农业大学硕士学位论文, 2012.
XU Chun-hua. (2012).TheEvaluationofDroughtResistanceandtheStudyonDroughtResistantMechanismofTwoEphemeralPlants[D]. Master Thesis. Xinjiang Agricultural University, Urumqi. (in Chinese)
[10] 陈琴, 曲延英, 刘静静,等. 两种短命植物HRD转录因子基因的克隆及序列分析[J]. 植物研究, 2015, 35(2):250-258.
CHEN Qin, QU Yan-ying, LIU Jing-jing, et al. (2015). Cloning and Sequence Analysis of HRD Transcription Factors Gene from Two Kinds of Ephemeral Plants [J].BulletinofBotanicalResearch, 35(2):250-258. (in Chinese)
[11] 陈琴, 李星星, 童婷,等. 干旱胁迫对转CpHRD基因烟草的影响[J]. 植物生理学报, 2015,(5):715-720.
CHEN Qin, LI Xing-xing, TONG Ting, et al. (2015). Influence of Drought Stress on Transgenic CpHRD Gene in Tobacco [J].PlantPhysiologyJournal, 51(5):715-720. (in Chinese)
[12] Liang, P., & Pardee, A. B. (1992). Differential display of eukaryotic messenger rna by means of the polymerase chain reaction.Science,257,(5072):967-971.
[13] 斯钦巴特尔,李 强,张 辉,等.显性核不育亚麻可育,不育花蕾 mRNA 差异表达研究及差异片段分析[J].生物技术通报,2009,(7):67-70.
Siqinbateer, LI Qiang, ZHANG Hui, et al. (2009). Study on mRNA Differential Expression in Male Sterile and Fertile Flower Buds of Dominant Genomic Male Sterile Flaxand Sequence Analysis of Differential Fragments [J].BiotechnologyBulletin, (7): 67-70.(in Chinese)
[14] 孙晓红,冯爱萍,陈明杰,等.草菇冷诱导相关基因的克隆及序列分析[J].菌物学报,2006,25(1):88-93.
SUN Xiao-hong, FENG Ai-ping, CHEN Ming-jie, et al. (2006). Cloning and sequence analysis of cold induced genes in Chinese straw mushroom, Volvariella volvacea [J].Mycosystema, 25(1):88-93. (in Chinese)
[15] 覃立立, 童雄, 徐建,等. mRNA差异显示技术研究中外猪种肉质性状差异表达基因[J].华南农业大学学报, 2011, 32(4):82-85.
QIN Li-li,TONG Xiong,XU Jian, et al, (2011). Study on the Different Expression of Meat Quality Candidate Genes between the Local and Exotic Pig Breeds Using mRNA Differential Display Technology [J].JournalofSouthChinaAgriculturalUniversity, 32(4):82-85. (in Chinese)
[16] Nagai, M. A., Fregnani, J. H., Netto, M. M., Brentani, M. M., & Soares, F. A. (2007). Down-regulation of phlda1 gene expression is associated with breast cancer progression.BreastCancerResearch&Treatment,106(1):49-56.
[17] 李拥军, 敖红, 孙桂金.mRNA差异显示技术中特异条带回收方法的比较[J].生物技术,2005, 15(3):43-44.
LI Yong-jun, AO Hong, SUN Gui-jin. (2005). Comparison of Different Methods in Recovering Special Bands in mRNA Differential Display [J].Biotechnology, 15(3):43-44. (in Chinese)
[18]张秀娟. 拟南芥类受体蛋白激酶CRK45对生物和非生物胁迫的响应[D]. 呼和浩特:内蒙古农业大学博士学位论文, 2013.
ZHANG Xiu-juan. (2013).Arabidopsisreceptor-likeproteinkinaseCRK45respondstoabioticandbioticstresses[D]. PhD Thesis. Inner Mongolia Agricultural University, Hohhot. (in Chinese)
[19] Tanaka, H., Osakabe, Y., Katsura, S., Mizuno, S., Maruyama, K., & Kusakabe, K., et al. (2012). Abiotic stress-inducible receptor-like kinases negatively control aba signaling in Arabidopsis.PlantJournalforCell&MolecularBiology, 70(4):599-613.
[20] Zhang, X., Han, X., Shi, R., Yang, G., Qi, L., & Wang, R., et al. (2013). Arabidopsis cysteine-rich receptor-like kinase 45 positively regulates disease resistance to pseudomonas syringae.PlantPhysiology&BiochemistryPpb, 73(73C): 383-391.
[21] Lange, J., Xie, Z. P., Broughton, W. J., Vögelilange, R., & Boller, T. (1999). A gene encoding a receptor-like protein kinase in the roots of common bean is differentially regulated in response to pathogens, symbionts and nodulation factors.PlantScience, 142(2):133-145.
[22] Winicov, I. (1999). Transgenic overexpression of the transcription factor alfin1 enhances expression of the endogenous msprp2 gene in alfalfa and improves salinity tolerance of the plants.PlantPhysiology, 120(2): 473-480.
[23] Winicov, I., Valliyodan, B., Xue, L., & Hoober, J. K. (2004). The msprp2 promoter enables strong heterologous gene expression in a root-specific manner and is enhanced by overexpression of alfin 1.Planta, 219(6):925-935.
[24] Chandrika, N. N., Sundaravelpandian, K., Yu, S. M., & Schmidt, W. (2013). Alfin-like 6 is involved in root hair elongation during phosphate deficiency in Arabidopsis.NewPhytologist, 198(3):709-720.
[25] Anne Marie Molitor, Zhongyuan Bu, Yu Yu, Wen-Hui Shen. (2014). Arabidopsis al phd-prc1 complexes promote seed germination through h3k4me3-to-h3k27me3 chromatin state switch in repression of seed developmental genes.PLoSGenetics, 10,1(2014-1-23):10(1), e1004091.
[26] Song, Y., Gao, J., Yang, F., Kua, C. S., Liu, J., & Cannon, C. H. (2013). Molecular evolutionary analysis of the alfin-like protein family in arabidopsis lyrata, arabidopsis thaliana, and Thellungiella halophila.PlosOne, 8(7):e66838.
[27] Wei, W., Zhang, Y. Q., Tao, J. J., Chen, H. W., Li, Q. T., & Zhang, W. K., et al. (2015). The alfin-like homeodomain finger protein al5 suppresses multiple negative factors to confer abiotic stress tolerance in Arabidopsis.PlantJournalforCell&MolecularBiology, 81(6): 871-883.
[28] Kayum, M. A., Park, J. I., Ahmed, N. U., Jung, H. J., Saha, G., & Kang, J. G., et al. (2015). Characterization and stress-induced expression analysis of alfin-like transcription factors in Brassica rapa.MolecularGenetics&GenomicsMgg, 290(4):1-13.
[29] 刘雨, 刘春霞, 李早霞,等. 植物同源结构域(PHD)-finger家族转录因子OsPHD1的过量表达可提高水稻的耐逆性能[J]. 农业生物技术学报, 2011, 19(3):462-469.
LIU Yu, LIU Chun-xia, LI Zao-xia, et al, (2011). Overexpression of a Plant Homedomain (PHD)-finger Transcription Factor,Os PHD1, Can Enhance Stress Tolerance in Rice [J].JournalofAgriculturalBiotechnology, 19(3):462-469. (in Chinese)
[30] Wu, X. J., Li, M. Y., Que, F., Wang, F., Xu, Z. S., & Xiong, A. S. (2016). Genome-wide analysis of phd family transcription factors in carrot ( daucus carota, l.) reveals evolution and response to abiotic stress.ActaPhysiologiaePlantarum, 38(3): 67.
ApplicationofmRNADifferentialDisplayTechniqueinScreeningDroughtResistanceRelatedGenesinC.planisiliqua
ZHU Yan-fei, CHEN Quan-jia, QU Yan-ying
(KeyLaboratoryofAgriculturalBiotechnology,CollegeofLifeScienceandTechnology,XinjiangAgriculturalUniversity,Urumqi830052,China)
ObjectiveThe ephemeral speciesConringiaplanisiliquabelongs to Brassicaceae which grows in Xinjiang arid environment, which has strong drought resistance, but its drought resistance mechanism is not clear. In order to understand the mechanism of drought resistance and discover some excellent resistance genes from wild plant resources, it has laid an important foundation for further understanding the mechanism of drought resistance inconringiaplanisiliqua.MethodUsing the plant that has grown for three to four weeks treated by 20% PEG6000, total RNA of the leaves at 0 h, 3 h, 6 h, 9 h, 12 h, 24 h and 48 h was extracted. Then the differentially expressed genes were screened by mRNA differential display techniques.ResultEighty primer combinations were used to screen the differentially expressed cDNAs, and a total of 18 differentially expressed cDNAs were found. They were named of DF1-DF18, 12 of the cDNAs were the up-regulated and 6 of them were down-regulated gene fragments. According to the gene function they were divided into 6 categories: basal metabolism, transcription factor, disease resistance protein, hypothetical protein, unknown protein and photoperiod protein. Most of them were the basal metabolism related genes. We analyzed the expression pattern of the DF-2,DF-6 and DF-14 under drought and salt stress, and the finding showed that the three genes were regulated by drought and salt.ConclusionEighteen of the drought-resistant genes were screened from ephemeral plantConringiaplanisiliqua. Three of the genes expression patterns were detected, they were induced by drought and salt stress.
Conringiaplanisiliqua; drought stress; mRNA different display
QU Yan-ying(1962-),Female,Native place: Shandong,professor, (E-mail)383006047@qq.com
S188
A
1001-4330(2017)10-1775-10
10.6048/j.issn.1001-4330.2017.10.002
2017-07-25
国家转基因生物新品种重大专项“ 转基因耐旱、 耐盐新品种培育” (2013ZX08005-004)
朱燕飞(1988-),女,江苏南通人,博士研究生,研究方向为植物抗逆基因工程,(E-mail)1456359625@qq.com
曲延英(1962-),女,山东人,教授,博士生导师,研究方向为棉花分子育种,(E-mail)383006047@qq.com
Supported by: National special program for new varieties of genetically modified organisms "Transgenic drought tolerance and salt tolerant new variety breeding" (2013ZX08005-004)

