固定化α-淀粉酶在邻氨基对甲苯酚合成中的应用
吴效楠,郑哲奎,潘滋涵
(承德石油高等专科学校 化学工程系,河北 承德 067000)
固定化α-淀粉酶在邻氨基对甲苯酚合成中的应用
吴效楠,郑哲奎,潘滋涵
(承德石油高等专科学校 化学工程系,河北 承德 067000)
以自制的固定化α-淀粉酶为催化剂,邻硝基对甲苯酚为原料合成了邻氨基对甲苯酚。确定了α-淀粉酶的固定化率和重复使用次数,并利用正交试验考察了反应温度、溶剂组成和反应时间对产率的影响,得出了最佳合成条件,其产率达到了93.73%(HPLC)。
邻氨基对甲苯酚;邻硝基对甲苯酚;固定化α-淀粉酶;正交试验
邻氨基对甲苯酚在工业上是重要的染料及聚酯纤维荧光增白剂DT中间体[1]。该产品传统的合成方法如硫化钠、铁粉还原法对环境污染严重,而水合肼还原法报道较多,但因水合肼价格较高且采用了贵金属作为催化剂,从而阻碍了该法的发展。酶法催化是近些年新兴的技术,和传统的制备工艺相比,高效、经济、环保是该法最大的优点[2],尤其酶在固定化后不仅稳定性得到了提高,而且活性和催化底物均产生了变化。本文以尼龙为载体,自制了固定化α-淀粉酶催化剂,以邻硝基对甲苯酚为原料还原合成了邻氨基对甲苯酚,并在实验室条件下进行了反应条件的探索,该法目前在国内还未见报道。
1 实验部分
1.1主要试剂和仪器
邻硝基对甲苯酚(工业品);尼龙网(工业品);去离子水(自制);甲醇、可溶性淀粉、麦芽糖、α-淀粉酶、柠檬酸(钠)、50%戊二醛、磷酸氢二钠、碳酸氢钠、碘化钾、盐酸、硼氢化钠、土温80、酒石酸钾钠、硫酸铜,分析纯,均购自天津市化学试剂供销公司。
XT4A显微熔点仪,河南巩义市英峪予华仪器厂;pHS-25型pH计,上海精科雷磁;UV-1600型紫外分光光度计,北京普析通用仪器有限公司;AX200型电子分析天平,上海精科天平;L-7000型液相色谱仪,北京莱伯泰科仪器有限公司;IR Prestige-21红外光谱仪,长春市辉浩科技有限公司。
1.2实验原理
采用戊二醛为交联剂将游离α-淀粉酶固定在尼龙上[3],并在最佳条件下与淀粉溶液进行水解生成还原糖。水解后的产物配以适量的甲醇作为溶剂,在一定条件下和邻硝基对甲苯酚反应生成邻氨基对甲苯酚。
1.3实验步骤
1.3.1 α-淀粉酶的固定化
尼龙固定化α-淀粉酶的制备参照文献[4]进行。
1.3.2 固定化α-淀粉酶最佳水解条件的确定[4]
经斐林试剂法检测固定化α-淀粉酶水解淀粉的最佳条件是:水解时间=4 h、pH值=7、温度=70 ℃。
1.3.3 固定化α-淀粉酶还原邻硝基对甲苯酚
取500 mL的三口烧瓶由左至右依次安装温度计、回流冷凝管、滴液漏斗。在右侧滴液漏斗中加入0.2 g邻硝基对甲基苯酚,并用适量甲醇溶解(甲醇用量参照正交试验表)。在烧瓶中放入用尼龙固定化好的α-淀粉酶,加入150 mL温度为70 ℃的1%淀粉溶液,维持温度不变水解4 h左右,然后将滴液漏斗中的原料溶液逐滴加入到三口烧瓶中,升高温度并保持恒温反应一定时间。
2 产品分析与表征
2.1熔点测定仪分析
用显微熔点仪测定产品邻氨基对甲苯酚的熔点为136.5 ℃,与文献数据135~137 ℃基本一致[5]。
2.2产品邻氨基对甲苯酚的IR表征
邻氨基对甲苯酚的红外图谱见图1。
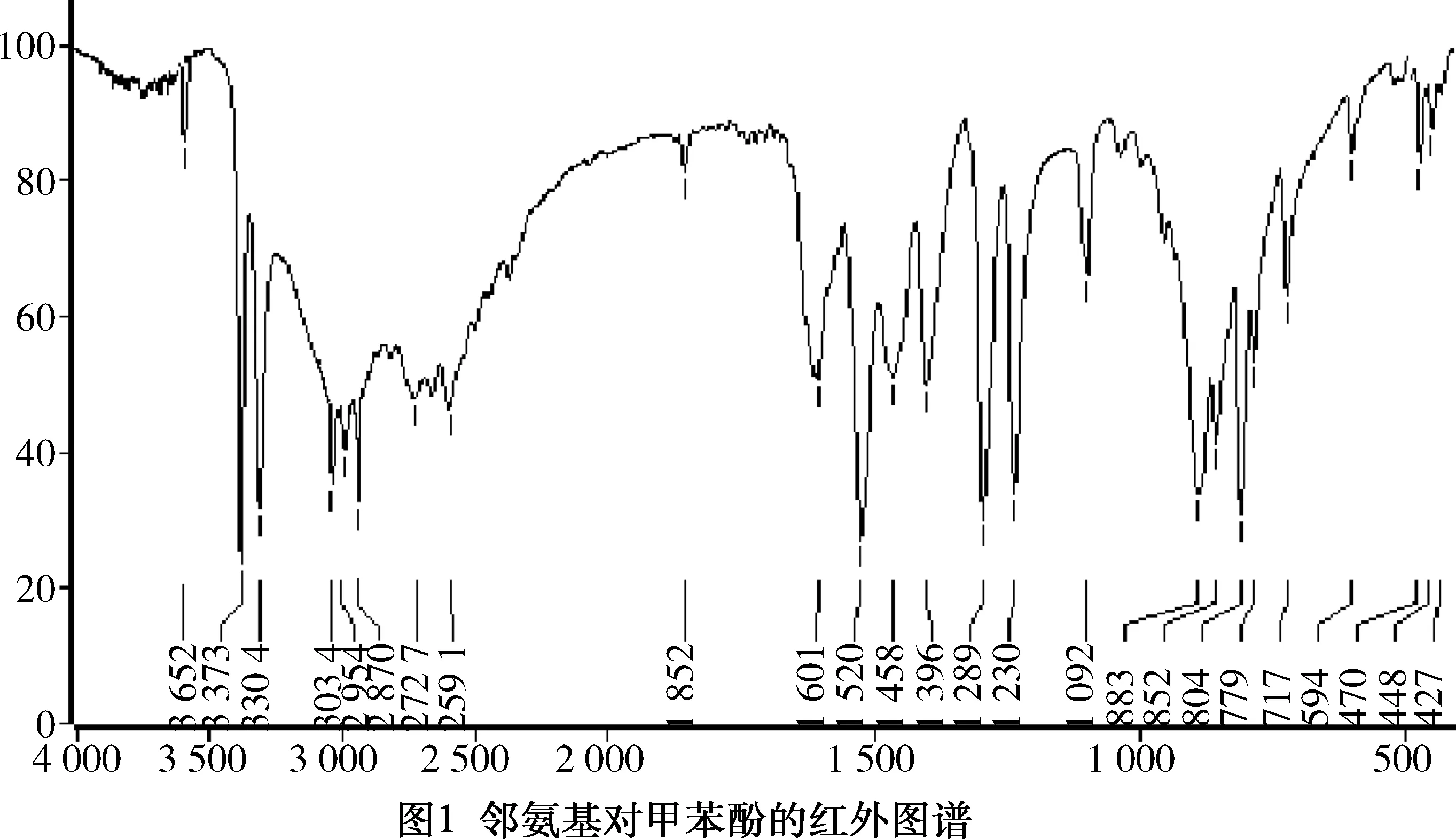
由图1可知,3 034 cm-1为苯环上(=C-H)碳氢伸缩振动峰,且1 520 cm-1与1 601 cm-1处也有吸收,证明了该化合物中苯环的存在;2 954 cm-1与2 870 cm-1分别为甲基(CH3-)的碳氢不对称和对称伸缩振动峰;3 652 cm-1为苯酚羟基(-OH)的伸缩振动吸收峰;1 396 cm-1为苯酚羟基(-OH)的弯曲吸收振动峰;1 289 cm-1与1 230 cm-1为苯环与羟基的(C-O)伸缩振动吸收峰;804 cm-1处的吸收峰说明了该芳香化合物是1,2,4-取代,由此可推断出产物为邻氨基对甲苯酚。
2.3HPLC检测(峰面积法)
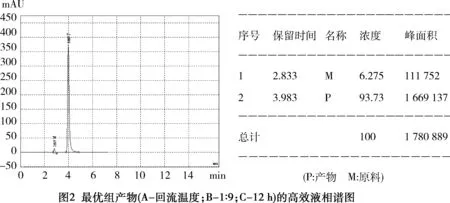
检测条件如下:反向C18色谱柱;流动相中v(CH3OH) ∶v(H2O)=70 ∶30;流量0.5 mL/min;L-7420型UV-Vis检测器;紫外检测波长:254 nm。此条件下产物出峰位置的保留时间在4 min附近(见图2),因此可确定为产物。
3 结果与讨论
3.1α-淀粉酶的固定化率测定
根据下面的公式进行α-淀粉酶固定化率的计算:
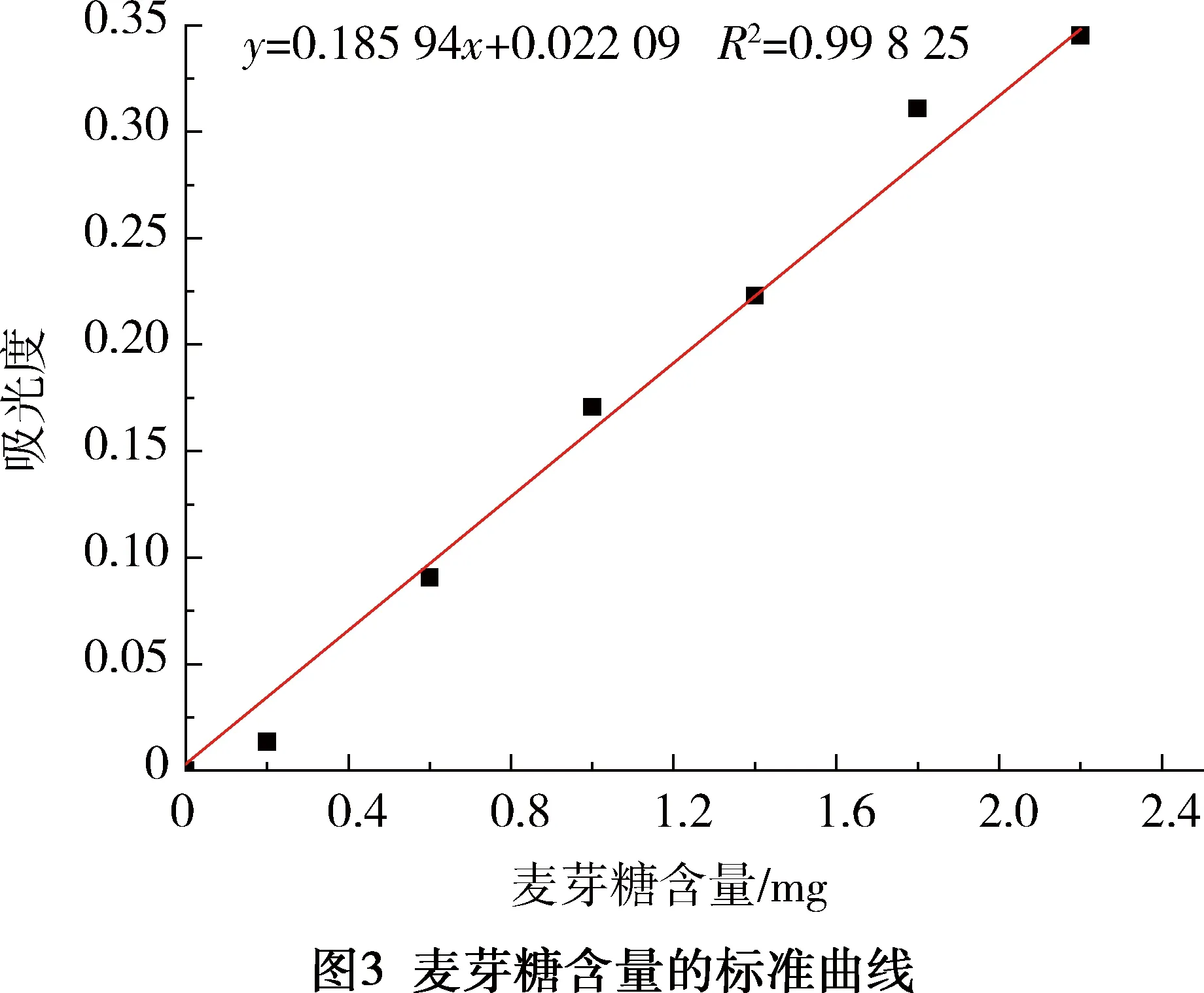

其中游离酶的活性通过3,5-二硝基水杨酸对还原糖进行显色反应来测定[6]。取7支干净的具塞刻度试管并编号,将各试管摇匀,置沸水浴中煮沸5 min 后取出冷却,加蒸馏水定容至25 mL。以1号管作为空白样,在540 nm波长下通过比色法测定吸光度,并以麦芽糖含量为横坐标,吸光度为纵坐标绘制标准曲线(见图3)。
从标准曲线图3可以看出,在540 nm下,麦芽糖含量与吸光度成正线性关系,符合线性方程:y=0.185 94x+0.022 09(R2=0.998 25)。即通过测定的吸光度,可以求得麦芽糖的量,再根据下面公式可得到α-淀粉酶的活性。

取四份0.2 g α-淀粉酶分别溶于100 mL浓度为1%的淀粉溶液中,在60 ℃的条件下水解4 h后测得的吸光度见表1。
将四块大小均一的尼龙放入0.2 g α-淀粉酶的水溶液中按照步骤1.3.1进行固定化,随后取出固定化后的尼龙,将剩余的淀粉酶溶液和淀粉配成100 mL浓度为1%的淀粉溶液水解4 h,同时测量剩余游离α-淀粉酶的活性,见表2。
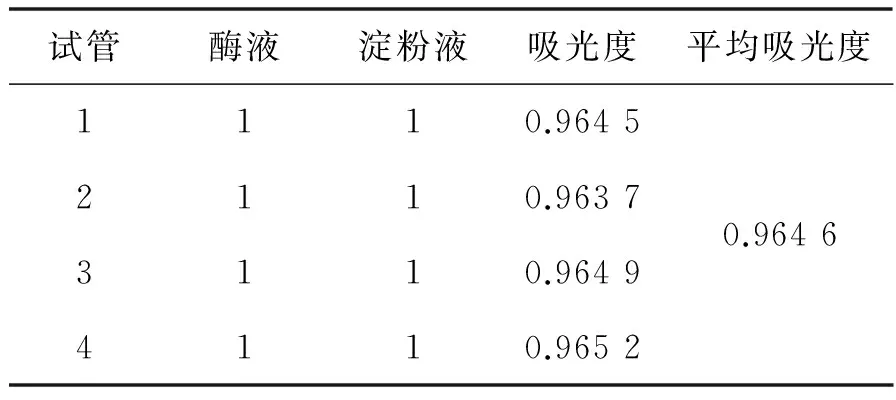
表1 游离α-淀粉酶的活性测定

表2 剩余游离α-淀粉酶的活性测定
根据以上数据可以得到α-淀粉酶的固定化率为39.26%。
3.2固定化α-淀粉酶还原邻硝基对甲苯酚
在合成邻氨基对甲苯酚的实验中,为了考察反应温度、溶剂组成(甲醇与水的比例)和反应时间对产率的影响,按照步骤1.3.3及设计的表3(三因素四水平正交试验表)进行了实验。其中,A因素为温度,四组水平分别为40 ℃、60 ℃、80 ℃ 和回流温度;B因素为溶剂组成(甲醇与水的体积比),四组水平分别为蒸馏水、1 ∶9、1 ∶4 和1 ∶2;C因素为反应时间,四组水平分别为2 h、4 h、8 h和12h 。测定的实验结果见表4。
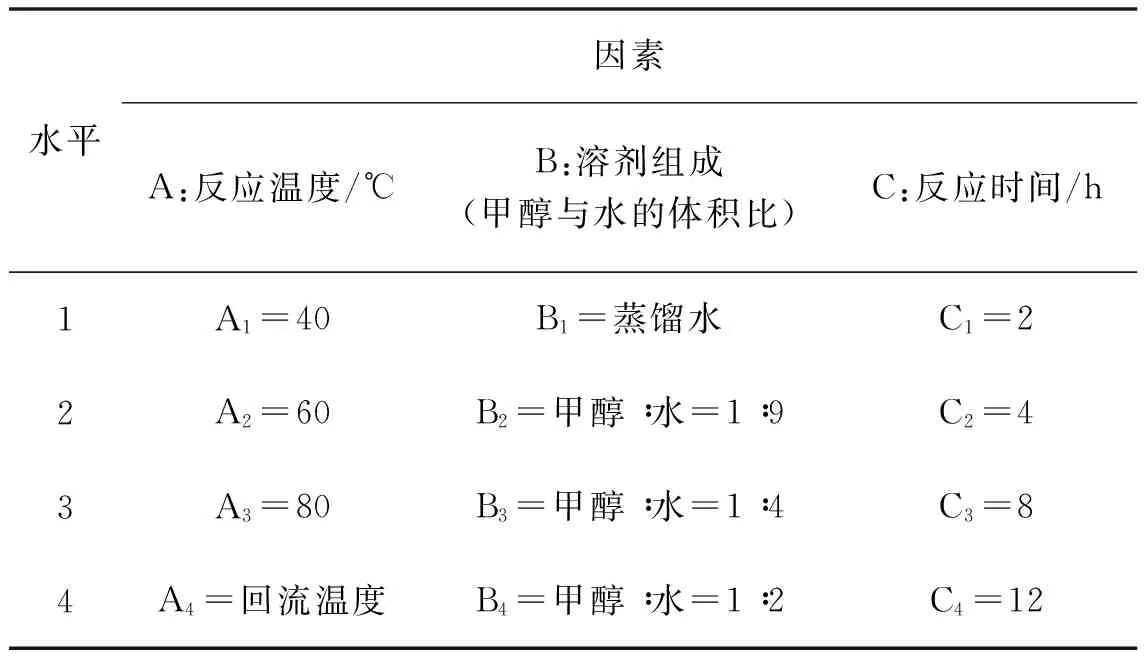
表3 三因素四水平正交试验表
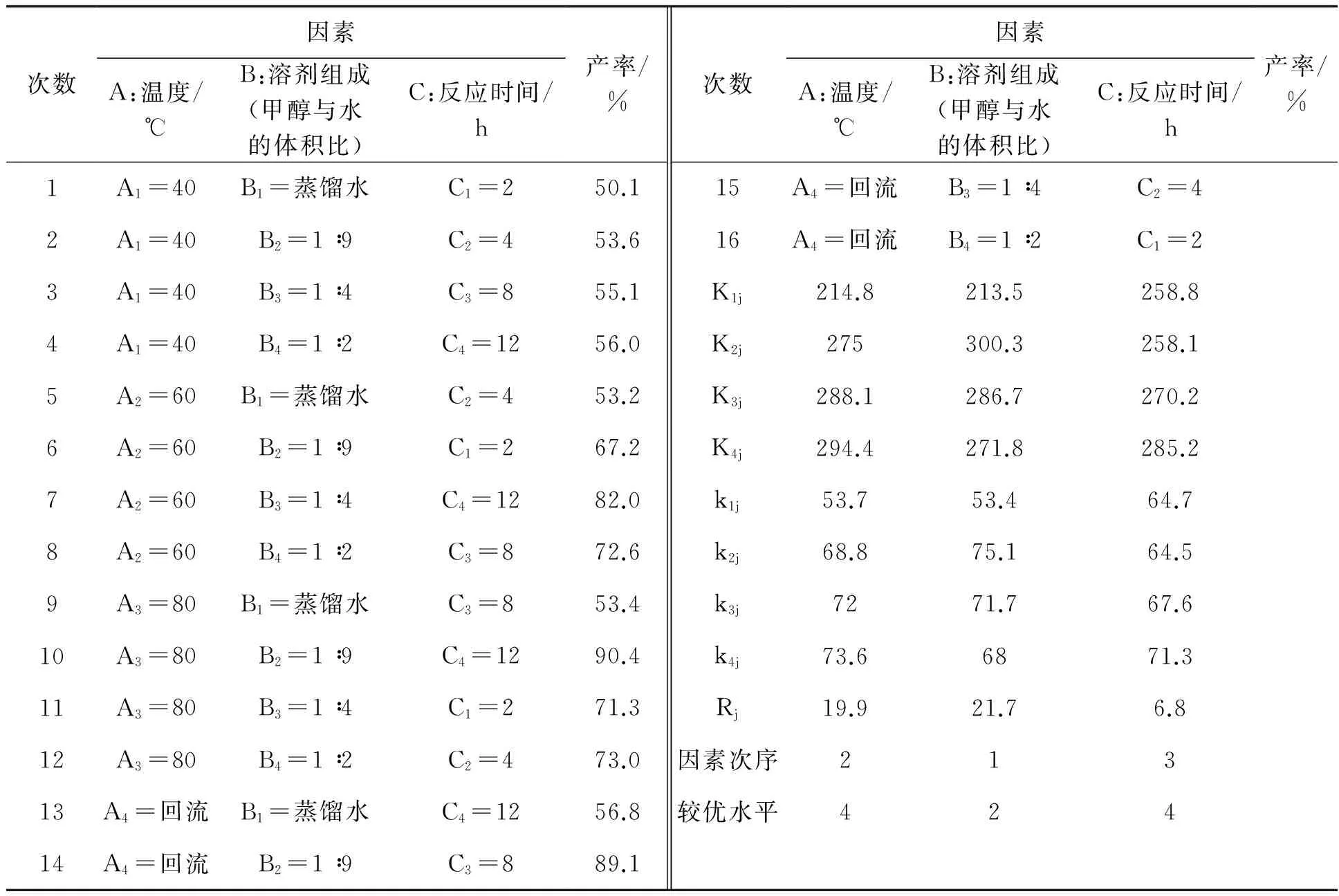
表4 正交试验数据
(注:溶剂的总体积是165 mL;邻硝基对甲苯酚为0.2 g)
从上面的16组正交试验的结果中可以看到,影响产率的因素排序为:B>A>C,最好一组的水平组合是A4B2C4,而在这16组中并无该水平组合,并且从这16组整体数据中可以看出,随着反应温度的升高、反应时间的延长,所要得到的产物的产率就有提高的趋势。因此,根据上面的正交实验结果又选取了A4B2C4这组条件重复了以上实验,得到的最终产率为93.7%(高效液相谱图见图2)。故最佳的反应条件是在混合溶剂甲醇 ∶水(体积比)=1 ∶9中,于回流温度下反应12 h。
3.2固定化α-淀粉酶重复使用性
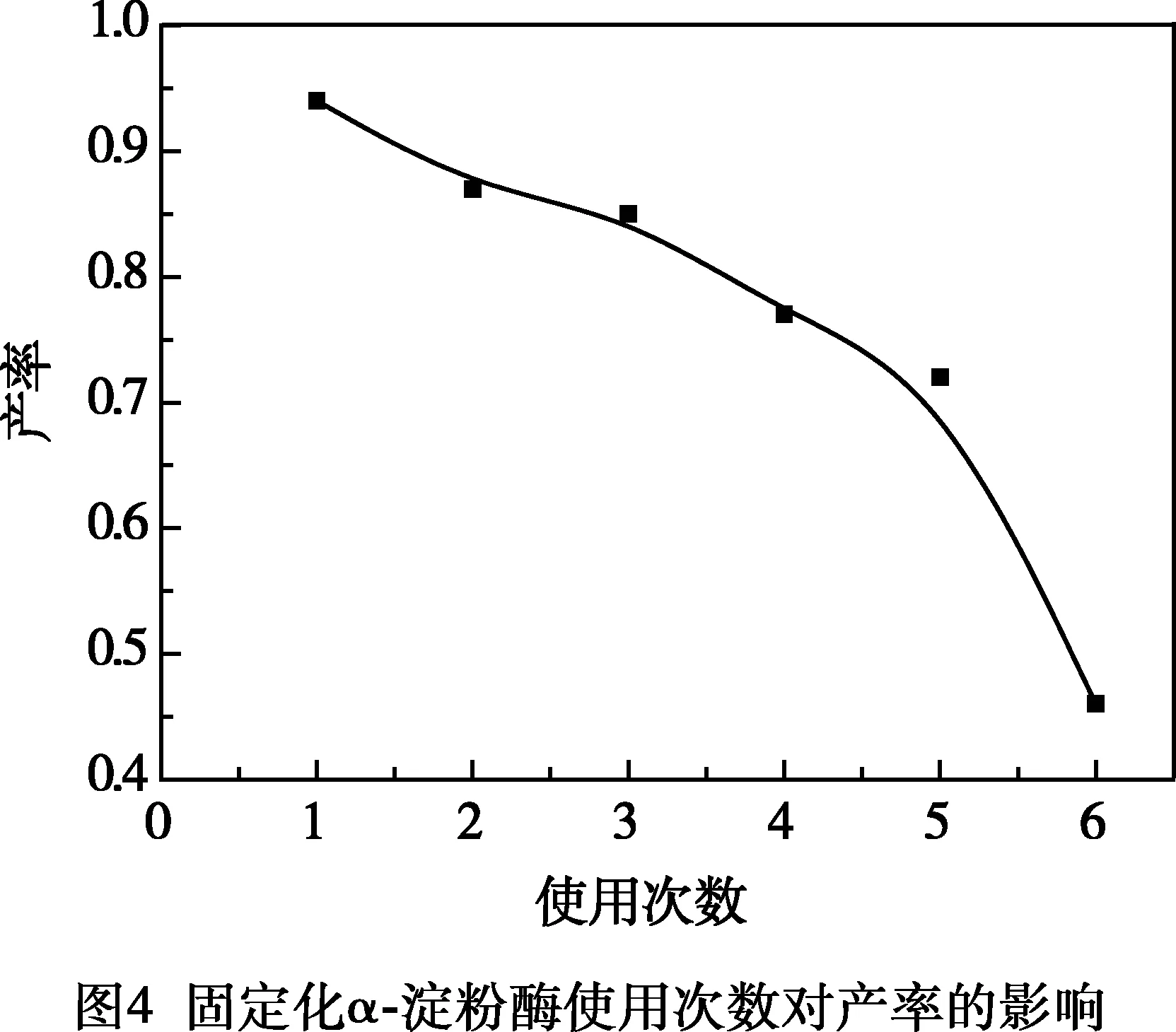
按照1.3.3的步骤并采用A4B2C4组实验条件对固定化α-淀粉酶进行重复实验,来验证固定化酶的重复使用次数。结果见图4。
由图4可知,固定化α-淀粉酶在使用5次后,产品的产率有明显的下降,故重复使用次数为5次。
4 结论
以固定化α-淀粉酶为载体催化还原制备邻氨基对甲苯酚,是生物催化剂应用的一种探索。由于交联剂戊二醛分子两端的两个醛基可以分别与载体及配基上的氨基以五碳桥的形式交联起来,所以载体与酶的结合力较强。而尼龙是由酰胺键联接起来的亲水性载体,与肽键结构非常相似,其价格低廉,化学性质稳定,具有良好的可操作性。此外,尼龙固定化α-淀粉酶的各项性能都有显著的提高,并可多次重复使用,所得产物邻氨基对甲苯酚的产率也较高,最高可以达到93.73%,因此该技术在工业上具有广泛的应用前景,是绿色化工的发展方向。本实验中尼龙对酶的固定化率为39.26%,说明今后还可以在增加酶的固定量以及溶剂回收方面进行更深一步的探索研究。
[1] 吴效楠,刘涛,何南思,等.水合肼法催化还原邻硝基对甲基苯酚的研究[J].承德石油高等专科学校学报,2014,16(5):15.
[2] 陈陶声,居乃琥,陈石根.固定化酶理论与应用[M].北京:北京轻工业出版社,1987.
[3] 陈盛,刘艳如,余萍.淀粉酶的固定化及其柱式反应器的研究[J],福建师范大学学报(自然科学版).1996,12(4):75-79.
[4] 吴效楠.尼龙载体固定化α-淀粉酶的研究[J],化工中间体.2014(10):30.
[5] 唐坤.中间体化学工艺学[M].化学工业出版社,1984.
[6] 陈石根,周润琪.酶学[M].上海:复旦大学出版社,2001.
Immobilizedα-amylaseandItsApplicationinSynthetizingo-amino-p-methylphenol
WU Xiao-nan, ZHENG Zhe-kui, PAN Zi-han
(Department of Chemical Engineering, Chengde Petroleum College, Chengde 067000, Hebei, China)
Synthesis of o-amino-p-methylphenol by catalytic reduction of o-nitro-p-methylphenol in the presence of self-made immobilized α-amylase was studied. The immobilization rate and the number of repeated use of the immobilized α-amylase were determined, and the effects on the yield of temperature, solvent composition and reaction time have been reported by using the orthogonal test. Under the optimum conditions, the yield of o-amino-p-methanephenol was 93.73%(HPLC).
o-amino-p-methylphenol; o-nitro-p-methylphenol; immobilized α-amylase; orthogonal test
TQ203
B
1008-9446(2017)05-0015-05
2016-11-14
吴效楠(1980-),男,河北承德人,副教授,硕士,主要研究方向为工业催化,E-mail:cdpcwxn2007@163.com。

