骨质疏松大鼠骨髓基质细胞膜片制备过程中纤维连接蛋白表达检测
陈玉玲, 何梦娇, 许雄程, 伍晓红, 李艳芬, 陈 超, 骆 凯
更年期妇女随着体内雌激素水平的下降,骨转化增加,骨吸收程度超过骨形成,易出现绝经后骨质疏松症(postmenopausal osteoporosis,PMO),导致骨密度降低,骨组织出现吸收破坏[1]。随着人们生活水平的提高,越来越多的成年人接受正畸治疗,对成年患者尤其是更年期妇女在正畸治疗过程中出现的牙槽骨缺损如骨开裂和骨开窗的处理是所有正畸和牙周医生需要共同面对的问题。随着组织工程技术的发展,细胞膜片技术(cell sheet technology,CST)的出现为实现PMO状态下骨开裂和骨开窗的治疗提供了一个可选择的方法[2]。本研究拟通过体外培养PMO大鼠骨髓基质细胞(bone marrow stromal cell, BMSC)并构建细胞膜片,从基因和蛋白水平检测膜片中细胞外基质(extracellular matrix,ECM)纤维连接蛋白(fibronectin,FN)的表达情况,为应用CST实现PMO状态下牙槽骨缺损的治疗提供实验依据。
1 材料与方法
1.1材料
1.1.1动物 健康SPF级SD大鼠,体质量(100±20) g[福建医科大学动物实验中心,SYXK(闽)2012-0001]。
1.1.2试剂 DMEM培养液、胎牛血清(fetal bovine serum,FBS)(美国Hyclone公司);谷氨酰胺、0.25%胰蛋白酶(美国Gibico BRL公司);维生素C、β-甘油磷酸钠、茜素红S、地塞米松、苏木精、伊红(美国Sigma公司);碱性磷酸酶检测试剂盒(上海碧云天生物技术有限公司);TRIzol®Reagent(美国Life Technologies公司);兔抗大鼠纤维连接蛋白多克隆抗体(货号ab2413,美国Abcam公司);Alexa Fluor®488山羊抗兔 IgG(美国Jackson公司);DAPI染色液、抗荧光淬灭封片剂(美国Amrsco公司);SDS-PAGE凝胶快速配制试剂盒(上海碧云天生物技术研究所);辣根过氧化物酶标记的羊抗兔二抗IgG(中国Biosharp公司);反转录及荧光定量聚合酶链反应试剂盒(日本Takara公司)。
1.1.3仪器 CO2细胞培养箱(Heracell 150,德国Heraeus公司);超净工作台(SW-CJ-1B,苏州净化设备有限公司);生物安全柜(7BZ-ZHF1200A2,上海力新仪器有限公司);倒置荧光相差显微镜(IX-71,日本Olympus公司);高速离心机(SABOFUGE400R,德国Heraeus公司);实时荧光定量PCR仪(LightCycler 480,德国Roche公司);化学发光成像系统(chemiscope5300,上海勤翔科学仪器有限公司);蛋白电泳-电转系统(PP-1150 POWERB-MINIP-4,北京凯元信瑞仪器有限公司)。
1.2方法
1.2.1PMO大鼠BMSC体外培养 参照课题组方法[3],经双侧卵巢切除术建立骨质疏松大鼠模型。建模12周大鼠经腹腔注射氯胺酮(100 mg/kg)麻醉处死,无菌条件下迅速取出完整股骨及胫骨,以DMEM培养液交替冲洗髓腔收集骨髓冲洗液,1 000 r/min离心5 min,弃上清。用含青霉素100 U/mL、链霉素100 mg/L、10%FBS的DMEM培养液重悬,置于CO2细胞培养箱中常规培养。待细胞达80%融合时进行消化传代。
1.2.2PMO大鼠BMSC成骨分化能力检测 将PMO大鼠BMSC以每孔1×105的密度接种于6孔板内,用含2 mmol/L β-甘油磷酸钠、10 mmol/L地塞米松和50 μg/mL维生素C的DMEM成骨诱导液培养7 d后经95%乙醇固定,根据试剂盒说明进行碱性磷酸酶(alkaline phosphatase,ALP)染色。成骨诱导液培养14 d出现肉眼可见矿化结节时,弃培养液,茜素红染色检测矿化结节。
1.2.3PMO大鼠BMSC细胞膜片的构建及观察 选取生长状态良好的PMO大鼠BMSC,以每孔2×105密度接种于6孔板,加入含50 μg/mL维生素C的膜片诱导培养液,每隔3 d更换培养液,连续培养10 d即可获得细胞膜片。将细胞膜片固定后,梯度酒精脱水,浸蜡包埋切片,苏木精-伊红(hematoxylin-eosin, H-E)及Masson染色观察膜片结构。
1.2.4PMO大鼠BMSC细胞膜片FN基因表达检测 将生长状态良好的PMO大鼠BMSC以每孔2×105密度接种于6孔板,用含50 μg/mL维生素C的膜片诱导培养液培养,于培养5,10 d后弃培养液,根据试剂盒说明提取总RNA并逆转录成cDNA,实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction, qPCR)检测细胞膜片FN的表达情况。以GAPDH为内参,2-ΔΔCt法计算相对表达量。引物序列如下:
GAPDH:
上游:CGGCAAGTTCAACGGCACAGTCAAGG
下游:ACGACATACTCAGCACCAGCATCACC
FN:
上游:AGGAGAACCAGGAGAGCACA
下游:TCGGTCACTTCCACAAACTG
1.2.5PMO大鼠BMSC细胞膜片FN蛋白表达检测 取生长状态良好的PMO大鼠BMSC,以每孔2×105密度接种于6孔板,以含50 μg/mL维生素C的膜片诱导培养液培养10 d构建细胞膜片。将细胞分成酶消化组和膜片组,酶消化组采用0.25%胰蛋白酶消化后收集细胞,膜片组直接刮取细胞膜片。2组细胞加入裂解液后,提取细胞总蛋白,测定蛋白浓度,配制适合浓度的 SDS-PAGE胶,上样、电泳、转膜、封闭,一抗GAPDH、FN 4 ℃孵育过夜,洗膜,二抗孵育1~2 h。化学发光显色后采用Image J软件分析条带灰度值。
1.2.6PMO大鼠BMSC细胞膜片FN免疫荧光染色 石蜡包埋的PMO大鼠BMSC细胞膜片制备成4 μm切片,常规脱蜡,梯度酒精复水后,经复合酶修复抗原后洗涤,滴加兔抗大鼠纤维连接蛋白,4 ℃孵育过夜,洗涤,滴加山羊抗兔IgG,37 ℃避光孵育1 h,经DAPI染色后用抗荧光淬灭封片剂封片,荧光显微镜观察拍照。

2 结 果
2.1PMO大鼠BMSC体外培养及成骨分化能力检测 原代培养的PMO大鼠BMSC中红细胞较多,经多次换液后可见贴壁的梭形或纺锤形细胞,培养14 d即可达到近80%融合进行传代(图1A)。经成骨诱导液连续培养7 d,BMSC胞浆内可见棕黑色颗粒状集簇,ALP染色阳性(图1B);成骨诱导液连续培养14 d,细胞局部聚集形成矿化结节,茜素红染色呈橘红色(图1C)。
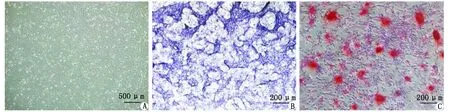
A:原代培养14 d; B:碱性磷酸酶染色; C:矿化结节茜素红染色.图1 骨质疏松大鼠BMSC原代培养及成骨分化能力检测Fig 1 Primary culture and osteogenic differentiation potential of osteoporotic rat bone marrow stromal cell
2.2PMO大鼠BMSC细胞膜片观察 PMO大鼠BMSC经膜片诱导液培养10 d,即可在培养皿底部形成一薄膜样结构,边缘皱褶卷曲,此时可用细胞刮刀或镊子获取细胞膜片(图2A)。经H-E及Masson染色,可见细胞膜片由多层细胞构成,连接紧密,富含胞外基质(图2B,C)。

A:细胞膜片大体观; B:细胞膜片H-E染色; C:细胞膜片Masson染色.图2 骨质疏松大鼠BMSC细胞膜片观察Fig 2 Morphological observation of osteoporotic rat BMSC cell sheet
2.3PMO大鼠BMSC细胞膜片中FN基因及蛋白表达检测 分别于膜片诱导培养液培养5,10 d后收集BMSC进行qPCR 检测,结果显示细胞膜片ECM中FN的mRNA表达随着培养时间的延长显著增加,差别具有统计学意义(P<0.05,图3A)。Western-blot检测结果可见,BMSC细胞膜片组可见明显的条带影像(285 kD),高表达FN;而酶消化组未见明显条带影像(图3B)。经Image J软件分析发现,膜片组的FN蛋白表达水平显著高于酶消化组,差别具有统计学意义(P<0.05,图3C)。
2.4PMO大鼠BMSC细胞膜片中FN免疫荧光染色 免疫荧光染色结果可见PMO大鼠BMSC细胞膜片ECM中高表达FN,镜下呈纤维网状结构(图4)。

FN:纤维连接蛋白. A:细胞膜片FN基因表达qPCR检测(培养不同时间点比较,△:P<0.05); B:细胞膜片FN 蛋白表达Western-blot检测(1:酶消化组;2:膜片组); C:Western-blot检测结果半定量分析(与酶消化组比较,△:P<0.05).图3 骨质疏松大鼠BMSC细胞膜片FN基因及蛋白表达检测Fig 3 Gene and protein detection of FN in osteoporotic rat BMSC cell sheet
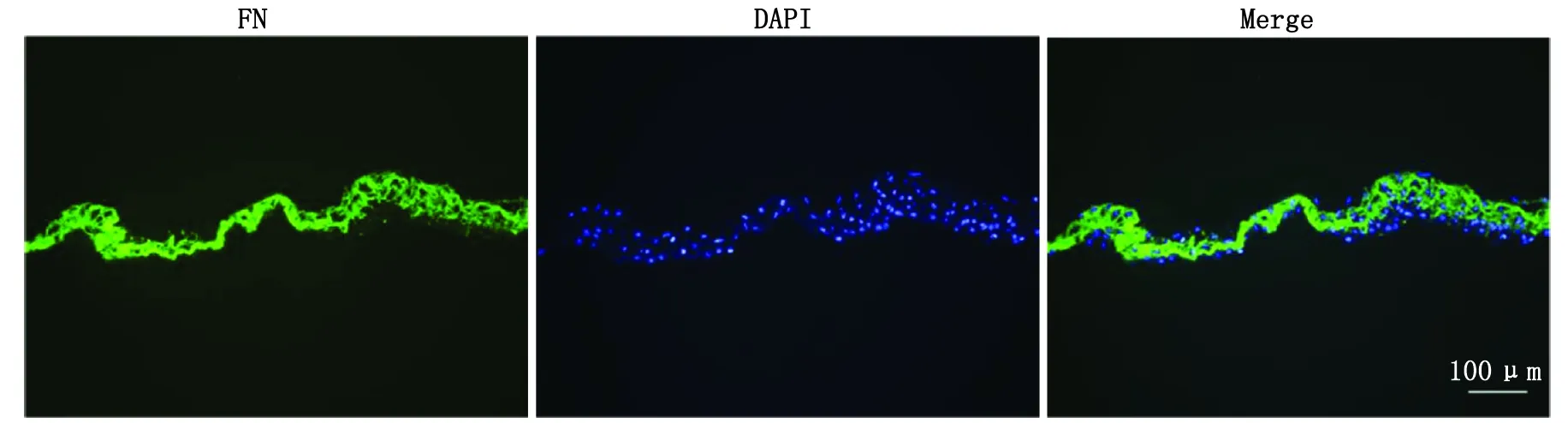
FN:纤维连接蛋白;DAPI:4′,6-二脒基-2-苯基吲哚; Merge:叠加.图4 骨质疏松大鼠BMSC细胞膜片免疫荧光染色Fig 4 Immunofluorescent staining of FN in osteoporotic rat BMSC cell sheet
3 讨 论
1995年,日本学者Okano等报道采用CST技术将培养细胞,待细胞融合后即可形成膜片样组织,应用于组织的再生修复[2]。当前CST已广泛应用于组织再生的各个领域,如心肌组织、角膜和皮肤等[4-5]。利用不同来源的细胞,作为种子细胞采用CST可实现牙周组织的再生[6-10]。上述研究提示,利用CST有望实现正畸治疗中出现的牙槽骨“骨开窗”和“骨开裂”。
BMSC是组织工程技术理想的种子细胞,具有自我更新及多向分化潜能,易于体外分离培养扩增,可实现牙周组织的再生[11]。报道显示,BMSC体外连续培养可获得富含ECM的细胞膜片,与β-磷酸三钙复合后植入裸鼠皮下可形成骨样组织[12-13],植入犬牙周骨缺损中可实现牙周组织的再生[8]。由颌骨BMSC膜片与牙周膜干细胞膜片联合构建的复合膜片高表达成骨及细胞外基质相关基因与蛋白,复合膜片与富血小板纤维蛋白联合应用在体内可形成生理性牙周组织结构[14-15]。将BMSC膜片与牙周膜干细胞膜片联合应用可充分利用两种细胞的特点修复犬牙周组织缺损[9]。当前有关BMSC膜片的研究主要以健康状态的BMSC为种子细胞,本研究在体外培养PMO大鼠BMSC的基础上构建细胞膜片并检测膜片中ECM的表达情况。
以往研究多采用温度反应培养皿来构建膜片。采用该方法需要特殊的设备,同时所构建的膜片由单层细胞构成,膜片较薄,不利于操作。本研究参照文献[16],采用维生素C连续培养法构建PMO大鼠BMSC细胞膜片。采用该方法无需特殊培养设备,仅通过在培养液中添加维生素C进行连续培养,使细胞复层生长,最终形成具有一定机械强度的完整的细胞膜片。维生素C又名抗坏血酸,为水溶性维生素,可刺激细胞增殖并分泌大量ECM,加速细胞膜片的形成[17]。本研究qPCR结果显示,随着体外培养时间的延长,PMO大鼠BMSC在基因水平表达更多的FN,提示研究所用维生素C在BMSC细胞膜片构建中发挥重要的作用,促进细胞形成丰富的ECM。传统组织工程技术需将细胞消化后接种于支架材料,该过程不可避免的会导致细胞ECM的流失,破坏细胞表面受体及信号分子等,在一定程度上影响细胞的功能。本研究发现,采用维生素C连续培养法构建的细胞膜片与酶消化后的BMSC相比,膜片中FN蛋白的含量更高,该结果提示采用CST构建的细胞膜片可避免酶消化对细胞的影响,保留更多的ECM,为实现组织再生创造有利的条件。
ECM是由多种蛋白和多聚糖构成的精细复杂的网状结构,其基本成分包括I型胶原、FN及层黏连蛋白等,还包括一些特殊蛋白如生长因子和蛋白多糖等[18-19]。ECM可为细胞和组织提供全面的支持,在维持细胞的基本生命活动方面发挥重要的作用[18]。FN是由两个多肽糖蛋白亚基经由二硫键连接形成的大分子糖蛋白,包括血浆型FN和细胞型FN两种类型。细胞型FN可表达于细胞和ECM中,是ECM中蛋白质相互整合的关键因素。FN所形成不可溶性纤维网状结构在细胞粘附、迁移及ECM蛋白沉积方面发挥重要作用[20]。本研究采用免疫荧光染色发现所构建的PMO大鼠BMSC膜片中富含FN,说明所构建的膜片具有一定的生物学功能,自身分泌的ECM有望为膜片自体移植实现组织再生尤其是牙槽骨缺损的修复提供帮助。
尽管在本研究条件下采用维生素C培养基进行连续培养可成功获取富含ECM的PMO大鼠BMSC细胞膜片,但课题组以往的研究发现,PMO状态下BMSC的成骨分化能力减弱[11]。因此,所构建的细胞膜片的成骨分化能力如何,其在体内能否修复正畸治疗所致的牙槽骨缺损尚有待后续实验探讨。

