钒氧化物纳米带的合成及其去除水中Cu2+离子的研究
段永胜 ,杨修春 ,2
(1.同济大学 材料科学与工程学院,上海 201804;2.同济大学 土木工程教育部重点实验室,上海 201804)
0 引 言
随着社会不断进步和工业快速发展,重金属废水污染严重威胁到生活环境和生命健康。其中Cu2+废水的处理方法主要有化学沉淀、离子交换、溶剂萃取、氧化还原、过滤和吸附法等[1],吸附法具有易于操作、低能耗和低残留等优点[2-3]。通常使用的吸附剂包括活性炭、壳聚糖、天然沸石、生物吸附剂等[4-5]。纳米材料包括纳米粒子[6]、纳米复合材料[7]以及纳米纤维材料等[8,9]作为一种新型的吸附剂,具有高比表面积、高孔隙率等优点,在重金属废水处理中的应用越来越多。近年来,国内外学者发现钒氧化物在电极材料[10]、光电[11]、智能窗[12]、气敏传感器[13-14]、磁性以及催化[15]等方面有着潜在的应用前景。V2O5是价态最高的钒氧化物,具有开放的层状结构[16]和半导体特性[17]。当钒氧化物进入低维结构时,由于较大的比表面积和量子尺寸效应,可能产生许多的奇异的物理和化学现象。Li等[18]通过水热处理V2O5和H2O2的水溶液,获得宽度为100-300 nm,厚度为30-40 nm,长度达数十微米的V2O5纳米线。目前对一维钒氧化物纳米材料的制备主要利用水热法和溶胶凝胶法,很少有通过电化学方法制备一维钒氧化物纳米材料的报道,未见用钒氧化物纳米材料吸附水中重金属离子的报道。
本文以钒箔作为V源,水作为O源,采用电化学方法制备出了钒氧化物纳米带,其长度在0.5-3.0 μm之间,宽度在20-50 nm之间,对水中Cu2+具有很好的吸附能力,吸附率达到99.0%。
1 实 验
1.1 材料制备
将钒箔剪切成2 cm × 2 cm的正方形(厚度为0.35 mm,纯度为99.9%),用1200目砂纸打磨钒箔表面,去除表面氧化层,然后用蒸馏水超声清洗,晾干备用。将17.40 g NaCl、0.80 g KCl、2.90 g CaCl2·2H2O、4.89 g MgCl2·6H2O溶入1 L去离子水中,充分溶解,得到溶液A。取2 mL溶液A和1 mL HNO3混合,加去离子水稀释,配置成60 mL电解液。用以上制备的钒箔作为阳极,铂片作为阴极,加入电解液至淹没钒箔和铂片的2/3部分,连接上稳压直流电源,调节电压至3 V,开始阳极氧化。钒箔慢慢溶解,电解液的颜色从无色变成蓝色。经过一段时间反应,电解液慢慢变成黑色的悬浊液。反应不断进行,直至浸入电解液中的钒箔全部溶解,其阳极氧化过程如下:
阳极反应:
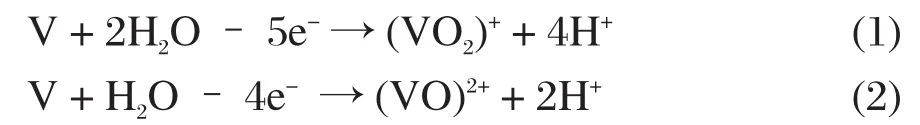
阴极反应:

电解液中反应:
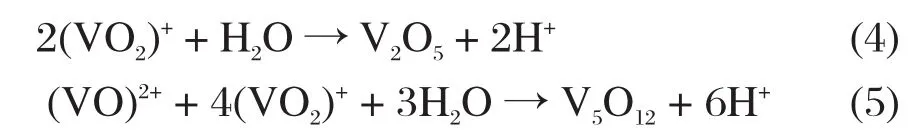
通过离心分离电解液,得到沉淀物,将沉淀物进行多次水洗,60 ℃下烘干,得到最终产物B。
1.2 组成、结构和形貌的表征
采用X射线衍射仪(XRD,D/max 2550 VB3+ /PC型,λ=0.15406 nm)分析样品的物相,利用高分辨透射电子显微镜(HRTEM,AH-800型,加速电压为200 kV)观察样品的微观形貌和结构,用综合热分析(TG/DSC,ZH1250型)分析样品的脱水过程。
1.3 吸附Cu2+性能测试
称量1.00 g的样品B放入烧杯中,加入50 m L(5 0mg/L)硫酸铜溶液,吸附时间0-72 h,每隔一段时间取出1 mL溶液,加入0.04 mL铜试剂[(C2H5)2NCSSNa, 4.0 g/L]和适量氨水溶液(1 mol/L),稀释至50 mL 溶液C,pH值约为9.0。使用紫外-可见分光光度计对溶液C进行测试,扫描范围300-800 nm,扫描速度10 nm/s。二乙基二硫代氨基甲酸根(C2H5)2NCSS-)与Cu2+通过两个硫原子螯合,与Cu2+形成平面四方形的配合物,配合物在λ=452 nm处有吸收峰,利用吸光度计算溶液C中Cu2+浓度。
2 结果与讨论
图1为样品B热处理前后的XRD 图谱。由图1可以看出,样品B未做热处理时,样品中含有结晶水,其组分是V2O5·1.6H2O和V5O12·6H2O;在300℃条件下空气中热处理3 h后,样品中的结晶水脱去,同时钒氧化物中低价态钒发生了氧化反应,经过热处理后完全生成V2O5。
图2给出了样品B的TG-DSC图。由图2可见,随着温度的升高,样品B发生以下变化:在40-150 ℃(Ⅰ区),重量从38.95 mg下降至18.89 mg,失重达52.61%(质量分数),并出现了明显的吸热峰1,这是由于钒氧化物脱去物理吸附水的缘故;在150-265 ℃(Ⅱ区),重量从18.89 mg下降至15.79 mg,继续失重7.90%,钒氧化物失去层间结合水,出现吸热峰2。根据结晶水的摩尔量可计算出V2O5·1.6H2O和V5O12·6H2O摩尔比为2.92 ∶ 1。当温度高于265 ℃时,出现缓慢增重的现象,这是由于V5O12发生了氧化,生成V2O5的缘故。放热峰3的存在,也证明是V5O12发生氧化反应放热。
图3为样品B的TEM照片。将制备的样品B粉末置于无水乙醇中,分别超声分散15 min和3 h,制样后利用高分辨透射电子显微镜观察样品的形貌特征和微观结构。比较图3(a,b)与(c,d)可以看出,经过长时间超声作用,团聚的钒氧化物纳米带发生分散,纳米带的长度为0.5-3 μm,宽度在20-50 nm之间。

图1 样品B热处理前后的XRD图谱Fig.1 XRD patterns of sample B before and after thermal treatment

图2 样品B的TG-DSC曲线Fig.2 TG and DSC curves of sample B
图4为样品B的HRTEM照片。由图4可以看出高分辨中可以观察到晶格条纹,(c)中晶面间距为0.2134 nm、0.2107 nm,经与V2O5的PDF卡片比较得知,上述晶面为V2O5(0 2 0)晶面。V2O5·1.6H2O中层间插入了H2O分子,导致层间增大。(d)中晶面间距为0.2096 nm、0.3436 nm,与V5O12· 6H2O的PDF卡片比较得知,上述晶面为V5O12·6H2O(-16 0 2)、V5O12· 6H2O(-6 0 3)晶面。

图3 钒氧化物纳米带的透射电镜照片,(a,b)是超声分散15 min,(c,d)是超声分散3 hFig.3 Typical TEM images of vanadium oxide nanobelts: (a, b) ultrasonic dispersion for 15 min;(c, d) ultrasonic dispersion for 3 h

图4 钒氧化物纳米带超声分散3 h的高分辨透射电镜照片Fig.4 Typical HRTEM images of vanadium oxide nanobelts with 3 h ultrasonic dispersion
图5为钒氧化物纳米带吸附不同时间溶液C的紫外-可见吸收光谱。由图5可以看出,所配制的Cu2+溶液在波长300-800 nm区间范围会出现三个吸收峰。E峰是铜试剂产生; F峰是Cu2+与铜试剂形成络合物的特征峰,吸收峰强度和络合物浓度之间具有良好的线性关系[19];G峰也是Cu2+与铜试剂形成络合物产生,吸光度强度较低。根据图5中λ=452 nm处吸收峰的吸光度,可以计算钒氧化物纳米带吸附不同时间后Cu2+溶液中Cu2+的含量,并计算钒氧化物纳米带的Cu2+吸附率Kt 随时间t的变化:
Kt=(At-An)/(A0-An),Kt对应t时刻的吸附率,At对应t时刻λ=452 nm处的吸光度,An对应无Cu2+溶液的λ=452 nm处的吸光度,A0对应0时刻λ=452 nm处的吸光度。
图6为不同吸附时间紫外-可见吸收光谱中λ=452 nm处吸光度和对应的Cu2+吸附率。由图6可知,所制备的钒氧化物纳米带对Cu2+有着很好的吸附效果,在浸泡1 h时,吸附率已经到达42.0%,随后吸附速率下降,72小时吸附率达到了99.0%。
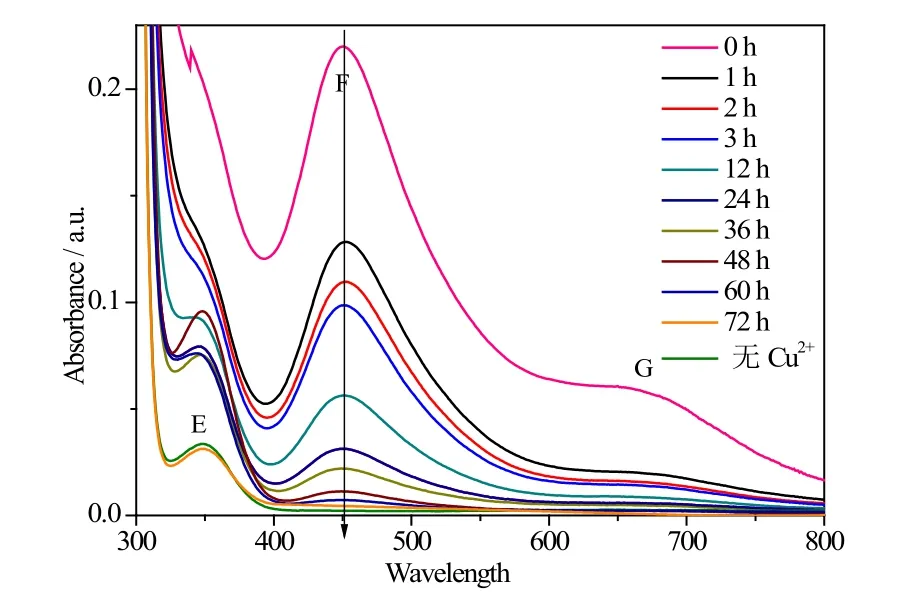
图5 钒氧化物纳米带吸附时间对Cu2+溶液吸收光谱的影响Fig.5 In fl uence of the adsorption time of vanadium oxide nanobelts on the absorption spectra of Cu2+ solution
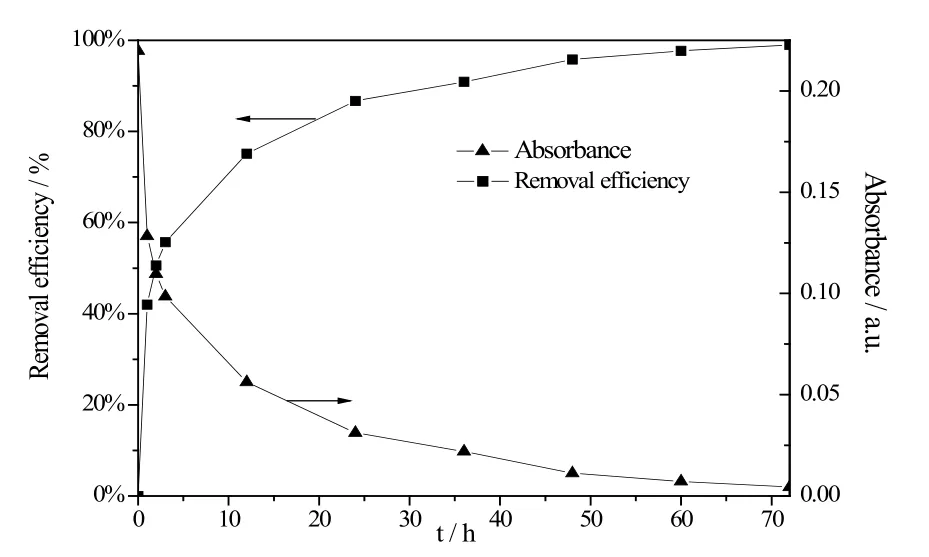
图6 吸附时间对钒氧化物纳米带吸附Cu2+的影响Fig.6 The effect of the contact time on Cu2+ absorption
3 结 论
采用阳极氧化法,混合盐和硝酸溶液作为电解液,钒箔作为阳极,制备出V2O5·1.6H2O、V5O12·6H2O两种钒氧化物纳米带,长度为0.5-3.0 μm,宽度为20-50 nm;该氧化物纳米带对水中Cu2+有着很好的吸附效果,吸附率达到了99.0%。
[1]ZHANG X Z, SUO S F, JIANG Y H, et al. Preparation of hollow fiber ceramic UF membrane and its application in the treatment of heavy metal ion wastewater [J]. Journal of Ceramics, 2015,36(6)∶ 583-588.
[2]COSKUN R, SOYKAN C, SACAK M. Adsorption of copper (II), nickel (II) and cobalt (II) ions from aqueous solution by methacrylic acid/acrylamide monomer mixture grafted poly(ethylene terephthalate) fiber [J]. Separation &Purification Technology, 2006, 49(2)∶ 107-114.
[3]RAHMAN M S, ISLAM M R. Effects of pH on isotherms modeling for Cu (II) ions adsorption using maple wood sawdust[J]. Chemical Engineering Journal, 2009, 149(1)∶ 273-280.
[4]WAN M W, KAN C C, ROGEL B D, et al. Adsorption of copper(II) and lead (II) ions from aqueous solution on chitosan-coated sand [J]. Carbohydrate Polymers, 2010, 80(3)∶ 891-899.
[5]MONIER M, AYAD D M, SARHAN A A. Adsorption of Cu(II),Hg(II), and Ni(II) ions by modified natural wool chelating fibers[J]. Journal of Hazardous Materials, 2010, 176(1-3)∶ 348-355.
[6]HU X J, WANG J S, LIU Y G, et al. Adsorption of chromium(VI) by ethylenediamine-modified cross-linked magnetic chitosan resin∶ Isotherms, kinetics and thermodynamics [J].Journal of Hazardous Materials, 2011, 185(1)∶ 306-314.
[7]LI X, LI Y, YE Z. Preparation of macroporous bead adsorbents based on poly(vinyl alcohol)/chitosan and their adsorption properties for heavy metals from aqueous solution [J]. Chemical Engineering Journal, 2011, 178(60-68)∶ 60-68.
[8]HEIDARI A, YOUNESI H, MEHRABAN Z, et al. Selective adsorption of Pb(II), Cd(II), and Ni(II) ions from aqueous solution using chitosan-MAA nanoparticles [J]. International Journal of Biological Macromolecules, 2013, 61∶ 251-263.
[9]HOSSAIN M A, NGO H H, GUO W S, et al. Competitive adsorption of metals on cabbage waste from multi-metal solutions [J]. Bioresource Technology, 2014, 160(6)∶ 79-88.
[10]WEI Q, TAN S, LIU X, et al. Novel polygonal vanadium oxide nanoscrolls as stable cathode for lithium storage [J]. Advanced Functional Materials, 2015, 25(12)∶ 1773-1779.
[11]LI Z, HU Z, PENG J, et al. Ultrahigh infrared photoresponse from core-shell single-domain-VO2/V2O5heterostructure in nanobeam [J]. Advanced Functional Materials, 2014, 24(13)∶1821-1830.
[12]PARKIN I P. Intelligent thermochromic windows [J]. Journal of Chemical Education, 2006, 83(3)∶ 393-400.
[13]GOODILIN E A, BADALYAN S M. Sensor properties of vanadium oxide nanotubes [J]. Mendeleev Communications,2008, 18(1)∶ 6-7.
[14]RAJ A D, PAZHANIVEL T, KUMAR P S, et al. Self assembled V2O5nanorods for gas sensors [J]. Current Applied Physics, 2010, 10(2)∶ 531-537.
[15]LIU F, SONG S, XUE D, et al. Selective crystallization with preferred lithium-ion storage capability of inorganic materials[J]. Nanoscale Research Letters, 2012, 7(1)∶ 149.
[16]LI Y M, KUDO T. Electrochromic properties of spin-coated thin films from peroxo-polymolybdovanadate solutions [J].Journal of the Electrochemical Society, 1995, 142(4)∶ 1194-1198.
[17]YAN B, LIAO L, YOU Y, et al. Single-crystalline V2O5ultralong nanoribbon waveguides [J]. Advanced Materials, 2010,21(24)∶ 2436-2440.
[18]LI G, PANG S, JIANG L, et al. Environmentally friendly chemical route to vanadium oxide single-crystalline nanobelts as a cathode material for lithium-ion batteries [J]. The Journal of Physical Chemistry B, 2006, 110(19)∶ 9383-9386.
[19]YANG R P, LI X X, DING L, et al. Determination of copper ions in polluted water [J]. Chinese Journal of Health Laboratory Technology, 2007, 17(12)∶ 2217-2218.

