let-7b介导IGF2BP3表达抑制鸡成肌细胞增殖效果的研究
岳孝亭,刘 燊,杨承忠,吕敏芝,郭金彪,张绮琼,刘洁珠,林树茂
(佛山科学技术学院 生命科学与工程学院,广东 佛山528231)
骨骼肌的生长发育过程涉及多信号途径、多基因表达及网络式调控,其过程很复杂。包括骨骼肌的细胞增殖、分化和凋亡等过程,受到多种细胞因子的调控。在不同的发育阶段,相关基因互相影响,借助于复杂的网络调控通路方式,共同维持肌肉的生长与分化。目前对骨骼肌发育的研究主要集中在蛋白编码基因,其中包含MADS同源盒蛋白、锌指蛋白和Wnt家族成员、基于碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)蛋白质家族的Myf5、MyoD、Mrf4和Myogenin等生肌调节因子(Myogenic Regulatory Factors,MRFs)或肌源性分化因子(Myogenic Differentiation Factors,MDFs)等基因,这些基因的表达对肌细胞的构成、分化和肌组织形态的构建起着特殊的作用[1-3]。微小RNA(microRNA,miRNA)是一类长度约为22 nt(18~25 nt)的非编码单链小分子RNA,在动物体内普遍存在并且参与其生长、发育、代谢、凋亡等生命过程。miRNA通过与靶基因mRNA的3'UTR相结合,在转录水平引起靶基因mRNA的降解或抑制其蛋白质合成,从而来调控靶基因的表达[4]。
从19世纪末,Lee等[5]在秀丽新小杆线虫(c.elegans)中发现了一种调控胚胎后期发育的第一个miRNA-lin4后,有越来越多的miRNA被发现。本世纪初,有人在线虫中初次发现 let-7,现已成为目前研究最为普遍的miRNA家族之一[6]。let-7具有高度时空表达性、组织特异性、保守性等特点,普遍参加细胞的分化、增殖、凋亡和癌细胞的浸润。先期研究发现,let-7b作为let-7家族的重要成员之一,对鸡的骨骼肌生长发育发挥重要作用[7]。通过采用生物信息学方法进行分析,进一步发现IGF2BP3是let-7b的候选靶基因。研究发现,IGF2BP3(Insulin-like Growth Factor 2 mRNA-Binding Protein 3),又名IMP3(IGF2 mRNA-Binding Protein 3)、KOC(KH-domain containing Protein overexpressed in cancer)和L523S,属于VICKZ家族(Vgl,RBP/Vera,IMP-l,2,3,CRD-BP,KOC,ZBP-l),是胰岛素样生长因子RNA结合蛋白家族(RNA-binding proteins,RBPs)中的重要成员,具有促进生长发育的作用。研究发现,IGF2BP3(IMP3)能够高度特异地与编码IGF2的mRNA相结合,是一种可以与胰岛素样生长因子(IGFs)相结合的分泌性蛋白,参与IGF2 mRNA的定位、稳定性、反转录和翻译的调节,对RNA的运输、稳定、细胞的增殖和迁移具有非常重要的作用[8]。为此,本研究以let-7b过表达载体转染鸡成肌细胞,通过观察成肌细胞的生长以及IGF2BP3等相关基因的表达情况,以进一步探讨let-7b对鸡骨骼肌生长发育的分子调控机制。
1 材料与方法
1.1 载体构建
根据let-7b 前体序列设计引物(见表1),在其两端各保留约200 bp,从鸡基因组中PCR 扩增获得约541bp片段,通过酶切位点NotI与ApaI将其连入真核表达载体pcDNA3.1,构建let-7b过表达载体pcDNA-EGFP-pre-let-7b。根据预测的IGF2BP3 3′UTR 与let-7b结合的靶位点设计引物,在其两端各保留约200bp,从鸡基因组中PCR 扩增获得约453bp片段,通过酶切位点SacI与XbaI将其连入靶基因报告载体pMIR-REPORT,构建IGF2BP3报告载体pmirGLO-let-7b-IGF2BP3 3'UTR。根据种子区设计突变引物,与IGF2BP3 3′UTR 引物进行重叠PCR对靶位点进行突变,将突变产物连入pMIR-REPORT,构建IGF2BP3靶位点突变报告载体pMIR-mIGF2BP3(表2)。
1.2 双荧光素酶检测
本试验采用双荧光素酶报告系统进行靶标验证。首先将let-7b的候选靶基因IGF2BP3 3'UTR靶序列插入到萤火虫荧光素酶基因下游。然后进行共转染试验。试验分为3个组:(1)let-7b过表达载体pcDNA-EGFP-pre-let-7b与其靶基因IGF2BP3 验证载体pmirGLO-let-7b-IGF2BP3 3'UTR共转染到DF-1细胞(let-7b组);(2)let-7b过表达载体与靶基因IGF2BP3种子序列点突变载体共转染组(let-7b-mut组);(3)let-7b过表达载体与空质粒载体共转染对照组(NC组)。
具体方法为:在24孔板中,对于每孔细胞,转染pmirGLO-miR-基因3'UTR(或突变质粒)200 ng、pcDNA-EGFP-pre-miRNA 600 ng及阴性对照30 pM。50 μL OPTI-MEMI培养基稀释2 μL Lipofectamine 2000试剂后孵育5 min;混合需转染的DNA和稀释的Lipofectamine 2000,室温孵育20 min后直接将复合物加到含0.4 mL OPTI-MEMI培养基的细胞中,轻轻摇动培养板混匀;在37 ℃,5%CO2培养箱培养5 h后换0.5 mL含10%FBS,不含抗生素的正常DMEM培养基,在37 ℃,5%CO2培养箱中培养36 h,收集细胞。

表1 pre-let-7b及其侧翼序列的扩增引物Table 1 Primer for pre-let-7b
注:下划线部分为保护碱基序列,斜体部分为酶切位点(NotI与ApaI)。下同。
Note:The underlined part is protective base,the italicized part is restriction site. (NotIandApaI).The same below.

表2 let-7b靶基因IGF2BP3 3'UTR序列扩增引物Table 2 Primer for predicted target gene IGF2BP3 3'UTR of let-7b
荧光素酶检测按照Dual Luciferase Reporter Gene AssayKit(Promega公司)说明书检测报告基因的强度。
1.3 成肌细胞的分离培养
参照成肌细胞分离培养的步骤进行[9]。将孵化至E11 的胚蛋,用75%乙醇消毒蛋壳,无菌操作取出胚胎,分离肌肉置于预先加入磷酸缓冲盐溶液(phosphate buffer saline, PBS)的培养皿中。将肌肉组织剪碎,加入DMEM生长培养基(含15%胎牛血清);将组织液移入50 mL离心管中,在旋涡振荡器上高速混合40 s,吸取上清液,用双层200 目尼龙膜过滤。反复震荡过滤3 次,收集全部滤液1 000 r/min转离心5 min,弃上清。用新鲜的生长培养基重悬细胞,移至培养皿中,37 ℃,5% CO2条件下培养40 min;如此反复差贴3次,以消除成纤维细胞。
1.4 功能验证
将let-7b过表达载体pcDNA-EGFP-pre-let-7b转染至成肌细胞,并同时设空质粒对照。具体方法为:50 μL OPTI-MEMⅠ培养基稀释600ng let-7b过表达载体,轻柔混匀室温孵育5 min;50 μL OPTI-MEMⅠ培养基稀释2 μL Lipofectamine 2000试剂后轻柔混匀室温孵育5 min;将上述两样品混合,室温孵育20 min后直接将复合物加到含0.4 mL OPTI-MEMⅠ培养基的细胞中,来回摇动培养板,轻轻混匀;于37 ℃,5% CO2培养箱中培养4~6 h后换0.5 mL含10%FBS,不含抗生素的DMEM培养基,于37 ℃,5% CO2培养箱中培养。分别培养24 h、48 h、72 h,提取RNA并反转录,不同时间组分别设3个重复。
用MTT法测定OD值[10]。转染后,分别培养24 h、48 h、72 h,每个时间点设5个平行样品。每孔加入MTT (5 mg/mL)20 μL,继续培养4 h,终止培养,小心吸尽培养液。每孔加入150 μL DMSO 振荡10 min。在酶标仪上读取OD值,检测波长570 nm。取每个时间点3个平行样品的平均值,根据OD值绘制细胞的生长曲线。
qPCR检测基因表达量:采用实时荧光定量PCR 的方法检测let-7b 、IGF2BP3、IGF2、IGF2R、IGF1和IGF1R的表达,具体方法见参考文献[7],引物信息见表3。

表3 qRT-PCR引物的信息Table 3 Sequences of primers used for qRT-PCR
采用Western blot测定其靶基因的蛋白质表达量。ELISA检测,依照蛋白质种类的不同依照所购试剂盒的说明书操作。
1.5 统计分析
实时荧光定量PCR 结果采用2-ΔCt分析IGF2BP3、IGF2、IGF1等基因相对于GAPDH基因、let-7b相对于18S的表达。双荧光素酶检测结果采用萤火虫荧光素酶活性与海肾荧光素酶活性比进行分析。试验数据以“均值±标准误”表示,组间比较采用SPSS12.0 软件的t检验。
2 结果与分析
2.1 miRNA let-7b与靶基因IGF2BP3 3'UTR的双荧光素酶验证
共转染IGF2BP3 3'UTR荧光素酶报告与let-7b过表达载体到DF-1细胞,双荧光素酶验证结果显示,let-7b过表达载体与IGF2BP3 验证载体共转染组的荧光素酶相对活性明显下降,表明let-7b能够抑制IGF2BP3 的 3'UTR荧光素酶报告基因的活性;而当结合let-7b的位点突变后,这种抑制作用大大降低,表明let-7b与靶基因IGF2BP3有确切的靶标关系(图1)。

图1 let-7b与靶基因IGF2BP3 3'UTR靶标萤火虫/海肾双荧光素酶验证Fig.1 Validation of luc2/hRluc-neo between let-7b and IGF2BP3
2.2 miRNA let-7b对成肌细胞增殖的影响
将let-7b过表达载体pcDNA-EGFP-pre-let-7b转染到成肌细胞,并同时设空质粒对照。在细胞培育0h、24h、48h、72h后,采用MTT检测试剂盒对细胞增殖情况进行鉴定,结果见图2。从图2可以看出,let-7b过表达载体转染成肌细胞后,与空质粒组相比,细胞增殖受到一定程度的影响,细胞数量呈现逐渐下降的趋势。
2.3 miRNA let-7b对靶基因IGF2BP3与相关基因的mRNA表达量的影响
将let-7b过表达载体pcDNA-EGFP-pre-let-7b转染成肌细胞,同时设置空质粒对照组。细胞培养36h后,分别收集细胞并提取总RNA,并同时进行荧光定量分析(见图3)。从图3中可见,let-7b过表达载体转染成肌细胞后,let-7b的表达量为空质粒对照组的3.09倍,差异极显著(P<0.01),其靶基因 IGF2BP3的mRNA表达量则下调了2.33倍,差异显著(P<0.05),说明let-7b对IGF2BP3基因有负向调控作用。而IGF2、IGF1的mRNA表达量有一定程度的变化,但差异不显著(P>0.05)。
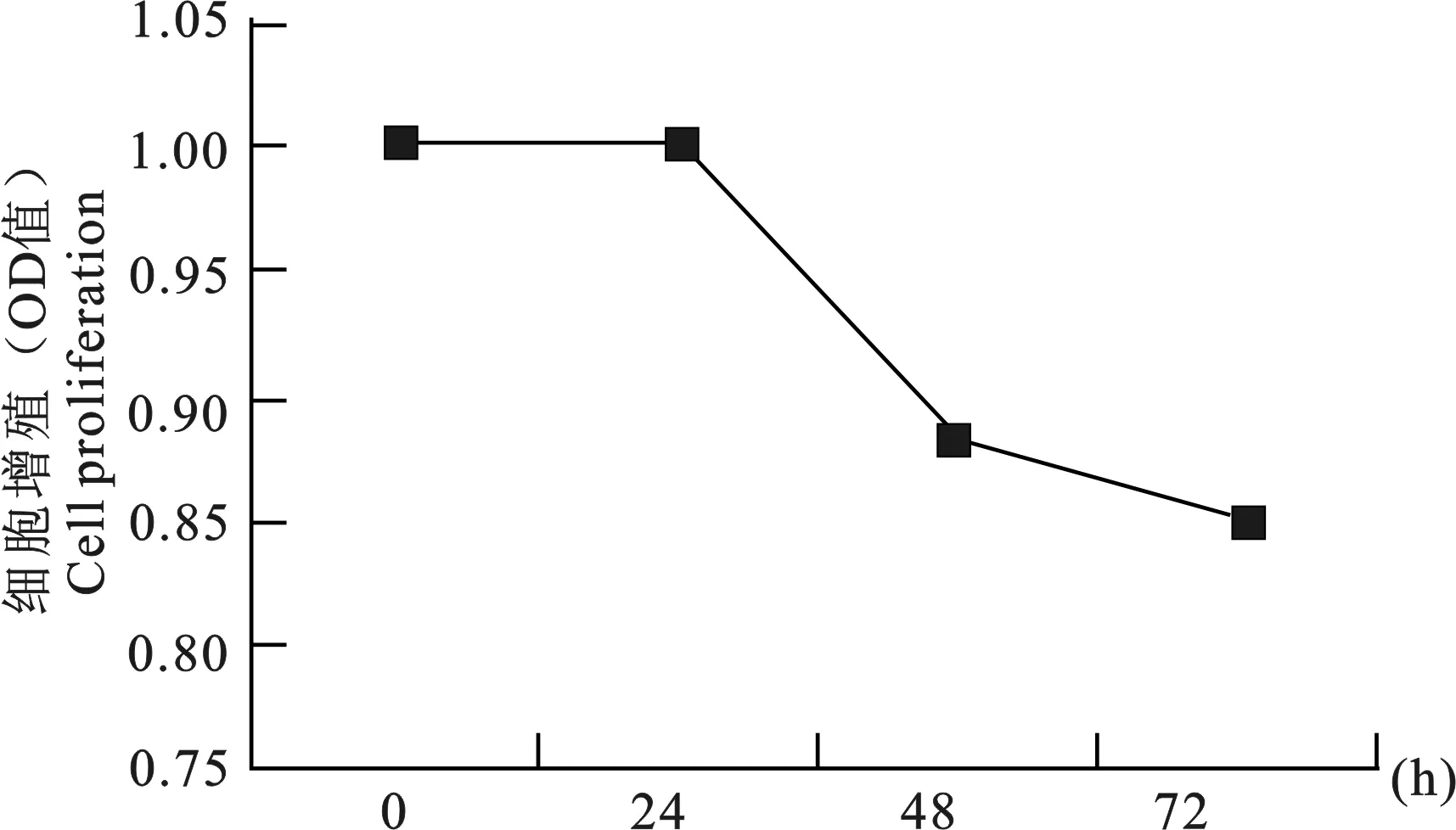
图2 miRNA let-7b对成肌细胞增殖的影响Fig.2 Effects of miRNA let-7b on myoblast proliferation
2.4 miRNA let-7b对靶基因IGF2BP3的蛋白质表达量的影响
把let-7b过表达载体pcDNA-EGFP-pre-let-7b转染成肌细胞,并且设置空质粒对照组。细胞培养36 h后,对成肌细胞的蛋白质表达量进行western blotting和ELISA分析,结果见图4、图5。
从图4可知,let-7b转染成肌细胞36 h后,IGF2BP3的蛋白质表达量明显减少,这与上述let-7b过表达可使IGF2BP3基因mRNA表达量下调2.33倍的结果相一致。

图3 miRNA let-7b对靶基因IGF2BP3及相关基因的mRNA表达量的影响Fig.3 Effects of miRNA let-7b on mRNA expression of target gene IGF2BP3 and related genes

图4 miRNA let-7b对成肌细胞IGF2BP3蛋白质表达量的影响Fig.4 Effect of miRNA let-7b on the expression of IGF2BP3 protein in myoblasts

图5 let-7b对成肌细胞IGF2、IGF1表达量的影响Fig. 5 Effects of let-7b on the expression of IGF2 and IGF1 in myoblasts
从图5可知,根据ELISA分析,let-7b转染成肌细胞24 h,IGF2的蛋白质表达量与空质粒对照组比较,下降了57.1%,差异显著(P<0.05),但在转染后36 h,IGF2的蛋白质表达量与空质粒对照组接近,差别不显著(P>0.05),说明let-7b对IGF2的蛋白质表达的影响随时间的延长而逐渐减弱(见图5A)。从ELISA分析结果来看,把let-7b转染到成肌细胞24h后,IGF1的蛋白质表达量与空质粒对照组相比下降了8.4%,差异不显著(P>0.05),但在转染后36h,IGF1的蛋白质表达量与空质粒对照组相比较,下降了24.5%,差异显著(P<0.05),说明let-7b对IGF1的蛋白质表达的影响随时间的延长而逐渐增强(见图5B)。
3 讨 论
骨骼肌的生长发育过程涉及多基因调控,受许多细胞因子的调理,过程非常繁琐。miRNA是一类长度约为22 nt的非编码小分子单链 RNA,在动物体内广泛存在并参与调节动物的生长、发育等一系列生命过程。miRNA经过与靶基因mRNA相结合,从而在转录程度上导致靶基因mRNA的降解或翻译的抑制,参与基因转录后调控。
IGF2BP3作为一种转录后基因表达调控因子,主要参与胚胎发育和肿瘤发生而受到广泛重视[11]。对IGF2BP3的研究主要集中在动物癌细胞的调控机制方面,大量研究表明,IGF2BP3对促进癌症细胞的增殖具有重要作用[12-13]。有关IGF2BP3参与调控鸡生长发育的研究报道很少。本研究在前期靶基因预测的基础上,通过let-7b过表达载体转染至DF-1细胞进行双荧光素酶靶标验证,证明miRNA let-7b对IGF2BP3基因具有靶向调控作用。为了进一步观察miRNA let-7b对骨骼肌成肌细胞生长发育的调控作用,将let-7b过表达载体转染成肌细胞,结果发现let-7b对细胞增殖产生了明显影响。从mRNA的表达情况来看,与骨骼肌生长发育相关基因中,只有let-7b的靶基因IGF2BP3明显下调,而IGF2、IGF1的mRNA表达量则变动不大。与此同时,western blotting分析发现,IGF2BP3的蛋白质表达量也同步下降。ELISA分析发现,let-7b转染24 h时IGF2的蛋白质含量明显下调,36 h后恢复正常水平,推测let-7b可使IGF2BP3表达量下降,但对IGF2 mRNA的表达影响不大,它的影响主要是使IGF2蛋白质的转运效率降低,而且其影响会随时间的延长而逐渐下降;let-7b转染成肌细胞24 h后IGF1的表达量受到一定影响,36 h后则明显下调,但其作用机理尚不清楚。
研究表明,IGF2BP3是胰岛素样生长因子RNA结合蛋白家族中的一个重要成员,可以高度特异地与编码IGF2的mRNA结合,是一种能够与胰岛素样生长因子(IGFs)相结合的分泌性蛋白,参加RNA的运输、稳定、细胞的增殖和迁移[14-15]。IGF2BP3与IGFs结合能够调控IGFs与IGF2受体间的互相作用,改变其促有丝分裂效应,调节细胞的生长、分化、凋亡、黏附和运动[16]。IGF2(insulin-like growth factor 2)基因又称生长调节素A(somatomedin A),是动物生长轴上重要的因子,也是一种多功能细胞增殖调控因子,在细胞的分化、增殖,胚胎的生长发育以及肿瘤细胞中具有重要的作用。胰岛素样生长因子通过自分泌/旁分泌机制在禽类胚胎发育中发挥重要作用[17]。
综上可见,miRNA let-7b对鸡成肌细胞增殖效果的影响,主要是通过靶向调控IGF2BP3的mRNA表达,进而影响其蛋白质表水平。而IGF2BP3表达水平的下降,又进一步影响到IGF2的运输、稳定和迁移功能,从而影响成肌细胞的增殖。
4 结 论
通过let-7b过表达载体转染DF-1细胞进行双荧光素酶靶标验证,证明miRNA let-7b对IGF2BP3基因具有靶向调控作用。进一步分析表明,miRNA let-7b主要是通过靶向调控IGF2BP3的mRNA和蛋白质表达水平,并进一步影响IGF2的运输、稳定和迁移功能而影响成肌细胞的增殖。
[1] ZHAO Yong, SAMAL E, SRIVASTAVA D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature, 2005, 436(748): 214-220.
[2] CHEN Jian-fu, MANDEL E M, THOMSON J M, et al. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J]. Nature Genetics, 2006, 38(2): 228-233.
[3] RAO P K, KUMAR R M, FARKHONDEH M, et al. Myogenic factors that regulate expression of muscle-specific microRNAs[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(23): 8 721-8 726.
[4] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[5] LEE R C, FEINBAUM R L, AMBROS V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5): 843-854.
[6] REINHART B J, SIACK F J, BASSON M, et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans[J].Nature, 2000,403(6772):901-906.
[7] LIN Shumao, LI Hongmei, MU Heping, et al. Let-7b regulates the expression of the growth hormone receptor gene in deletion-type dwarf chickens[J]. BMC Genomics, 2012,13:306.
[8] NIELSEN F C, NIELSEN J, KRISTENSEN M A, et al. Cytoplasmic trafficking of IGF-II mRNA-binding protein by conserved KH domains[J]. Journal of Cell Science, 2002, 115(10): 2 087-2 097.
[9] 张丽. 鸡GHR 基因天然反义链转录本功能研究[D].广州:华南农业大学,2016.
[10] 曾四平.MTT法测定 mir-129对肾癌细胞 SN12-PM6生长曲线影响的实验研究[J].齐齐哈尔医学院学报,2014(20):2 965-2 966.
[11] DEFORZH E, VARGAS T R, KROPP J, et al. IMP-3 protects the mRNAs of cyclins D1 and D3 from GW182/AGO2-dependent translational repression[J]. International Journal of Oncology, 2016, 49(6): 2 578-2 588.
[12] ZHOU Yuhang, HUANG Tingting, SIU H L, et al. IGF2BP3 functions as a potential oncogene and is a crucial target of miR-34a in gastric carcinogenesis[J]. Molecular Cancer, 2017, 16(1): 77.
[13] JOHNSON B, KHALIL M, BLANSFIELD J, et al. Investigating the prognostic value of KOC (K homology domain containing protein overexpressed in cancer) overexpression after curative intent resection of pancreatic ductal adenocarcinoma[J]. Journal of Gastrointestinal Oncology, 2016, 7(6):113-117.
[14] NIELSEN J, CHRISTIANSEN J, LYKKE-ANDERSEN J, et al. A family of insulin-like growth factor II mRNA-binding proteins represses translation in late development[J]. Molecular and Cellular Biology, 1999, 19(2): 1 262-1 270.
[15] NIELSEN F C, NIELSEN J, CHRISTIANSEN J. A family of IGF-II mRNA binding proteins (IMP) involved in RNA trafficking[J]. Scandinavian Journal of Clinical and Laboratory Investigation. Supplementum, 2001, 234: 93-99.
[16] BELL J L, WACHTER K, MUHLECK B, et al. Insulin-like growth factor 2 mRNA-binding proteins (IGF2BPs): post-transcriptional drivers of cancer progression?[J]. Cellular and Molecular Life Sciences : CMLS, 2013, 70(15):2 657-2 675.
[17] LIU Yanli, GUO Wei, PU Zhenyu, et al. Developmental changes of Insulin-like growth factors in the liver and muscle of chick embryos[J]. Poultry Science, 2016, 95(6): 1 396-1 402.

