1 例死亡克隆牛主要脏器组织学观察及胎盘印记基因甲基化水平分析
马 馨, 张 胜, 朱屹然, 马盼盼, 杨树宝, 栾维民, 李子义
(1. 吉林农业大学动物科学技术学院, 吉林 长春130118 ;2. 吉林大学第一医院, 吉林 长春130062)
“多莉”的诞生不仅打破了生命科学中动物已分化细胞不具有发育全能性的传统概念,而且由此诞生的体细胞核移植(SCNT)技术也展示出了巨大的应用前景,它为家畜良种选育、转基因动物生产、濒危动物保护、细胞衰老分化机理等研究提供了新的技术手段。 迄今为止,应用体细胞核移植技术已相继诞生牛、小鼠、猪、兔等10 余种克隆动物。 但是,目前SCNT 技术成功率仍然很低,绝大多数克隆胚胎的胎盘都会出现发育异常,如胎盘增生、胎盘血管缺陷、脐带畸形等[1],并由此引发胎儿各器官出现发育缺陷。 因此,胎盘发育异常是造成克隆胚胎妊娠失败的主要原因之一。
基因组印记是双亲基因组的一种差异表观修饰机制,通过印记位点被差异甲基化区域(DMRs)标记,使父系或母系的等位基因出现单等位表达,其对于胎盘的发育,胎儿的生长具有重要调控作用[2]。 现已发现在克隆牛[3]、猪[4]、羊[5]等动物胎盘中,多个印记基因mRNA 表达及DNA 甲基化水
平出现异常。 克隆动物中,一些与胎盘生长相关的印记基因如H19、Peg3、Cdkn1 c 都出现了差异甲基化区域(DMRs)的异常甲基化状态。 克隆胚胎印记基因甲基化异常很可能是造成克隆动物胎盘发育异常的重要原因。 因此,本研究以1 例出生后3 h死亡的克隆牛胎盘为研究对象,运用组织学方法对该克隆牛主要内脏器官进行形态学观察,并利用亚硫酸氢盐测序分析胎盘中印记基因H19、Peg-10 及Snrpn 的甲基化状态,以期为提高体细胞核移植效率提供基础实验数据。
1 材料与方法
1.1 克隆牛 本研究所选克隆牛取自吉林大学牛场。
1.2 主要内脏器官的组织取材、固定及石蜡切片制备(H. E. 染色) 取死亡克隆牛心、肝、脾、肺和肾组织,修整后放入10%甲醛中浸渍固定,常规石蜡包埋切片,H. E. 染色。
1.3 胎盘组织的亚硫酸氢盐测序分析(BSP)
1.3.1 基因组DNA 的提取及亚硫酸氢盐处理 利用动物组织基因组DNA 提取试剂盒(TianGen)提取基因组DNA,每个样品取50 ng 左右基因组DNA,用甲基化试剂盒(ZYMO)进行亚硫酸氢盐处理,并用于PCR 反应。
1.3.2 H19、Snrpn 及Peg-10 差异甲基化区域(DMRs)的甲基化PCR 扩增 根据牛H19、Snrpn 及Peg-10 DMRs 序列,设计甲基化PCR 引物(表1)。

表1 牛H19、Snrpn 及Peg-10 甲基化PCR 引物序列
PCR 反应体系为25 μL,包括0.125 μL Taq DNA 聚合酶(Ex Taq, TaKaRa),2 μL DNTP,上下游引物各1 μL,1 μL 亚硫酸氢盐处理后的基因组DNA,剩余体积用水补平。 扩增程序为: 94 ℃预变性4 min,变性后加Ex Taq DNA 聚合酶,94 ℃30 s,52 ℃40 s,72 ℃30 s,共45 个循环;72 ℃7 min;4 ℃保存。 DNA 回收试剂盒(TianGen)回收目的片段,将回收的DNA 用于BSP 研究。
1.3.3 BSP 测序 胶回收产物与pMD18-T 载体(TaKaRa)连接2 h,转化涂板后每个胶回收产物挑取15 个阳性单克隆送上海生工生物工程技术服务有限公司测序。
2 结果与分析
2.1 死亡克隆牛主要内脏器官形态学观察 该克隆牛出生时便表现出明显异常,母牛妊娠时腹部过大,生产时羊水过多,胎盘增生明显并伴有充血,子宫阜的数量比正常受精胚胎显著减少。 出生后,无法站立,生后3 h 死亡。 剖检主要表现为:心脏和肝脏体积偏大,肝脏形态颜色较为正常,但局部呈现黄色,肺膨胀不全并有较多脂肪覆盖,脾脏呈灰白色且被膜增厚,两侧肾脏大小及形态未见明显异常。 对该克隆牛主要内脏器官制作组织切片并进行组织学观察,结果表明,克隆牛心肌纤维拉长变细排列欠规则,横纹不明显,部分核着色深呈固缩状态(见中插彩版图1A);肝脏,各肝小叶间界限不清晰,部分肝细胞索紊乱、断裂,肝细胞胞浆出现较多蛋白颗粒,并有大小不等的空泡,肝细胞核亦发生固缩,肝血窦增大,血窦中及被膜下有大量淋巴细胞浸润(见中插彩版图1B);脾脏被膜增厚,被膜向实质延伸形成小梁,小梁结构明显,由致密结缔组织组成并含有平滑肌,实质中红髓与白髓分界不清晰,未见明显脾小体,实质中红髓与白髓分界不清晰,红髓中脾索脾窦均不明显(见中插彩版图1 C);肺脏的各级毛细血管均发生扩张充血,部分肺泡腔可见红细胞,肺泡壁发生断裂,肺泡隔增厚,肺泡上皮细胞变为立方形(见中插彩版图1D);光镜下观察肾脏组织结构基本正常,肾小体清晰可见(见中插彩版图1E)。
2.2 转基因克隆牛胎盘印记基因H19、Snrpn 及Peg-10 DMRs 甲基化分析 以亚硫酸氢盐处理后的基因组DNA 为模板扩增H19、Snrpn 及Peg-10 的差异甲基化区域(DMRs),回收目的条带,连接T 载体,并利用T 载体多克隆位点两端引物做菌液PCR筛选大小正确的克隆,送上海生工生物工程技术服务有限公司测序,利用BiQ analyzer 分析序列甲基化水平。 克隆牛胎盘印记基因H19、Snrpn 及Peg-10 甲基化水平如图2,转基因克隆牛胎盘印记基因H19 及Peg-10 的甲基化水平分别为84.6%和88.6%,显著高于50%,出现超甲基化状态。 印记基因Snrpn 的甲基化水平为67.8%,也出现升高趋势。
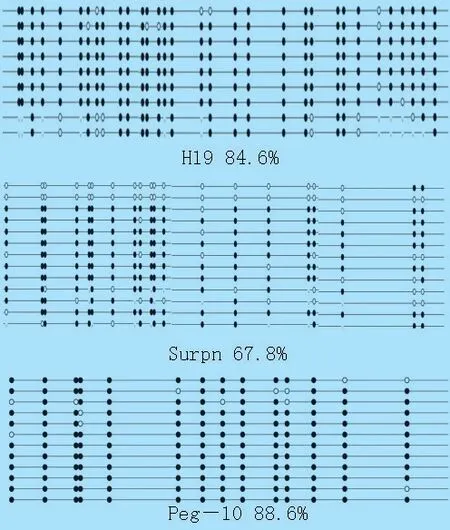
图2 胎盘中印记基因H19、Snrpn 及Peg-10 DMRs甲基化水平分析
3 讨论
胎盘发育异常是克隆动物流产、死亡及克隆效率低的主要原因[6],研究报道,印记基因对于胚胎及胎盘的发育非常重要。 因此,为确定印记基因表观修饰与克隆胚胎过度生长及胎盘异常发育之间的联系,本研究利用亚硫酸氢盐测序的方法,对一例出生后3 h 死亡的转基因克隆牛的主要内脏器官组织形态及胎盘印记基因H19、Peg10 及Snrpn DMRs 的甲基化状态进行分析。 结果表明,出生后死亡的克隆牛主要内脏器官均不同程度出现病理变化,胎盘H19 及Peg10 甲基化水平显著升高,Snrpn 的甲基化水平与正常胎盘相比虽有升高,但差异不显著。
出生后死亡的克隆牛胎盘中H19 及Peg-10 DMRs 出现了迷乱的超甲基化状态,这种超甲基化,可能引起基因表达抑制,使其表达量降低。 Su 等对转基因克隆牛的胎盘印迹基因的甲基化模式进行分析,发现H19 的差异甲基化区域出现高度甲基化[7]。 Wei 等报道产后死亡克隆猪胎盘的Igf2 的DMR2 以及H19 的DMRs 出现超甲基化[4]。 Peg-10是母源印记基因,由Ono R 等2001 年首次报道[8],该基因主要在成年动物脑、肾脏、肺脏中表达,并且在胚胎组织及胎盘中高度表达[9]。 该基因参与调控胎盘形成以及滋养层分化,并且在细胞增殖分化凋亡过程中发挥重要作用[10-11]。 Liu 等从流产的4个克隆牛胚胎中检测了Peg3 、Peg10 等印记基因甲基化的表达情况,发现Peg3 、Peg10 等基因都出现了不同程度的甲基化异常现象[12],这些结果与本研究的结果相吻合,本研究结果也显示母系印记基因Peg-10 甲基化水平显著升高。 印记基因甲基化模式的改变与胎儿及胎盘的发育调控密切相关[13]。印记基因通过调控胎盘的生长进而影响母体和胎儿之间的物质交换最终影响胎儿的生长。
本研究观察到克隆牛心肌纤维拉长变细,横纹不明显。 肝小叶界限不清晰,部分肝细胞索紊乱,血窦中及被膜下有大量淋巴细胞浸润。 肺脏的病理变化最为明显,其各级毛细血管均发生扩张充血,部分肺泡腔可见红细胞,壁发生断裂,这与袁苏娅[14]等对克隆牛肺脏的病理组织学分析结果一致。本研究中光镜下观察肾脏组织结构基本正常,而袁苏娅等观察到了肾脏的病理变化。 这种差异的原因可能是,肾脏发育相关基因表达异常或印记异常的胚胎细胞随机分化为滋养层,而未参与内细胞团的形成,因此,虽然胎盘发育异常并伴有相关基因的印记异常,但是胚体肾脏的发育并未受到显著影响,这也是少数克隆动物能够成功诞生并健康成长的原因[15]。
总之,在出生后3 h 死亡的克隆牛胎盘中,我们观察到了父源印记基因H19 及母源印记基因Peg-10 DMRs 的超甲基化。 印记基因表达异常导致胎盘发育异常,进而影响克隆牛胎儿发育。 因此,推测SCNT 过程影响了供核细胞的表观重编程,导致了H19 及Peg-10 迷乱的DNA 甲基化状态,最终引起胎儿及胎盘发育异常,同时也让我们进一步认识到了印记基因正确表观重编程在胚胎发育过程中的重要作用。

