鹅小肠肠球菌的分离鉴定
张腾帅, 李巧玲, 贾青辉, 张召兴, 刘京国, 张艳英, 高 聪
(1.河北科技师范学院动物科技学院 河北省预防兽医学重点实验室, 河北 秦皇岛066600 ;2.北京农学院生物科学与工程学院, 北京 昌平102206)
小肠肠球菌属肠球菌属,是人类和动物肠道正常菌群的一部分,通常在引起腹腔和盆腔感染所分离的混合菌丝中发现,既往认为肠球菌是对动物无害的共栖菌,但近年研究已证实了肠球菌的致病力[1]。 在需氧革兰阳性球菌中,它是仅次于葡萄球菌重要的院内感染致病菌,肠球菌亦可引起外感染。 肠球菌不仅可引起尿路感染、皮肤软组织感染,还可引起危及生命的腹腔感染、败血症、心内膜炎和脑膜炎等[2-3]。
河北省秦皇岛昌黎某鹅场的20 日龄左右雏鹅发生一起以精神沉郁、厌食、关节肿大为主要临床表现的疾病。 感染率高,出现症状3 d 左右死亡。为了鉴定引起鹅发病的病原菌,通过细菌分离培养、生化特性分析和16s rRNA 基因序列分析以及雏鹅致病性试验,证实该雏鹅病由小肠肠球菌感染引起。 并通过药敏试验测定其耐药谱,为预防和控制该病流行提供参考依据。
1 材料
1.1 病料来源 河北省秦皇岛昌黎某鹅场,20 日龄的雏鹅出现了精神沉郁、厌食、关节肿大为主要临床表现,病死20 日龄左右雏鹅。 无菌采集病鹅肝脏、肿大关节渗出液等组织进行病原分离鉴定。
1.2 试剂和仪器 血琼脂基础培养基、普通琼脂培养基,均购自北京路桥技术有限责任公司;药敏纸片,购自北京天坛药物生物技术开发公司;革兰染色试剂,购自青岛博海生物技术有限公司;肠道菌鉴定试条,购自法国梅里埃(bioMerieuxsa)公司;DL-2 000 Marker、2 ×Mix,均购自康为世纪生物科技有限公司;常用的试剂和主要仪器由河北省预防兽医学重点实验室提供。
1.3 试验动物 7 日龄健康雏鹅10 只,购自昌黎某孵化场。
2 方法
2.1 病原菌分离与鉴定 对病鹅进行剖检,无菌采集肝脏、关节渗出液等器官组织,划线接种于绵羊鲜血琼脂培养基,37 ℃恒温培养12 ~18 h,选取圆形、较小、露珠样优势单个菌落接种于普通琼脂培养基上进行纯化培养,革兰染色镜检观察其形态学。
2.2 生化特性鉴定 取纯化培养的病原菌,调整菌液浓度为2 麦氏单位,加入到Rapid ID 32 STREP 生化鉴定试剂条中,37 ℃培养4 ~8 h 后,用ATB 细菌鉴定系统进行生化鉴定。
2.3 细菌的16S rRNA 基因序列和系统发育分析 取100 μL 无菌水于EP 管内,用接种环将培养基内细菌接种到EP 管内,煮沸5 min,12 000 r/min 离心2 min,取上清作为PCR 模板,-20 ℃保存。 以提取的分离菌株的基因组DNA 为模板,用16S rRNA 通用引物进行 PCR 扩增。 PCR 扩增反应体系(25 μL):预混物12.5 μL,ddH2O 9.5 μL,上、下游引物各0.5 μL,DNA 模板2.0 μL。 反应条件:95 ℃预变性3 min;94 ℃变性1min,55 ℃退火1 min,72 ℃延伸2 min,72 ℃中延伸6 min,共30 个循环。用1%琼脂糖凝胶检条带,将PCR 产物送生工生物工程(上海)股份有限公司测序,测序结果与Gen-Bank 数据库中登录基因序列进行同源性比较分析,构建系统发育树。
2.4 致病性试验 参考文献[4]、[5],将10 只健康7 日龄雏鹅分为2 组,每组5 只,将分离菌株接种营养肉汤中,37 ℃振摇培养12 h。 然后每只雏鹅注射0.2 mL(1 ×109CFU/mL ),对照组用同样的方法注射等量的无菌生理盐水。 接种12 h 后,观察7 d,记录每组雏鹅的发病及死亡情况,对死亡的雏鹅剖检后,无菌取其肝脏进行细菌分离与鉴定。
2.5 药敏试验 按照美国临床检验标准委员会(NCCLS)推荐的标准K-B 纸片法进行试验操作和结果判断。
3 结果分析
3.1 细菌的分离培养和形态学观察 分离菌株在绵羊鲜血琼脂平板培养上长出白色、湿润的露珠样圆形的小菌落;在普通琼脂培养基上长出灰白色、圆形、针尖大小的菌落;染色镜检可见,分离菌株为革兰阳性球菌,呈散在的链状的球菌(图1)。

图1 分离菌株革兰染色结果 (1 000 ×)
3.2 生化试验 用ATB 细菌鉴定系统对分离菌株进行检测,鉴定结果为小肠肠球菌(见表1),评定结果为99.3%。

表1 分离菌株生化特性鉴定结果
3.3 分离菌16S rRNA 测序与系统进化树的构建 对分离菌株(HQ150506)进行16S rRNA 基因的PCR 扩增,扩增出1 500 bp 左右大小的目的片段(见图2)。 将分离菌株测序后,在NCBI 网站进行BLAST 搜索比对,择取部分参考菌株,采用DNAStar生物软件进行系统发育分析,并构建系统进化树,分离菌株与小肠肠球菌关系较近聚为一支,分离菌株HQ150506 基因序列与参考菌株小肠肠球菌基因序列同源性在99.6% ~100%(见图3)。
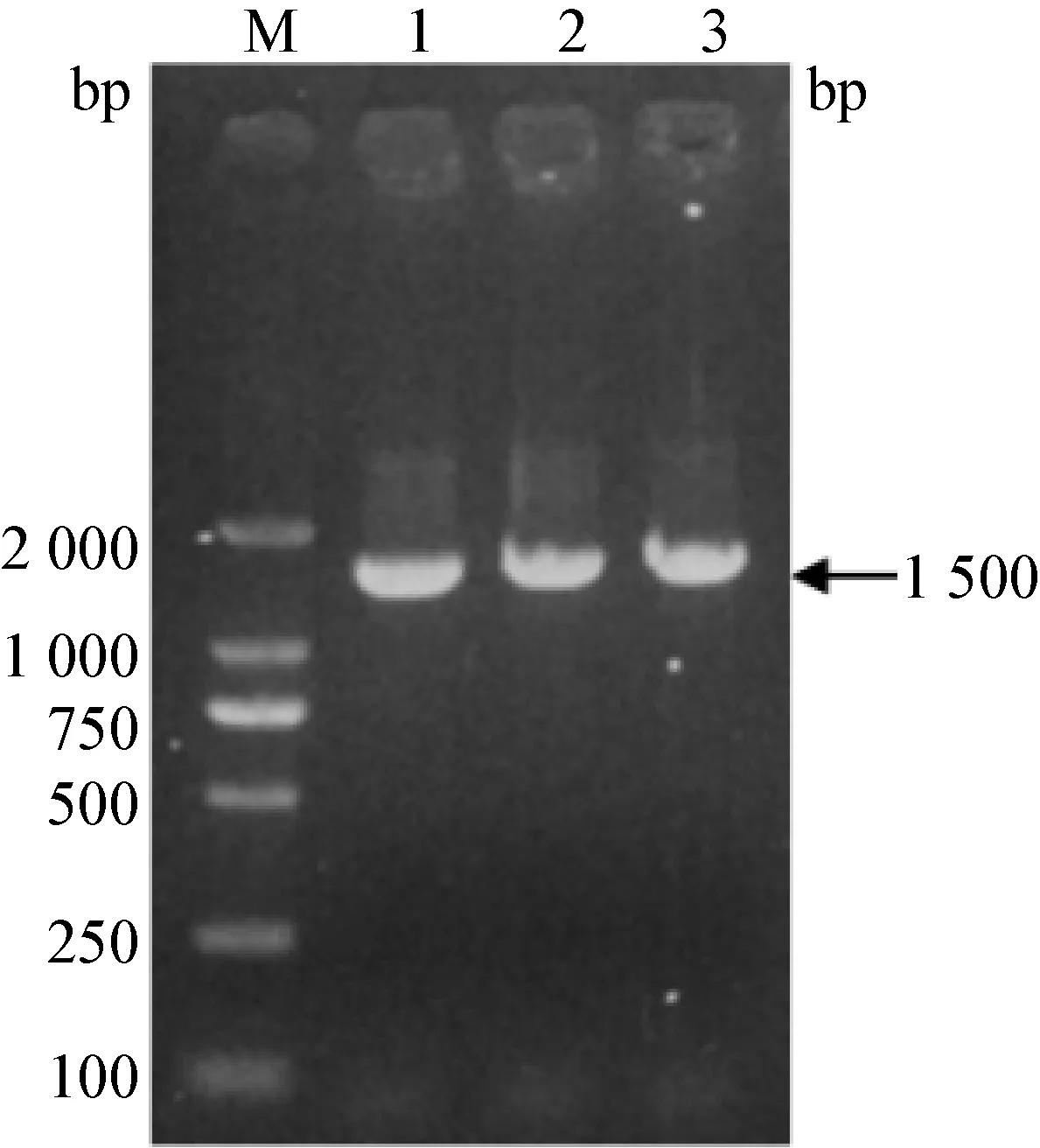
图2 分离菌株,6S rRNA PCR 结果
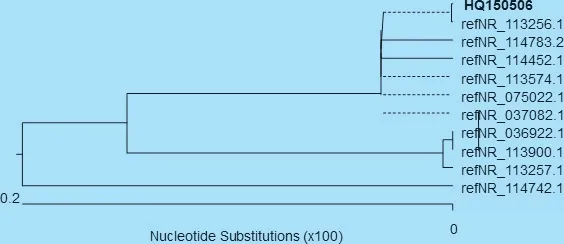
图3 分离菌株16S rRNA 基因序列系统发育树
3.4 致病性试验结果 试验组雏鹅在攻毒24 h后,雏鹅出现了背毛逆立,精神萎靡、厌食、关节肿大等现象,发病率为100%,剖检发病雏鹅,可见肝、脾肿大,肝表面有针尖大小的出血点,从雏鹅的肝脏和肿大关节处分离到小肠肠球菌。 对照组5 只雏鹅健康存活,因而证实分离菌具有很强的致病性。
3.5 药敏试验 由表2 结果显示,分离菌对庆大霉素、头孢唑林、青霉素、卡那霉素耐药;对氨苄西林、磷霉素、氟苯尼考、左氧氟沙星等抗菌药物敏感;对红霉素、大观霉素中敏。
4 讨论
肠球菌是近年来禽类养殖的常见疾病,危害极大。 唐晓丹等[6]、易爱玲等[7]研究发现小肠肠球菌属肠球菌属,是人类和动物肠道正常菌群的一部分,通常在引起腹腔和盆腔感染所分离的混合菌丝中发现,以前认为肠球菌是对人类无害的共栖菌,但近年研究已发现了肠球菌的致病力,因而对肠球菌的研究也愈发受到人们的重视。 为研究小肠肠球菌,本试验首先从患病鹅关节提取出优势致病菌。 经过菌体形态观察,生理生化特性鉴定,初步判断该致病菌为杆菌属,为证实所得结果,利用该菌16S rRNA 的基因序列并运用系统分子学进行同源性分析,进一步证明该菌为小肠肠球菌。 小肠肠球菌是禽类养殖的一种重要病原菌,极易引起幼年动物感染发病[8-9]。 在狄婷婷等“致鹅败血症粪肠球菌的分离与鉴定”中记述,小肠肠球菌可引起病禽精神沉郁、厌食、腹泻、关节肿大等症状[10]。 与本次试验病鹅病例症状一致。
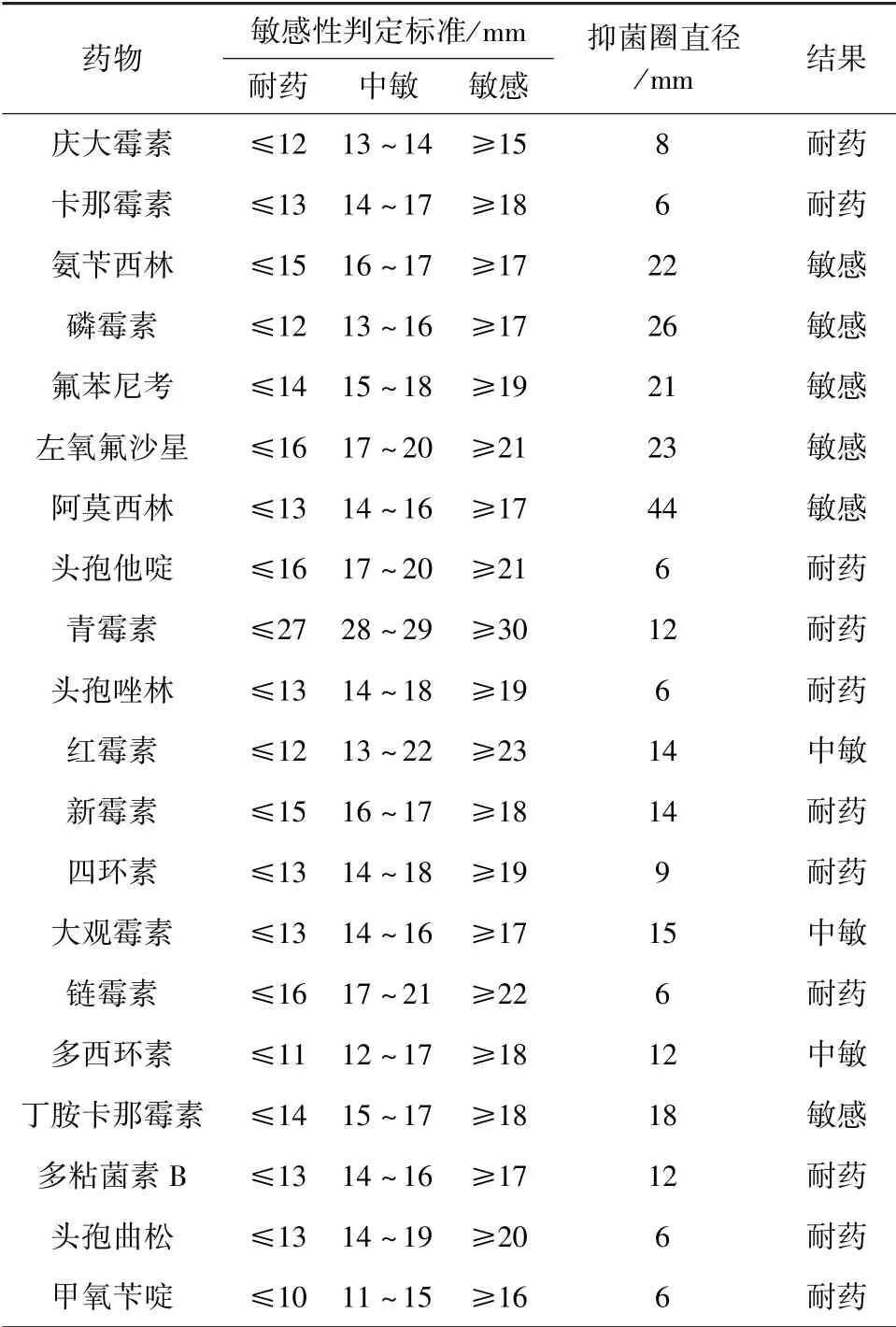
表2 药敏试验结果
肠球菌是条件致病菌,但近年来抗菌药物的广泛应用,使肠球菌对多种抗菌药物产生耐药,并成为导致感染的重要致病菌,为临床治疗带来了困难。 李春艳等人研究发现,在耐药菌株中氨基苷类高水平耐药菌株占了较大的比例,使得氨基苷类与作用于细胞壁的药物包括青霉素类、糖肽类的联合作用消失[11]。 张波等[12]对2012 -2015 年肠球菌属临床感染及耐药性变迁情况进行了研究,共检出肠球菌252 株,其中粪肠球菌148 株,屎肠球菌91株,鸟肠球菌6 株,铅黄肠球菌4 株,鹑鸡肠球菌2株,耐久肠球菌1 株,未检出鹅小肠肠球菌;粪肠球菌、屎肠球菌对于万古霉素耐药不同年份检出不同,并占有一定比率,且万古霉素耐药菌株近几年检出率呈下降趋势,其他肠球菌未检出万古霉素耐药株。 本次鹅小肠肠球菌药敏试验证明,该菌对氨苄西林、磷霉素、氟苯尼考、左氧氟沙星等抗菌药物敏感;对庆大霉素、头孢唑林、青霉素、卡那霉素等抗菌药物耐药。 故防治本病时需根据药敏试验结果进行科学用药。

