基于BSA法开发CAPS标记定位甜瓜果面沟相关基因研究
王学征,邱 果,陈克农,孙 慧,白 银
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺园林学院,哈尔滨 150030)
甜瓜(Cucumis melon.L)是葫芦科黄瓜属甜瓜亚属一年生草本植物,种质资源与变异类型丰富。目前,甜瓜果实性状、叶片性状、抗病性状等重要农艺学性状已有相关性分析与基因定位。
甜瓜果皮相关性状中,Obando等利用近等基因系与亲本比较发现,控制果皮颜色QTL数量至少为13个[1]。杨光华等以黄绿皮、白肉、无覆纹自交系K1-7为母本,黄皮、橘红肉、无覆纹自交系K3-92-1为父本杂交,构建F2代群体,采用复用鸟枪基因分型法(Multiplexed shotgun genotyping,MSG)对F2群体作基因分型,将果皮底色基因定位在4号染色体,在相同区域定位到一个与果皮覆纹有关基因[2]。周慧文以厚皮甜瓜品系M4-5为母本,薄皮M1-15为父本,构建F1和F2代群体,推测甜瓜外果皮类型性状为质量性状[3]。外果皮厚度分离存在超亲遗传现象,该性状为数量性状,将两个控制甜瓜果皮厚度QTL位点分别定位在第7和第11连锁群。在甜瓜果肉相关性状研究中,Monforte等通过F2代群体与双单倍体群体作QTL分析,将控制甜瓜绿色果肉基因定位在第1号连锁群,推测该基因与之前所记载gf基因吻合,控制橘红色果肉基因被定位在第2号连锁群和第12号连锁群上,推测控制该性状基因可能更复杂,需更大群体精细定位[4]。Cuevas等以甜瓜近等基因系群体为材料,初步定位到8个控制β-胡萝卜素QTL位点,分布在4条连锁群体上,解释该性状存在表型变异,发现控制甜瓜橘红果肉和白色果肉位点位于第9连锁群中部,该位点呼应双基因假说中wf基因[5]。Paris等在第2连锁群上定位甜瓜果肉厚度QTL位点,在CU160(10 cM)与OPAL9_750(34 cM)之间[6]。栾非时等以厚皮甜瓜M4-5为母本,M1-15为父本,杂交获得F1、F2代群体,定位到7个与果型指数相关QTL位点,分别位于第1连锁群、第2连锁群、第4连锁群(2个)、第7连锁群、第9连锁群和第10连锁群,采用不同试验群体研究性状,同样定位7个与果型指数相关QTL位点,并在第6连锁群上获得一个距离最小QTL位点[7-8]。甜瓜果实是否存在果面沟是甜瓜果皮类型呈现多样性因素之一。果面沟影响甜瓜果皮结构、物质积累、果实受力及甜瓜果实裂果。保证成熟甜瓜果实完整无损、无裂果,有利于甜瓜运输与贮藏,也是甜瓜遗传育种研究重点。因此,开展甜瓜果面沟性状遗传规律及相关基因定位研究,对甜瓜种质资源改良和加快分子育种进程具有重要意义。
现有测序方法难以准确检测生命体完整遗传信息,在分子遗传育种中遗传标记被广泛应用,CAPS标记又称酶切扩增多态性序列标记,广泛用于基因分型、定位、克隆和分子鉴定,该方法兼顾共显性和位点特异性,且操作简便,成本低廉[9]。CAPS主要对PCR扩增DNA片段限制性酶切分析,基于EST或已发表基因序列设计特异性引物,将特异性PCR与限制性酶切结合检测多态性[10]。基本原理是利用已知位点DNA序列设计一系列特异性PCR产物(19~27 bp),扩增该位点某一DNA片段,再用限制性内切酶切割扩增产物,利用凝胶电泳分离酶切片段,染色并RFLP分析。CAPS具有简洁解释个体多态性、可区分纯合基因型和杂合基因型、对所需DNA要求不高、扩增结果稳定、自动化程度高等优点[11]。
群体分离分析法(Bulked segregant analysis)即BSA法,是快速定位与目标基因连锁分子标记有效方法。原理是在F2代群体挑选两组性状极端值,建DNA混池,计算每个SNP位点SNP-index,将两个SNP-index作差计算ΔSNP-index,ΔSNP-index中显著偏离0位点为候选位点。BSA定位目标基因方法已广泛应用于作物育种,张云辉等用BSA法在第11号染色体上定位到2个与水稻条纹叶枯病抗性有明显关系的SSR分子标记[12]。李晓娜利用SSR分子标记结合BSA法在第3条染色体上定位到一个控制玉米雄穗穗颈长主效基因位点[13]。
本试验以无果面沟甜瓜品系M4-5为母本,有果面沟甜瓜品系M1-15为父本,通过杂交、回交以及自交获得 P1、P2、F1、F2、BC1P1、BC1P2六世代群体,分析果面沟遗传规律,并与裂果性状作相关性分析。在F2代群体内挑选有果面沟和无果面沟两个极端性状群体,BSA法确定控制该性状基因所在区域,再将该区域SNP位点转化为CAPS位点构建遗传图谱并定位目标基因,为进一步开展甜瓜果面沟性状基因克隆及种质资源创新提供理论依据。
1 材料与方法
1.1 田间试验材料
本试验选用厚皮甜瓜M4-5为母本材料,又称伊丽莎白瓜,隶属短毛甜瓜亚种,雄花两性花同株,中早熟品系,果皮黄色,光滑,无果面沟,果肉厚。选用薄皮甜瓜品系M1-15作为父本材料,隶属短毛甜瓜亚种,雄花两性花同株,早熟品系,果皮绿色,有果面沟,果肉薄。以上试验材料均由东北农业大学园艺园林学院西甜瓜分子育种实验室提供。利用双亲杂交配制六世代群体。
1.2 田间试验设计
2016年5~9月,在东北农业大学向阳实验实习基地大棚播种父母本、F1群体、BC1P1群体、BC1P2群体及 F2代群体。P1、P2、F1、BC1P1、BC1P2采用完全随即区组设计,各种植30株,每小区10株,3次重复,F2随机种植300株(保苗285株,实际收获282株)。2017年5~9月,在东北农业大学向阳实验实习基地大棚种植100株甜瓜自然群体。待果实成熟后收获所有群体果实,统计果面沟性状。田间管理采用埋土施肥、滴灌、双蔓整枝。田间布局如图1所示。

图1 田间布局Fig.1 Distribution in plastic greenhouse
1.3 果实性状调查方法
沿果实中轴横切,观察果肉外围是否凹陷,判断是否存在果面沟。观察是否裂果。
1.4 分子标记试验内容与方法
1.4.1 分子试验材料
选用M4-5和M1-15杂交、自交、回交产生六世代群体及甜瓜自然群体,采集幼嫩叶片,提取DNA备用。
1.4.2 DNA提取
采用改良CTAB法[14]提取双亲材料M4-5和M1-15、 F1、 BC1P1、 BC1P2、 F2群 体 和 甜 瓜 自 然 群 体DNA。提取过程中应用氯仿异戊醇溶液(24∶1)抽提3次,避免移液过程中枪头吸取蛋白质。
1.4.3 BSA法定位基因位点
在F2代群体中,各选出有果面沟和无果面沟20个果实组成两个池,将对应植株DNA稀释到华大基因所需浓度,自行混合成DNA池,华大基因作BSA定位。
1.4.4 CAPS分子标记开发
根据BSA结果图上显示基因位置,确定目标染色体。在该染色体上,参照已公布甜瓜基因组数据,利用东北农业大学园艺园林学院西甜瓜分子育种实验室自编Perl脚本选取SNP位点前后大约500 bp碱基序列,通过SNP2CAPS软件获得酶切位点处有差异候选序列,将SNP位点转化为CAPS标记。将目标染色体平均分成15等份,在每等份相同或相似位置上挑选CAPS位点,引物命名方式为:M+染色体序号+引物序号。CAPS分子标记加密时同样使用此方法,初定位两个标记间设计引物。
1.4.5 CAPS标记筛选与验证
采用降落式PCR反应对引物作PCR扩增,扩增体系为1 μL模板DNA 、0.1 μL Taq酶,、正反向引物各 0.5 μL、0.5 μL dNTP Mix、1 μL 10×PCR Buffer(缓冲液)和6.75 μL双蒸水。PCR扩增程序为:94℃预变性7 min、94℃变性1 min、60℃复性30 s、每个循环降低0.5℃、72℃延伸90 s、30个循环、72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测合格后,利用4种限制性核酸内切酶 Eco R I、Hind III、Bam H I、Pst I,分别对相应PCR产物酶切验证,体系为:5 μL PCR产物、0.3 μL限制性内切酶(浓度为10 U·mL-1)、1.5 mol·L-1Tango buffer(酶对应缓冲液)、8.2 μL 双蒸水,酶切反应置于37℃恒温水浴锅或37℃恒温箱中,确保酶切反应高效运行。酶切产物1%琼脂糖凝胶电泳检测。
1.5 遗传连锁图谱构建
利用QTL IciMapping对具有多态性且应用于F2代群体基因分型的分子标记绘制遗传连锁图谱,依据CAPS标记在染色体上编号及与连锁群对应关系,将连锁群命名为Chromosome+染色体序号。
1.6 目的基因定位方法
Microsoft®Excel 2007统计果面沟性状田间调查数据,SPSS 19.0软件作相关性分析,QTL IciMapping软件将其与分子数据相合对F2群体定位,采用复合区间作图法,以1.0 cM为步移单位在全基因组范围内扫描。
2 结果与分析
2.1 甜瓜果面沟性状遗传分析
母本M4-5田间表型均无果面沟,父本M1-15田间表型均有果面沟,F1代田间表型表现为均有果面沟,F2代群体产生性状分离,共种植300株F2代群体,由于环境原因,共收获282株甜瓜,其中有果面沟∶无果面沟比例为213∶69,基本符合3∶1遗传规律,BC1P1共收获30株果实,其中有果面沟∶无果面沟为18∶12,BC1P2共收获30株果实,所有果实表现均为有果面沟。可以推断,甜瓜果实果面沟性状为显性遗传,受一对基因调控。
2.2 甜瓜果面沟性状与裂果相关性分析
甜瓜母本M4-5为易裂果,父本M1-15为不易裂果甚至不裂果,在F1代表型中,大多果实不裂果,极小部分果实呈轻微裂果状,在F2群体中,不裂果与裂果数量比为206∶76,比值为2.7,趋于3∶1。因裂果受外界因素影响严重,无法判定该性状遗传规律。通过观测F2代果实,发现其他变量相同或相似时,有果面沟甜瓜多为不裂果,无果面沟甜瓜多为裂果。利用SPSS 19.0软件对果面沟与裂果性状作相关性分析,结果如表1所示,果面沟与裂果呈极显著负相关。

表1 果面沟与裂果相关性分析Table 1 Correlation analysis of surface groove and dehiscent fruit
2.3 甜瓜遗传连锁图谱构建
2.3.1 甜瓜试验材料DNA提取
利用改良CTAB法提取甜瓜基因组DNA,1%琼脂糖凝胶电泳检测,电泳结果见图2。经检测,双亲材料、F1、F2、BC1P1、BC1P2、自然群体(Natural population)DNA浓度和纯度均可用于分子标记检测,基本不含有RNA和蛋白质,极少量杂质对分子标记检测无影响。
2.3.2 BSA法定位结果
将有果面沟和无果面沟两个性状DNA混池送华大基因测序,获得一张BSA初定位结果图(见图3)。结果显示,第6号和第11号染色体具有明显波动峰值。推断控制果面沟基因位点可能存在于第6号或第11号染色体上。相比于第6号染色体,第11号染色体定位范围更小,峰值波动更大,目标基因在第11号染色体上存在可能性更大。
2.3.3 CAPS引物筛选与验证
根据双亲基因组重测序结果,第6号和第11号染色体各设计30对CAPS引物(将染色体基因组长度均分为15段,在每段切割位点或其近似地方各设计2对引物),用双亲及F1单株DNA对其作PCR反应和酶切验证。其中第6号染色体具有多态性引物24对(每段分割点及其相似位置处均保证有一个多态性引物),多态率为80%,第11号染色体具有多态性引物28对,多态率达93.3%,在上述结果中等区段分割处选出存在多态性引物15对。筛选多态性引物部分结果如图4所示。

图2 甜瓜试验材料DNAFig.2 DNA of test material in melon
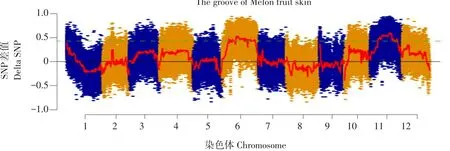
图3 甜瓜果面沟BSA分析结果Fig.3 BSA result of the surface groove in melon

图4 CAPS引物在P1、P2、F1代多态性表现Fig.4 Polymorphism of CAPS primers among P1,P2and F1generation
2.3.4 甜瓜遗传连锁图谱构建
以M4-5和M1-15为遗传研究背景,以含有282株单株F2代群体为绘图群体,以QTL IciMapping软件分别在第6号和第11号染色体上用15对具有多态性CAPS标记绘制一张甜瓜遗传连锁图谱。图谱结果显示,第6号染色体上未定位到与果面沟性状相关位点,因此排除控制果面沟基因位点在第6号染色体上可能性。利用CAPS标记分析第11号染色体,如图5所示,图谱长度为181.87 cM,共包含15对CAPS标记,定位到2个控制果面沟性状位点,其中一个qYG-1-1位点位于标记M11-5和M11-3之间,但是该位点所在位置与CAPS标记所在区域顺序不符,且分析数据表明该位点贡献率几乎为0,说明该位点存在错误。另一个位点为qYG-1-2,位于两标记M11-51和M11-53之间,两标记之间距离为3.42 cM。
为获得更近基因位点,在M11-51和M11-53标记之间平均设计10对引物,其中具有多态性为3对。用5对引物对该群体进一步构建CAPS标记遗传图谱,遗传图谱结果如图6所示。图谱覆盖长度为5 cM,定位到一个与果面沟性状有关位点,qGroove-1-1,位于CAPS标记M11-01与M11-51之间,两标记之间距离为1.1 cM,加性效应值为-0.2407,表明该基因位点对果面沟起反向加性效应。

图5 果面沟性状在11号染色体上的位点Fig.5 Locus of fruit surface groove on chromosome 11 in melon

图6 甜瓜果面沟性状在11号染色体上加密后位点Fig.6 Exact locus of fruit surface groove on chromosome 11 in melon
2.4 CAPS标记在自然群体中有效性检验
利用甜瓜自然群体对CAPS标记M11-01和M11-51作有效性检验,通过这两个标记对100株甜瓜自然群体PCR扩增和酶切分析显示,分子数据与田间性状符合率为74.67%和75.99%,结果表明果面沟性状可稳定遗传,上述2个CAPS标记可用于甜瓜果面沟分子标记辅助选择育种。
3 讨论与结论
3.1 利用BSA法定位基因优劣
BSA法最早用于抗病基因定位[15],随研究不断深入,BSA法逐渐应用于质量性状单基因或数量性状主效基因定位,仅由一对具有相对性状亲本杂交,其产生分离群体理论上适用于BSA法[16]。优点是可快速找到与目的基因紧密连锁分子标记,初步定位目标基因所在染色体,无需绘制全部基因组长度遗传连锁图谱,减少工作量,缩短工作时间。近年来,BSA方法已应用于黄瓜[17]、番茄[18]、甜瓜[19]等园艺植物,且成功定位部分目标基因。但该技术也有不足之处,无法精细定位基因区间,目标基因初步定位后还需进一步结合遗传图谱、分子标记或扩大群体等精细定位[20]。甜瓜果面沟性状由一对基因控制质量性状,因此可利用BSA法定位。本试验结果也证实BSA法无法将目标基因准确定位在具体某一位点[20]。本试验将控制甜瓜果面沟性状基因初定位在第11号染色体后半段,根据亲本重测序数据,在该区域开发CAPS标记,通过加密第11号染色体遗传图谱,最终将控制甜瓜果面沟性状基因定位在距离为1.1 cM两个CAPS标记之间。本研究中,BSA法同时将目标基因定位在两条染色体上,出现该结果可能是两个基因池间存在其他性状差异导致,因此,应用BSA法建立极端性状池时应考虑不同性状差异。
3.2 甜瓜果面沟性状调查方法
因为果面沟在F2果实中表型存在深浅差异,应沿果实中心轴横切,观察横截面判定果实是否具有果面沟。马双武认为果实表面存在条形覆纹处即是果面沟[21],但通过对F2群体调查过程发现,存在果实表面有条形覆纹但果皮光滑,无果面沟,说明果皮覆纹与果面沟之间并无必然联系。同一植株果实,果面沟也存在深浅不一情况,推断果面沟可能受其他因素(果实成熟度和坐果位置等)影响。
3.3 果面沟与裂果相关性分析
甜瓜果面沟性状与裂果呈显著负相关,说明存在果面沟甜瓜果实不易裂果,对于甜瓜采后贮藏与运输具有重要作用。但甜瓜是否裂果受环境影响较大,该性状可能由果面沟与其他环境因素共同导致,需在扩大群体并尽量保证其他因素一致前提下,深入研究确定两个性状间更准确相关性。
[1] Obando J,Fernández-Trujillo J P.Identification of melon fruit quality quantitative trait loci using near-isogenic lines[J].Journal of the American Society for Horticultural Science,2008,133(1):139-151.
[2] 杨光华,范荣,杨小锋,等.甜瓜果实颜色3个质量性状基因的定位[J].园艺学报,2014,41(5):898-906.
[3] 周慧文.甜瓜果实性状表型分析及其CAPS标记的研究[D].哈尔滨:东北农业大学,2016.
[4] Monforte A J,Oliver M,Gonzalo M J,et al.Identification of quantitative trait loci involved in fruit quality traits in melon(Cucumis melo L.)[J].Theortical and Applied Genetica,2004,108(4)∶750-758.
[5] Cuevas H E,Staub J E,Simon P W,et al.Mapping of genetic loci that regulate quantity of beta-carotene in fruit of US Western Shipping melon(Cucumis melo L.)[J].Theoretical and Applied Genetics,2008,117(8):1345-1359.
[6] Paris M K,Zalapa J E,Mccreight J D,et al.Genetic dissection of fruit quality components in melon(Cucumis melo L.)using a RIL population derived from exotic×elite US Western Shipping germplasm[J].Moleculat Breeding,2008,22(3):405-419.
[7] 栾非时,卢丙洋,周慧文,等.甜瓜遗传连锁图谱构建及果实相关性状QTL定位[J].东北农业大学学报,2016,47(8):9-20.
[8] 栾非时,矫士琦,盛云燕,等.甜瓜果实相关性状QTL分析[J].东北农业大学学报,2017,48(3):1-9.
[9] 束永俊,李勇,朱振雷,等.大豆CAPS标记快速开发方法的建立与优化[J].东北农业大学学报,2009,40(12):62-65.
[10] 赵雪,谢华,马荣才.植物功能基因组研究中出现的新型分子标记[J].中国生物工程杂志,2007,27(8):104-110.
[11] 邢延豪,周延清,楚素霞,等.CAPS标记技术及其应用进展[J].江苏农业科学,2011,39(5):74-76.
[12] 张云辉,张所兵,林静,等.利用BSA法检测水稻条纹叶枯病高效应抗性位点[J].华北农学报,2014,29(2):85-88.
[13] 李晓娜.玉米雄穗穗颈长QTL初步定位[D].沈阳:沈阳农业大学,2016.
[14] Luan F,Isabelle D,Jacke S.Chinese melon(Cucumis melo L.)diversity analyses provide strategies for germplasm curation,genetic improvement,and evidentiary support of domestication patterns[J].Euphytica,2008,164(2):445-461.
[15] Michelmore R W,Paran I,Kesseli R V.Identification of markers linked to disease-resistance segregant analysis:A rapid method to detect specific genomic regions by using segregating[J].Natl Acad Sci USA,1991,88(21):9828-9832.
[16] Chantret N,Sourdille P,Roder M,et al.Location and mapping of the powdery mildew resistance gene MIRE and detection of a resistance QTL by bulked segregant analysis(BSA)with microsatellitesin wheat[J].Theor Appl Genet,2000,100:1217-1224.
[17] Zhang P,Zhu Y Q,Lili Wang,et al.Mining candidate genes associated with powdery mildew resistance in cucumber via super-BSA by specific length amplified fragment(SLAF)sequencing[J].BMC Genomics,2015,16:1058-1072.
[18] Zhao T T,Jiang J B,Liu G,et al.Mapping and candidate gene screening of tomato Cladosporium fulvum-resistant gene Cf-19,based on high-throughput sequencing technology[J].BMC Plant Biology,2016,16:51-60.
[19] Zhang H,Yi H P,Wu M Z,et al.Mapping the flavor contributing traits on"Fengwei Melon"(Cucumis melo L.)chromosomes using parent resequencing and super bulked-segregant analysis[J].PLOS One,2016,11(2):1-24.
[20] 陈浣,夏菲,吴新儒,等.集群分离分析法在植物基因定位上的应用[J].基因组学与应用生物学,2016,35(6):1546-1551.
[21] 马双武.甜瓜种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.

