α-酮戊二酸对L-羟脯氨酸产量的影响
蔡萌萌,刘子强,户红通,陈 宁,2,3,徐庆阳,2,3*
(1.天津科技大学 生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457;3.天津市氨基酸高效绿色制造工程实验室,天津 300457)
L-羟脯氨酸是亚氨基酸L-脯氨酸羟基化后的产物[1],其存在于明胶、胶原、细胞壁蛋白质中[2],也存在于一些微生物的次级代谢产物中。L-羟脯氨酸作为一种稀有的亚氨基酸,在医药[3-5]、化工[6-8]、食品[9-10]和美容[11-13]等行业都具有广泛的应用。目前,生产L-羟脯氨酸的方法包括生物提取法、化学合成法和微生物发酵法,其中应用最广的生物提取法具有诸多弊端,正逐渐被市场淘汰[14],而微生物发酵法正以其原料来源广泛、成本低、工艺环保等优势迅速发展起来。
采用微生物发酵法生产L-羟脯氨酸时,L-脯氨酸在羟化酶的催化作用下生成L-羟脯氨酸,此过程需要Fe2+作为催化辅因子,同时需要α-酮戊二酸和氧气的参与[15],但是微生物细胞内合成的α-酮戊二酸含量有限,限制了L-羟脯氨酸的高效合成[16]。因此,本实验在L-羟脯氨酸发酵过程中外源添加α-酮戊二酸,通过改变α-酮戊二酸的添加量、添加时间和添加方式来探究α-酮戊二酸对L-羟脯氨酸发酵的影响,旨在提高L-羟脯氨酸产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
大肠杆菌(Escherichia coli)4HYP:由天津科技大学代谢工程研究室提供。
1.1.2 培养基
种子培养基:葡萄糖30 g/L,酵母粉6 g/L,(NH4)2SO41 g/L,KH2PO42 g/L,柠檬酸0.5 g/L,维生素B1(vitamin B1,VB1)1 mg/L,维生素H(vitamin H,VH)0.3 mg/L。
发酵培养基:葡萄糖10 g/L,酵母粉3 g/L,(NH4)2SO41 g/L,KH2PO44 g/L,柠檬酸0.5 g/L,MnSO4·H2O 10 mg/L,MgSO4·7H2O 1.5 g/L,FeSO4·7H2O 0.1 g/L,VB15 mg/L,VH 0.2 mg/L。
1.1.3 化学试剂
葡萄糖:西王药业有限公司邹平分公司;酵母粉:英国OXOID公司;(NH4)2SO4、KH2PO4、MgSO4·7H2O、NaOH、FeSO4·7H2O:天津市光复科技发展有限公司;柠檬酸、MnSO4·H2O、H2O2:国药集团化学试剂有限公司;L-羟脯氨酸:北京索莱宝科技有限公司;对二甲氨基苯甲醛:上海三爱思试剂有限公司;硫酸:天津化学试剂二厂。实验所用化学试剂均为分析纯或生化试剂。
1.2 仪器与设备
LRH-250-A生化培养箱:广东省医疗器械厂;5L离位灭菌发酵罐、30 L在位灭菌发酵罐:上海保兴生物设备工程有限公司;KQ-C型全自控蒸汽发生器:上海奉贤协新机电厂;V-1200型可见分光光度计:上海美谱达仪器有限公司;TG16-W微量台式高速离心机:湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 培养方法
摇瓶培养方法:在无菌条件下,用接种环划取一环斜面菌种至含有30 mL种子培养基的500 mL圆底三角瓶中,200 r/min、37℃培养10 h,然后按发酵培养基体积10%的接种量将菌液接种至含有30 mL发酵培养基的500 mL挡板三角瓶中,pH 7.0~7.2、37℃、200 r/min培养,发酵过程中以苯酚红作指示剂,当发酵液红色褪去时,补加体积分数25%的氨水溶液至红色出现,当发酵液长时间不变色时,补加1 mL 60 g/L的葡萄糖溶液维持发酵进行。
发酵罐培养方法:在无菌条件下,将活化的斜面菌种(1个250 mL茄形瓶)接种于含3 L种子培养基的5 L发酵罐中进行种子培养,pH 7.0~7.2、温度37℃、溶氧25%~30%,当OD600nm值为15左右时,以10%的接种量将其接种到30 L发酵罐中进行发酵,接种后发酵液体积为14 L,通过发酵罐自动控制温度37℃、pH 7.0~7.2,通过调节转速和通风量控制溶氧水平在25%~30%,当溶氧快速上升时说明培养基中葡萄糖耗尽,此时调节补糖脉冲比,自动流加80 g/L的葡萄糖溶液,发酵过程中每隔2 h取样检测并记录数据。
1.3.2 测定方法
pH值:pH值采用发酵罐连接的pH电极和精密pH试纸(6.4~8.0)测定;溶氧:采用发酵罐连接的溶氧电极。
菌体OD600nm值:将待测发酵液进行适当倍数的稀释,分光光度计测定波长600 nm处的吸光度值,将得到的吸光度值与稀释倍数相乘即为菌体OD600nm值。
L-羟脯氨酸含量测定[17]:取适量L-羟脯氨酸发酵液13 000 r/min离心2 min去除菌体,得到上清液,取20 μL于1 mL 5%H2O2溶液中,加入2滴1%CuSO4溶液和1 mL 10%NaOH溶液,混合均匀后呈现淡黄色,室温反应10 min至颜色消失且无气泡产生,加入1mL1%对二甲氨基苯甲醛硫酸溶液,混匀后沸水浴5 min,颜色由粉红色变为暗红色,冷却后加入10mL蒸馏水,混合均匀,于波长560nm处测定吸光度值,以同样的方法测定20 g/L的L-羟脯氨酸标准溶液的吸光度值,通过计算得到L-羟脯氨酸含量,其计算公式如下:

代谢流平衡模型的建立方法参照参考文献[17]。
2 结果与分析
2.1 α-酮戊二酸添加量对L-羟脯氨酸发酵的影响
为了考察不同α-酮戊二酸添加量对L-羟脯氨酸发酵的影响,通过摇瓶实验,在发酵培养基中分别添加0、1 g/L、2g/L、3g/L、4g/L、5g/L的α-酮戊二酸,每组设置3个平行,发酵24h后,菌体OD600nm值和L-羟脯氨酸产量情况如图1所示。
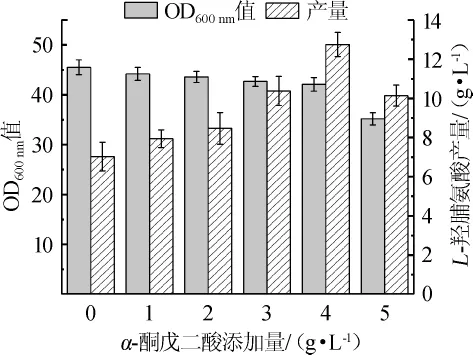
图1 不同α-酮戊二酸添加量对L-羟脯氨酸发酵的影响Fig.1 Effect of α-ketoglutarate addition on the fermentation of L-hydroxyproline
由图1可知,随着α-酮戊二酸添加量的增加,细菌的OD600nm值逐渐降低,当α-酮戊二酸添加量≤4 g/L时,菌体OD600nm值虽有减少,但减少的幅度并不显著,当添加量增加至5g/L时,菌体OD600nm值显著下降。当α-酮戊二酸添加量为0~4 g/L时,L-羟脯氨酸的产量随α-酮戊二酸的增加而逐步增加,且添加量在4g/L时,L-羟脯氨酸产量达到最大值12.75g/L,与未添加α-酮戊二酸的产量(7.03g/L)相比,提高了81.37%。这说明虽然α-酮戊二酸的添加会对菌体生长产生一定的抑制作用,但在一定范围内,外源添加α-酮戊二酸能有效缓解细胞内α-酮戊二酸含量不足的问题,使菌体高效合成L-羟脯氨酸。因此,α-酮戊二酸最适添加量为4 g/L。
2.2 α-酮戊二酸添加时间对L-羟脯氨酸发酵的影响
为了考察不同α-酮戊二酸添加时间对L-羟脯氨酸发酵的影响,分别在发酵0 h(培养基中)、6 h(发酵前期)、14 h(发酵中期)和22 h(发酵后期)加入4 g/Lα-酮戊二酸,同时以不添加α-酮戊二酸的发酵实验作为对照,发酵过程中菌体生长情况、L-羟脯氨酸产量及糖酸转化率如图2所示。
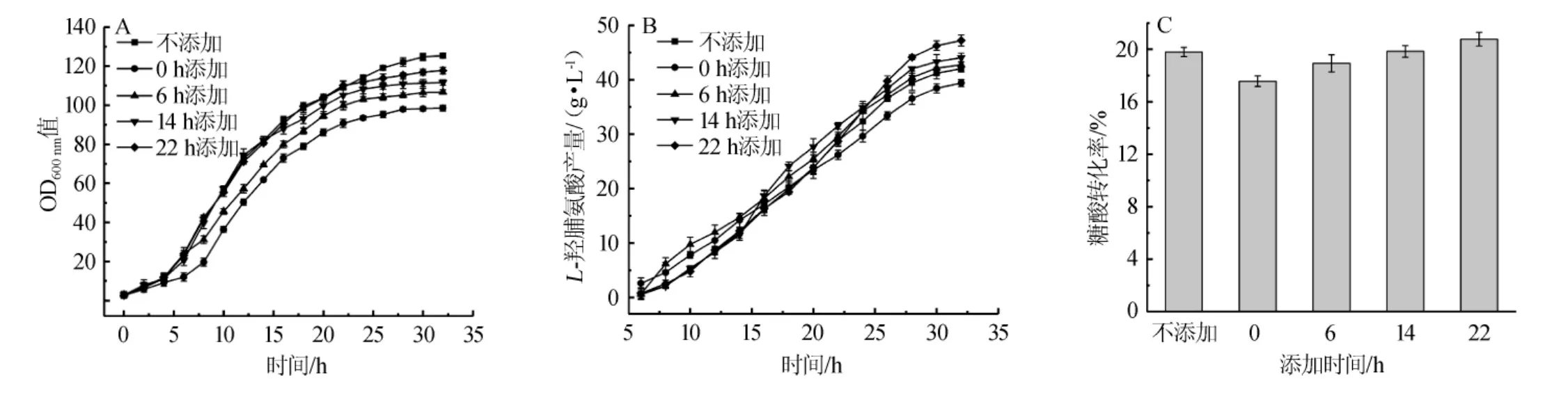
图2 不同α-酮戊二酸添加时间对菌体生长情况(A)、L-羟脯氨酸产量(B)及糖酸转化率(C)的影响Fig.2 Effects of different addition time of α-ketoglutarate on the cell growth(A),L-hydroxyproline yield(B)and glucose to acid conversion ratio(C)
由图2(A)可知,当0 h添加α-酮戊二酸时,菌体生长初期受到了严重的抑制作用,之后随着α-酮戊二酸的消耗,菌体生长速率基本恢复正常,但最终菌体OD600nm值只有98.5,与未添加α-酮戊二酸的菌体OD600nm值125.4相比,降低了27.31%;随着α-酮戊二酸添加时间的推移,菌体OD600nm值受到的影响逐渐减小,当22 h添加α-酮戊二酸时,菌体OD600nm值为117.7,与未添加α-酮戊二酸的OD600nm值相比,仅降低了6.79%。
由图2(B)可知,当外源添加α-酮戊二酸后,L-羟脯氨酸的产酸速率明显提高,随着α-酮戊二酸的消耗,产酸速率恢复常规水平,当发酵前期添加α-酮戊二酸时,虽然摇瓶实验中,L-羟脯氨酸的产量得到了明显提高,但在发酵罐中进行发酵时,L-羟脯氨酸的产量并未获得提升,这可能是由于前期菌体生长受到抑制,菌体总量较低导致的;当22 h添加α-酮戊二酸时,L-羟脯氨酸最终产量达47.21 g/L,与不添加α-酮戊二酸的产量42.03g/L相比,提高了12.32%。
由图2(C)可知,22h添加α-酮戊二酸时L-羟脯氨酸的糖酸转化率最高,达到20.77%,与不添加α-酮戊二酸的19.79%相比,提高了4.95%。
通过改变α-酮戊二酸的添加时间,L-羟脯氨酸的产量和糖酸转化率获得了一定程度的提高,但并没有达到理想水平,这可能是由于添加α-酮戊二酸时采用的是分批补料策略,即将其一次性加入发酵液中,导致了发酵液中α-酮戊二酸浓度瞬间升高,严重抑制了菌体生长,同时随着α-酮戊二酸的消耗,产酸速率未能一直维持较高水平,因此,接下来考虑采用连续补料策略进行L-羟脯氨酸的发酵。
2.3 α-酮戊二酸连续补料策略对L-羟脯氨酸发酵的影响
为了研究α-酮戊二酸连续补料策略对L-羟脯氨酸发酵的影响,分别添加3 g/L、4 g/L、5 g/L和6 g/L(初始发酵液)α-酮戊二酸溶液至糖溶液中,当发酵底糖耗尽时,使α-酮戊二酸随糖流加入发酵液,发酵过程中菌体生长情况、L-羟脯氨酸产量及糖酸转化率如图3所示。

图3 α-酮戊二酸连续补料策略对菌体生长情况(A)、L-羟脯氨酸产量(B)及糖酸转化率(C)的影响Fig.3 Effect of continuous feeding strategy of α-ketoglutarate on the cell growth(A),L-hydroxyproline yield(B)and glucose to acid conversion ratio(C)
由图3(A)可知,当随糖流加α-酮戊二酸的含量≤5 g/L时,对菌体生长没有太大影响,当随糖流加α-酮戊二酸含量增加至6 g/L时,菌体OD600nm显著下降。由图3(B)可知,菌体的产酸能力明显提高,且到发酵后期菌体依然保持较高活力,与分批补料策略相比,发酵时间延长了6 h,产量大大提高;在一定范围内,随着α-酮戊二酸流加浓度的增加,L-羟脯氨酸产量逐渐升高,当随糖流加α-酮戊二酸含量为5 g/L时,L-羟脯氨酸的产量最高,达62.14 g/L,与不添加α-酮戊二酸相比,提高了47.85%,与22 h时一次性加入α-酮戊二酸相比,提高了31.62%,但当随糖流加α-酮戊二酸含量>5 g/L之后,因α-酮戊二酸对菌体生长的影响使得产量未能继续提升。由图3(C)可知,当随糖流加α-酮戊二酸含为5 g/L时,L-羟脯氨酸发酵糖酸转化率达到最大值22.37%,与不添加α-酮戊二酸和22 h一次性加入α-酮戊二酸相比,分别提高了13.04%和7.70%。
2.4 α-酮戊二酸连续补料对L-羟脯氨酸代谢流的影响
根据L-羟脯氨酸发酵过程中菌体生长情况,假设22~28 h期间细胞处于拟稳态,检测该阶段发酵液中L-羟脯氨酸、葡萄糖、丙酮酸、乳酸、乙酸及赖氨酸的浓度,计算其积累或消耗速率,利用MATLAB软件计算分析,得到L-羟脯氨酸生物合成途径的代谢流分布情况,结果如图4所示。

图4 L-羟脯氨酸合成代谢流分布Fig.4 Synthetic metabolic flux distribution of L-hydroxyproline
由图4可知,当发酵过程中不添加α-酮戊二酸时,进入糖酵解途径(glycolytic pathway,EMP)的代谢流为58.01,进入磷酸戊糖途径(pentose phosphate pathway,HMP)的代谢流为41.99,从异柠檬酸(isocitric acid,ICI)进入乙醛酸循环和三羧酸循环(tricarboxylic acid cycle,TCA)的代谢流分别为3.69和147.43,主要副产物乙酸合成的代谢流为5.54,产物L-羟脯氨酸合成的代谢流为26.96,当随糖流加5 g/L α-酮戊二酸时,进入EMP途径的代谢流提高到53.60,进入HMP途径的代谢流下降为46.40,从ICI进入乙醛酸循环的代谢流为3.39,进入TCA循环的代谢流为145.26,同时,乙酸合成的代谢流(3.91)明显减少,L-羟脯氨酸合成的代谢流(30.19)显著增加,与不添加α-酮戊二酸的相比,L-羟脯氨酸合成的代谢流提高了11.98%,乙酸合成代谢流减少了29.42%。可见,α-酮戊二酸的加入可有效降低副产物乙酸的生成,使更多的代谢流流向L-羟脯氨酸的合成途径。
3 结论
菌体细胞内L-羟脯氨酸的合成需要α-酮戊二酸的参与,但往往细胞自身合成的α-酮戊二酸含量有限,不能满足需要,因此本研究通过在L-羟脯氨酸发酵过程中外源添加α-酮戊二酸来解决这一问题。实验结果表明,在L-羟脯氨酸发酵过程中,外源添加α-酮戊二酸能有效提高L-羟脯氨酸的产量和糖酸转化率,但α-酮戊二酸对菌体生长有一定的抑制作用,所以其添加浓度应该控制在一定范围内;当采用连续补料策略,使α-酮戊二酸随糖流加,质量浓度在5 g/L时,L-羟脯氨酸产量能够达到最大值62.14 g/L,糖酸转化率为22.37%,与不添加α-酮戊二酸相比,分别提高了47.85%、13.04%,同时,L-羟脯氨酸的合成代谢流提高了11.98%,副产物乙酸合成代谢流减少了29.42%。

