水开菲尔粒发酵香蕉皮过程中成分变化研究
翟苗苗,欧阳信,李梦茹,2,段 杉*
(1.华南农业大学 食品学院,广东 广州 510642;2.美国英狄士化学公司广州代表处,广东 广州 510000)
香蕉是热带亚热带地区大量种植的水果,香蕉皮通常被当作垃圾丢弃,这不仅污染环境还造成资源的浪费。其实,香蕉皮中除了含有大量的果胶、粗纤维等多糖成分外,还含有维生素C、多酚以及K、Ca、Mg、S、Fe、Zn等多种矿物质[1],此外,香蕉皮中还含有大量以糖苷形式存在的香气前体成分等,值得开发利用。
水开菲尔粒是由乳杆菌为主,包括醋酸菌和酵母菌在内的多种细菌和真菌共同构成的共生菌系,它们之间通过某些细菌分泌的多糖结合在一起形成颗粒[2]。世界上许多地区都有用水开菲尔粒发酵糖水、水果等制作饮料的习惯[3],这些饮料在发酵过程中会产生大量益生菌[4]、多糖、有机酸,具有抑制病原微生物[5]、抗炎[6]、提高免疫力[7]等功效。由于水开菲尔粒的菌系复杂,其发酵过程中可以产生多种多样的酶,对底物的水解作用更强,不仅能够水解多糖类成分,也可以水解以糖苷形式存在的风味前体成分,释放出诱人的果香,菌系自身也会产生复杂、协调的香气成分,并产生各种具有保健功效的次级代谢产物,保健作用更强,发酵剩余的粗纤维等不溶性沉淀成分则可以用于制作膳食纤维。近年来的研究大多是关于香蕉皮中的功能性成分的提取与利用,鲜见采用香蕉皮发酵制作饮料的相关文献。
本研究采用水开菲尔粒发酵香蕉皮,研究了发酵过程中各种成分的变化,旨在开发香蕉皮饮料,扩大香蕉皮的综合利用途径,提高香蕉深加工幅度,增加香蕉生产附加值,减少环境污染。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
香蕉皮、水开菲尔粒:市售;红糖:广东南字科技股份有限公司。
1.1.2 试剂
氢氧化钠:天津市大茂化学试剂厂;硫酸:广州市东红化工厂;酚酞:沈阳市试剂三厂;FL试剂(荧光素钠)、2,2'-偶氮二异丁基脒二盐酸盐(2,2'-azobis(2-methylpropi onamidine)dihydrochloride,AAPH)、Trolox(水溶性维生素):美国Sigma公司;磷酸氢二钾:汕头市光华化学厂;蛋白胨、酵母膏(均为生化试剂):广东环凯生物科技有限公司。实验所用试剂均为分析纯。
1.1.3 培养基
MRS培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、平板计数琼脂(plate count agar,PCA)培养基:广东环凯生物科技有限公司。
1.2 仪器与设备
PB-10 pH计:赛多利斯科学仪器(北京)有限公司;7890A-5975C气相色谱质谱联用仪:美国Agilent公司;101-1型电热鼓风干燥箱:上海沪南科学仪器有限公司;JA2003电子天平:上海精密科学仪器有限公司;RHB80糖度计:上海精科实业有限公司;DPX-9082B-2电热恒温培养箱:上海福玛实验设备公司。
1.3 方法
1.3.1 香蕉皮的发酵
将香蕉皮切成小块后打浆,打浆后的香蕉皮分为两份,一份在蒸锅内蒸15 min,破坏香蕉皮的组织结构,蒸煮后冷却待用,另一份不做任何处理;按红糖、香蕉皮、水、水开菲尔粒的质量比为1∶3∶10∶0.5发酵,其中,水开菲尔粒预先用无菌纱布包好,待用;红糖预先与水按1∶10的比例配制好,然后煮沸5 min灭菌,冷却。最后分别将上述两份香蕉皮浆、红糖水和水开菲尔粒混合,装入无菌三角瓶中,瓶口外覆8层纱布,置于28℃恒温培养箱静置发酵,至发酵液的pH不变时结束发酵。
采用烘干法测定香蕉皮发酵后剩余的沉淀物的干质量以及原料香蕉皮干质量,在105℃烘干至恒质量后,香蕉皮利用率计算公式如下:

1.3.2 分析检测
采用pH计测定pH值;采用糖度计测定糖度;滴定酸度的测定按照国标GB5009.239—2016[8]《食品酸度的测定》中的酚酞指示剂法;乙醇含量的测定按照国标GB/T 12143—2008《饮料通用分析方法》中的浓缩果汁中乙醇的测定方法[9]。抗氧化活性的测定按照续洁琨等[10]报道的氧化自由基吸收能力(oxygenradicalabsorbancecapacity,ORAC)法。分别按照国标GB 4789.2—2016《菌落总数测定方法》[11]、国标GB 4789.35—2016《乳酸菌检验》中的乳杆菌检验方法[12]、国标GB 4789.15—2016《霉菌和酵母计数方法》[13]检测菌落总数、乳杆菌数量和真菌数量。
1.3.3 香蕉皮原料及发酵产物挥发性风味成分的测定
采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法测定香蕉皮原料及发酵液挥发性成分。
(1)挥发性气体成分的收集
采用顶空固相微萃取(headspace solid-phase microextraction,HP-SPME)法收集挥发性气体成分,取10 mL未煮和煮过的香蕉皮发酵液分别置于萃取瓶中,萃取头的材料型号为PDMA/DVB,将萃取头插入萃取瓶中,使之悬空,萃取温度45℃,萃取时间30 min,解吸时间15 min。在设定的条件下萃取得到挥发性气体成分。
(2)香气成分的测定
气相色谱条件:DB-5色谱柱(30 m×0.25 nm×0.25 μm),载气为氦气(He),流速1.0mL/min,不分流进样,恒压35kPa,炉温45℃,进样口温度250℃,起始温度为35℃,保持5 min,后以3℃/min升温至225℃,保持10 min。
质谱条件:离子源温度230℃,电离方式电子电离(electronic ionization,EI),电子能量70 eV,灯丝电流150 μA,扫描质谱范围33~450 amu。
定性定量方法:样品经过气相色谱分离后,利用安捷伦质谱处理系统结合美国国家标准技术研究所(national institute of standards and technology,NIST)11标准质谱库对总离子流色谱图中各峰进行检索,确定每个峰对应的化合物,并用峰面积归一法计算各化合物的相对含量。
2 结果与分析
2.1 香蕉皮发酵过程中的pH值和糖度变化
香蕉皮发酵过程中的pH值和糖度变化如图1所示。
由图1A可知,香蕉皮是否经过蒸煮对发酵过程的pH值没有影响,在0~48 h之间煮过和未煮过的香蕉皮发酵液的pH值下降迅速,从初始的5.47分别下降至3.90和3.87;之后二者下降很缓慢,到发酵结束时分别为3.53和3.51。
由图1B可知,蒸煮香蕉皮发酵液的糖度高于未蒸煮的,发酵结束时二者的糖度分别为2.7%和2.2%。推测香蕉皮煮过后组织结构被破坏,所含多糖等成分更易被水解释放到发酵液中,导致蒸煮香蕉皮发酵液的糖度更高。发酵液的糖度也是在0~48 h之间迅速下降,此后变化较小。结合图1A可知,在0~48 h之间糖度变化与pH变化同步。水开菲尔粒中的微生物主要是各种乳杆菌,还有一些醋酸菌和酵母菌,乳杆菌会将大量糖类转化为乳酸,一些乳酸菌还会利用环境中的糖合成构成开菲尔粒的多糖;酵母菌会将部分糖转化为乙醇,醋酸菌则将乙醇进一步转化为乙酸。推测在此时间范围内糖度迅速下降可能是由于微生物的代谢活动旺盛,大量产生乳酸、乙酸等有机酸以及少量乙醇和多糖。到了发酵的中后期,糖度的变化较小,而pH持续缓慢下降,推测这是因为发酵初期产生的大量有机酸导致环境pH显著下降,微生物的代谢活动被大大抑制,产生有机酸的速度大大降低所致;而糖度变化较小推测可能是由于一方面微生物消耗糖的速度大大降低,另一方面香蕉皮中的果胶等多糖类物质在发酵过程中缓慢发生水解,释放出低分子糖类,这样糖的消耗和产生基本持平。
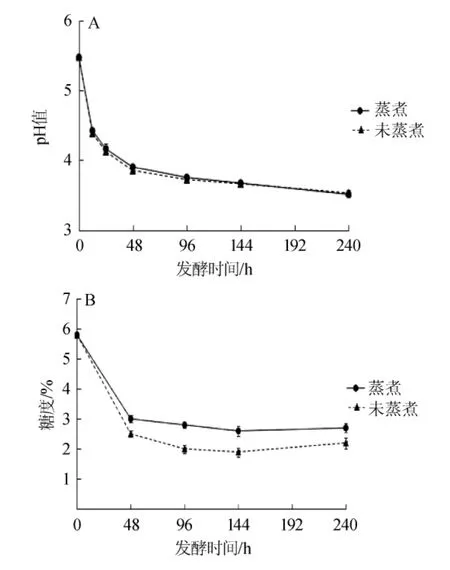
图1 香蕉皮发酵过程中的pH值(A)和糖度(B)变化Fig.1 Changes of pH value(A)and sugar contents(B)in banana peel during fermentation process
2.2 香蕉皮发酵液的成分分析
香蕉皮经240 h发酵后,测定香蕉皮的利用率,并分析发酵液中各种成分含量,结果如表1所示。微生物指标测定结果见表2。
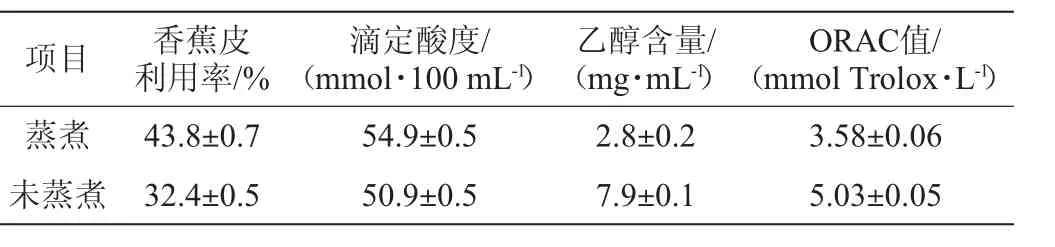
表1 香蕉皮利用率及发酵液的各种成分含量测定结果Table 1 Determination results of utilization rates of banana peel and the contents of various ingredients in fermentation broth
由表1可知,蒸煮香蕉皮利用率为43.8%,未蒸煮香蕉皮利用率为32.4%,可能是由于经过蒸煮香蕉皮中的多糖、果胶等被释放出来,更易于被细菌和真菌利用。蒸煮香蕉皮发酵液的滴定酸度为54.9mmol/100mL,未蒸煮香蕉皮为50.9 mmol/100 mL,相差不大;蒸煮香蕉皮发酵液中乙醇含量为2.8 mg/mL,低于未蒸煮香蕉皮7.9 mg/mL。
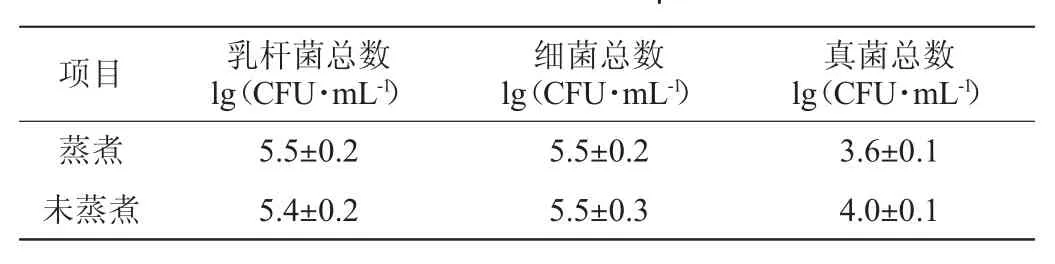
表2 香蕉皮发酵液的微生物指标测定结果Table 2 Determination results of microbiological indexes in fermentation broth of banana peel
由表2可知,二者的乳杆菌和细菌总数相差不大均在5.4~5.5 lg(CFU/mL)左右,而蒸煮香蕉皮发酵液中真菌数为3.6 lg(CFU/mL),低于未蒸煮的4.0 lg(CFU/mL),水开菲尔粒发酵液中的真菌为酵母菌,故推测可能是由于蒸煮香蕉皮发酵液中酵母菌数量较少,导致产生的乙醇较少。乳杆菌数与细菌菌落总数基本一致,可见在发酵液的微生物中乳杆菌占绝对优势,这与CORONAO等[14]的研究结果一致。
ORAC值反映抗氧化活性的强弱,蒸煮香蕉皮发酵液的ORAC值为3.58mmolTrolox/L,低于未蒸煮香蕉皮5.03mmol Trolox/L,推测这是因为在蒸煮过程中香蕉皮原料中的天然抗氧化成分有所破坏导致,但仍有一定的抗氧化活性。
2.3 香蕉皮中挥发性成分分析
对香蕉皮原料及其发酵液的挥发性成分进行了分析,结果如表3所示。
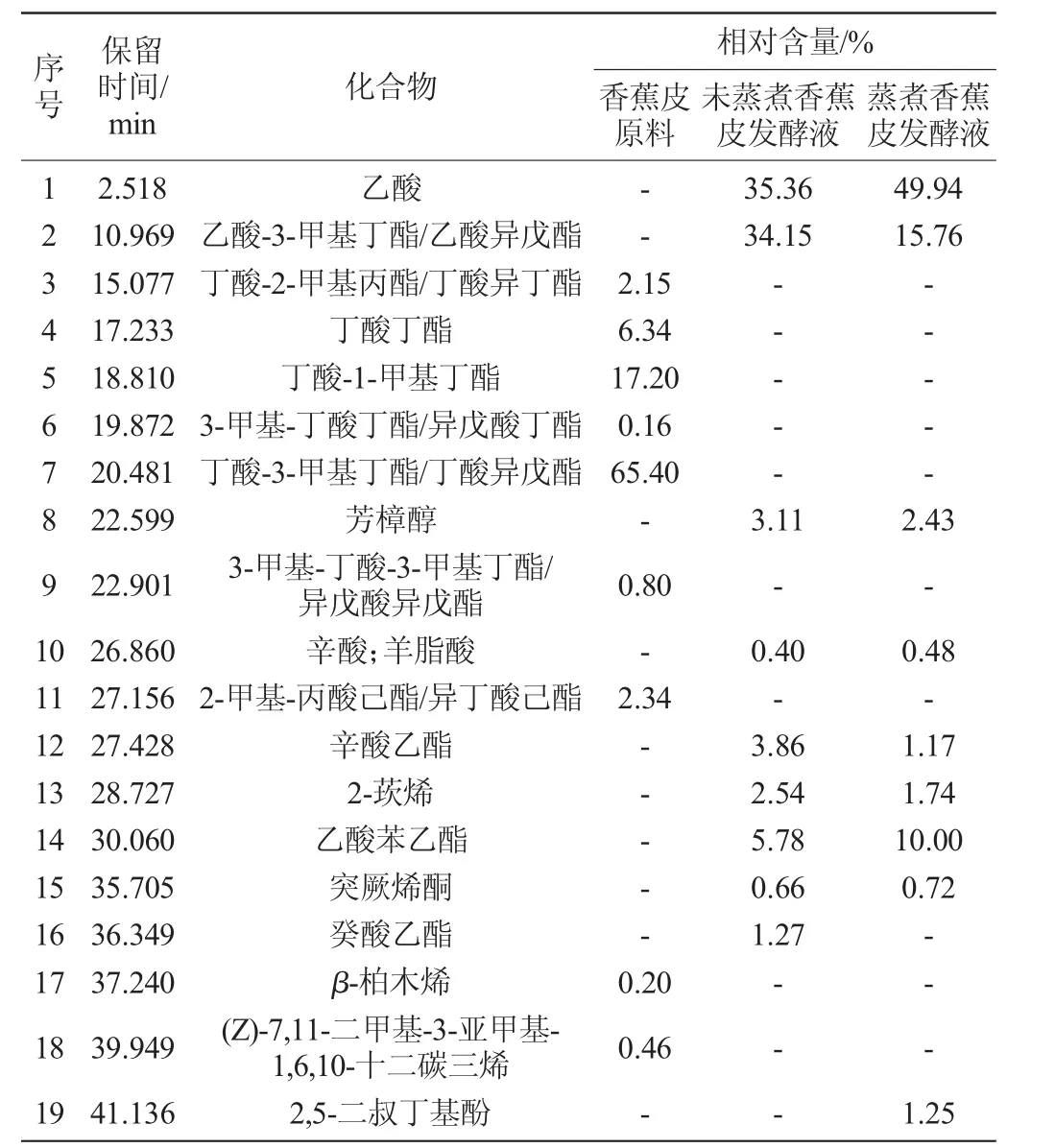
表3 香蕉皮原料及其发酵液中的挥发性成分GC-MS分析Table 3 GC-MS analysis of volatile components in banana peel and its fermentation broth
由表3可知,从香蕉皮原料中共鉴定9种挥发性成分,分别为丁酸-2-甲基丙酯/丁酸异丁酯、丁酸丁酯、丁酸-1-甲基丁酯、3-甲基-丁酸丁酯/异戊酸丁酯、丁酸-3-甲基丁酯/丁酸异戊酯、3-甲基-丁酸-3-甲基丁酯/异戊酸异戊酯、2-甲基-丙酸己酯/异丁酸己酯、β-柏木烯、7,11-二甲基-3-亚甲基-1,6,10-十二碳三烯。这9种成分占全部挥发性成分的95.05%,而其中仅丁酸酯类就占92.05%,可见,香蕉皮原料的挥发性成分主要是丁酸酯类。
未蒸煮香蕉皮发酵液中鉴定出9种挥发性成分,分别为乙酸、乙酸-3-甲基丁酯/乙酸异戊酯、芳樟醇、辛酸/羊脂酸、辛酸乙酯、2-莰烯、乙酸苯乙酯、突厥烯酮、癸酸乙酯。其含量占全部挥发性成分的87.13%。从蒸煮香蕉皮发酵液中检出28种挥发性成分,鉴定出其中的9种,分别为乙酸、乙酸-3-甲基丁酯/乙酸异戊酯、芳樟醇、辛酸/羊脂酸、辛酸乙酯、2-莰烯、乙酸苯乙酯、突厥烯酮、2,5-二叔丁基酚。其含量占全部挥发性成分的83.49%。在鉴定出的挥发性成分中,未蒸煮和蒸煮香蕉皮仅有1种成分不同,且其占比仅略超过1%,这说明二者的挥发性成分是相近的。
由表3可知,从香蕉皮原料中鉴定出的9种挥发性成分经过发酵后全部消失,说明发酵前后挥发性成分的变化很大,感官评定也表明香蕉皮经发酵后产生了浓郁的水果香气,与原料的气味差异极大。陶晨等[15]从香蕉中鉴定出39种挥发性成分,其中酯类占66.99%,包括异戊酸2-甲基丁酯、丁酸异戊酯和丁酸己酯等,与本研究结果相似。张文灿等[16]发现乙酸异戊酯在香蕉果肉和果皮中分别占挥发性成分的27.23%和4.67%,本研究在香蕉皮原料中未检测到乙酸异戊酯,但在未蒸煮和蒸煮香蕉皮发酵液中检测到其含量分别达到34.15%和15.76%,除乙酸外,含量占第一位,推测该成分在香蕉皮原料中可能以糖苷类香气前体成分的形式存在,无挥发性,发酵后游离出来。本研究在香蕉皮原料中检测到的丁酸异丁酯(2.15%)、丁酸丁酯(6.34%)、丁酸-1-甲基丁酯(17.20%)、丁酸异戊酯(65.40%)等几种主要挥发性成分也均在张文灿等[16]的研究中发现,但含量不同,这可能与成熟度、品种等差异有关。乙酸苯乙酯未在香蕉皮原料中检出,但在未蒸煮和蒸煮香蕉皮发酵液中除乙酸外其含量占第二位,分别达到5.78%和10.00%。
前期研究[17]发现在水开菲尔粒的微生物群落中存在多种多样的糖苷酶基因,而大量的水果香气成分是以糖苷类的前体物形式存在的,推测用水开菲尔粒发酵香蕉皮,可以有效水解糖苷类物质,将大量的香气成分释放出来,获得良好的水果香气,本实验结果证实了这种推测。
水开菲尔粒中的糖苷酶也包括了水解果胶、纤维素等物质的糖苷酶,所以香蕉皮经过发酵后相当一部分固形物被水解释放到发酵液中。发酵剩余的残渣主要是香蕉皮中的纤维素一类的成分,经过清洗干燥可以作为膳食纤维补充剂。
3 结论
本研究通过用水开菲尔粒对蒸煮和未蒸煮香蕉皮发酵,探讨香蕉皮发酵过程中各种成分的变化。气相色谱-质谱联用的数据结果显示香蕉皮发酵前后香气成分变化极大,发酵后香气大大增强。尽管蒸煮香蕉皮的发酵液比未蒸煮抗氧化活性有所降低,但仍具有一定的抗氧化活性,而且蒸煮香蕉皮利用率43.8%高于未蒸煮香蕉皮32.4%,乙醇含量2.8 mg/mL低于未蒸煮香蕉皮7.9 mg/mL。水开菲尔粒发酵蒸煮香蕉皮,发酵液风味良好,类似果醋,有望进一步开发成为新型饮料。

