天山雪莲SiICE2基因克隆及抗寒性分析
陈建权,张梦恬,熊 意,张向前,张 尧,王爱英,祝建波
(石河子大学 生命科学学院,农业生物技术重点实验室,新疆石河子 832003)
ICE(inducer of CBF expression)是低温胁迫转录激活因子,在低温胁迫信号的传导和诱导下游冷诱导基因(COR)的表达中起着关键的作用,是近年植物抗寒基因工程中研究较多的一类转录因子。2003年,朱健康[1]实验室利用EMS诱变含有ProCBF3:LUC的拟南芥(Arabidopsisthaliana)转基因植株,获得了ICE1突变体,并成功克隆到ICE1基因。随后研究者相继发现,在拟南芥中ICE1和ICE2基因可以编码MYC型bHLH转录因子,控制植物对低温的反应,是植物低温胁迫反应的正调控因子[2],在常温条件下,ICE1蛋白处于未激活状态,低温下被激活,特异性地结合到CBF启动子的顺式作用元件上,通过调节CBF/DREB1参与冷应激反应[3]。ICE2基因与ICE1具有高度相似性,最近有研究发现,ICE2的过度表达可以激活CBF1基因的表达,后者又激活COR/RD/LTI基因的冷依赖和ABA非依赖性表达[4];JAZ蛋白是茉莉酸信号的抑制因子,它可以通过与ICE2蛋白的直接结合来抑制ICE2基因的转录功能[5];2007年Pillitteri等[6]研究发现,ICE2基因在气孔形成的过程中起重要的调节作用。
本研究克隆了天山雪莲SiICE2基因,以pCAMBIA2300载体为骨架构建了植物表达载体,采用农杆菌介导的转化法侵染番茄(Lycopersiconesculentum),成功获得转天山雪莲SiICE2基因番茄植株,将转天山雪莲SiICE2基因和野生型番茄分别在0 ℃处理不同时间,测量各株系相对电导率及相关酶活性变化,再观察各株系表型恢复状态,初步探究了天山雪莲SiICE2基因在番茄抵抗低温环境下的作用。
1 材料和方法
1.1 材 料
本研究所用的天山雪莲野生型(Saussureainvolucrata)和番茄(Lycopersiconesculentum)野生型(WT)由新疆石河子大学农业生物技术重点实验室保存。
1.2 方 法
1.2.1天山雪莲SiICE2基因的克隆本研究通过对天山雪莲转录组数据的分析得到SiICE2基因序列,利用Premier 5.0软件设计引物SiICE2-Up和SiICE2-Down(表1),反应程序如下:94 ℃ 5 min; 94 ℃ 30 s, 58 ℃ 45 s, 72 ℃ 1 min, 25个循环; 72 ℃ 延伸7 min,4 ℃保存。PCR产物用1%琼脂糖凝胶电泳分离检测正确后,回收目的片段连接于pGM-T载体,得到重组载体pGM-SiICE2,酶切鉴定正确后测序。利用DNAMAN软件分析测序正确的序列,确定ORF并推导相应氨基酸序列。
1.2.2植物表达载体的构建用限制性内切酶SmaI和SalI双酶切重组载体pGM-SiICE2和植物表达载体pCAMBIA2300, 将目的基因片段和载体片段连接,得到重组载体pCAMBIA2300-35S-SiICE2-Nos,运用热激法将重组子转入大肠杆菌DH5α感受态细胞中;运用电击法将重组子导入农杆菌GV1301。
1.2.3转SiICE2基因番茄的获得及分子鉴定取番茄叶片剪成小块,暗培养2 d,将叶片夹入已活化好的含pCAMBIA2300-35S-SiICE2-Nos质粒的农杆菌箘液中,振荡侵染15 min;取出叶片,用无菌滤纸吸干,叶片正面朝上平铺于MS培养基(含滤纸)上;暗培养2 d,转入含50 mg/L Cb和100 mg/L Kan分化培养基中;室温光照培养待不定芽的分化,每隔15 d更换1次培养基;25~35 d以后,叶片边缘的愈伤组织逐渐分化出丛生芽;待丛生芽长至2~3 cm左右,转接至MS+50 mg/L Kan+0.3 mg/L IAA+500 mg/L Cb的番茄生根培养基中,继续生根培养。20 d后,将根系生长良好的转化植株移栽至基质(蛭石∶腐质土=2∶1)中,在培养室内以25 ℃、45%~60%湿度、每天光照9 h的条件下培养。利用CTAB法[7]提取转化番茄和野生型番茄叶片DNA,以野生型番茄DNA为阴性对照,质粒为阳性对照,对转化番茄进行PCR检测。利用Trizol法提取转化和野生型番茄RNA[8],用cDNA试剂盒对RNA进行反转录,得到cDNA第一链。根据番茄GAPDH基因、天山雪莲SiICE2基因序列设计特异性引物(表1),以得到的第一链为模板,进行RT-PCR扩增。扩增程序如下: 94 ℃预变性5 min;94 ℃变性45 s,55 ℃退30 s,72 ℃延伸1 min,共进行25个循环;最后72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测。
表1 本研究所用引物
1.2.4SiICE2表达量及生理指标测定选取长势良好的转SiICE2基因番茄3株(G1、G2、G3)和野生型(WT)一起置于0 ℃处理2、4、8、12、24 h,通过qRT-PCR测定SiICE2基因的表达量;测定各株系相对电导率[9-12]、丙二醛含量[13-14]、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性和超氧化物歧化酶(SOD)活性[15-18]。
2 结果与分析
2.1 SiICE2基因的克隆及生物信息学分析
以天山雪莲cDNA为模板进行SiICE2基因的克隆,经PCR扩增和酶切鉴定,证明天山雪莲SiICE2基因克隆成功(图1)。经DNAMAN软件分析,发现SiICE2基因序列的最大开放阅读框为462 bp,共编码153个氨基酸(图2)。利用Blastp对该蛋白保守区预测,发现该片段含有ACT(super family)结构区域。用Protparam预测天山雪莲SiICE2蛋白的理化性质,结果显示:分子式为C750H1217N209O244S4,相对分子量为17 194.41 Da,等电点为5.17,属于碱性蛋白;理论推导半衰期大约为30 h,不稳定参数为40.25;蛋白中Glu、Leu、Lys和Ser的相对含量较高;带负电荷的残基为56,带正电荷的残基为40;脂肪族氨基酸指数为94.31,平均疏水指数为-0.489。利用Blast分析和Mega软件构建了系统进化树,结果显示SiICE2与菜蓟的亲缘关系最近(图3)。
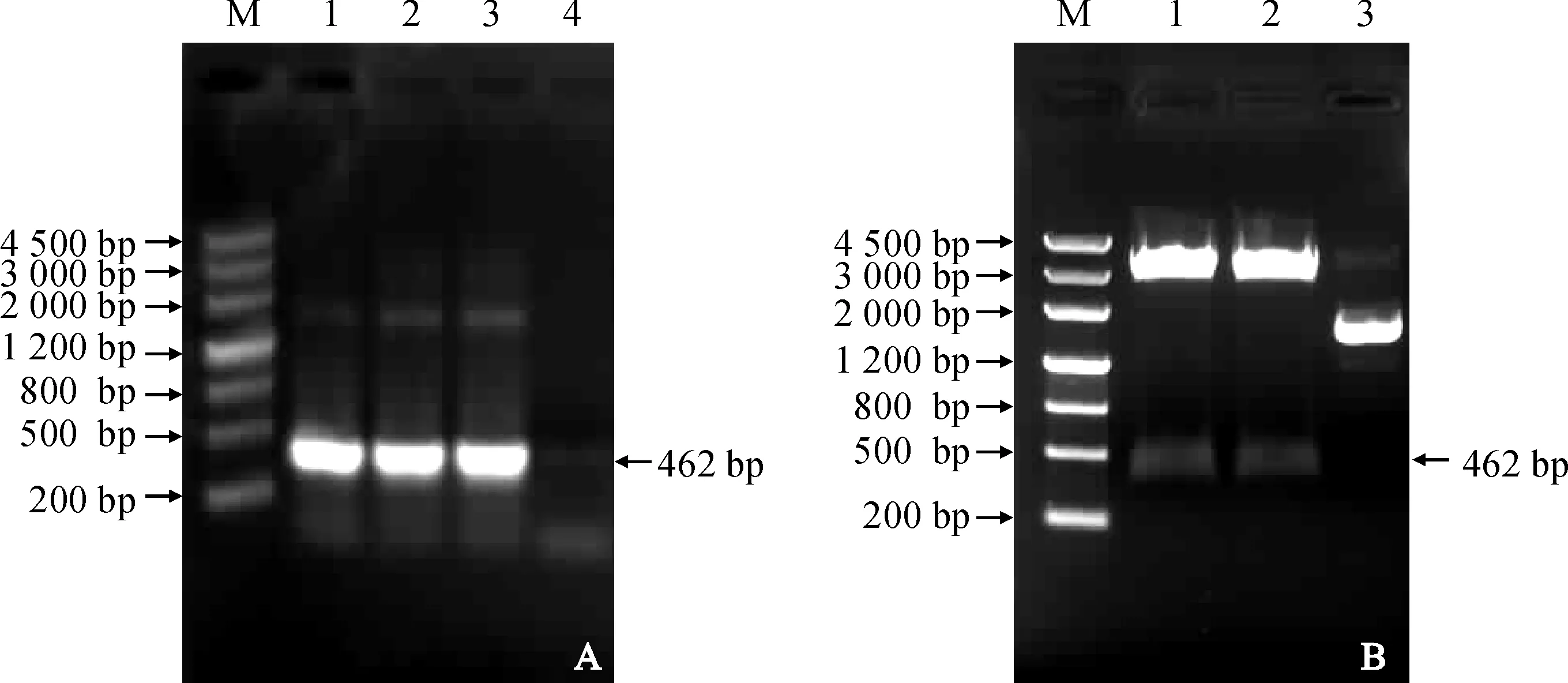
M. DNA Maker Ⅲ;A. pGM-SiICE2载体PCR鉴定: 1~2. PCR产物; 3. 阳性对照; 4. 阴性对照;B. pGM-SiICE2载体酶切鉴定: 1~2. SiICE2; 3. 质粒对照图1 天山雪莲SiICE2基因的克隆M. DNA Maker Ⅲ; A. PCR identification of pGM-SiICE2: 1-2. PCR products; 3. Plasmid control; 4. Negative control;B. Restriction enzyme digestion of pGM-SiICE2 plasmid: 1-2. SiICE2; 3. PlasmidFig.1 Cloning of Saussurea involucrata SiICE2 gene

图3 天山雪莲SiICE2蛋白与其他植物ICE2蛋白的系统进化树Fig.3 Phylogenetic tree analysis of S. involucrata SiICE2 and ICE2s of other plants

图2 天山雪莲SiICE2基因核苷酸序列及其编码的氨基酸序列Fig.2 The nucleotide and putative amino acid sequences of S. involucrata SiICE2 gene
2.2 植物表达载体的构建和转SiICE2基因番茄的获得
用限制性内切酶SmaI和SalI双酶切重组载体pGM-SiICE2和植物表达载体pCAMBIA2300,将目的基因片段和载体片段连接,运用热激法将得到的重组子转入大肠杆菌DH5α感受态细胞中,提取阳性质粒,用SmaI和SalI双酶切鉴定,证明植物表达载体pCAMBIA2300-35S-SiICE2-Nos构建成功(图4)。采用农杆菌介导法侵染番茄,得到转化的番茄植株(图5)。取9株转化的番茄植株叶片各0.2 g,提取基因组DNA,并以其为模板对转化植株进行PCR检测,均得到462 bp特异条带(图6)。进一步采用Trizol法提取转化番茄和野生型番茄RNA进行RT-PCR检测,结果(图7)表明,天山雪莲SiICE2基因已成功转化到9株番茄中。
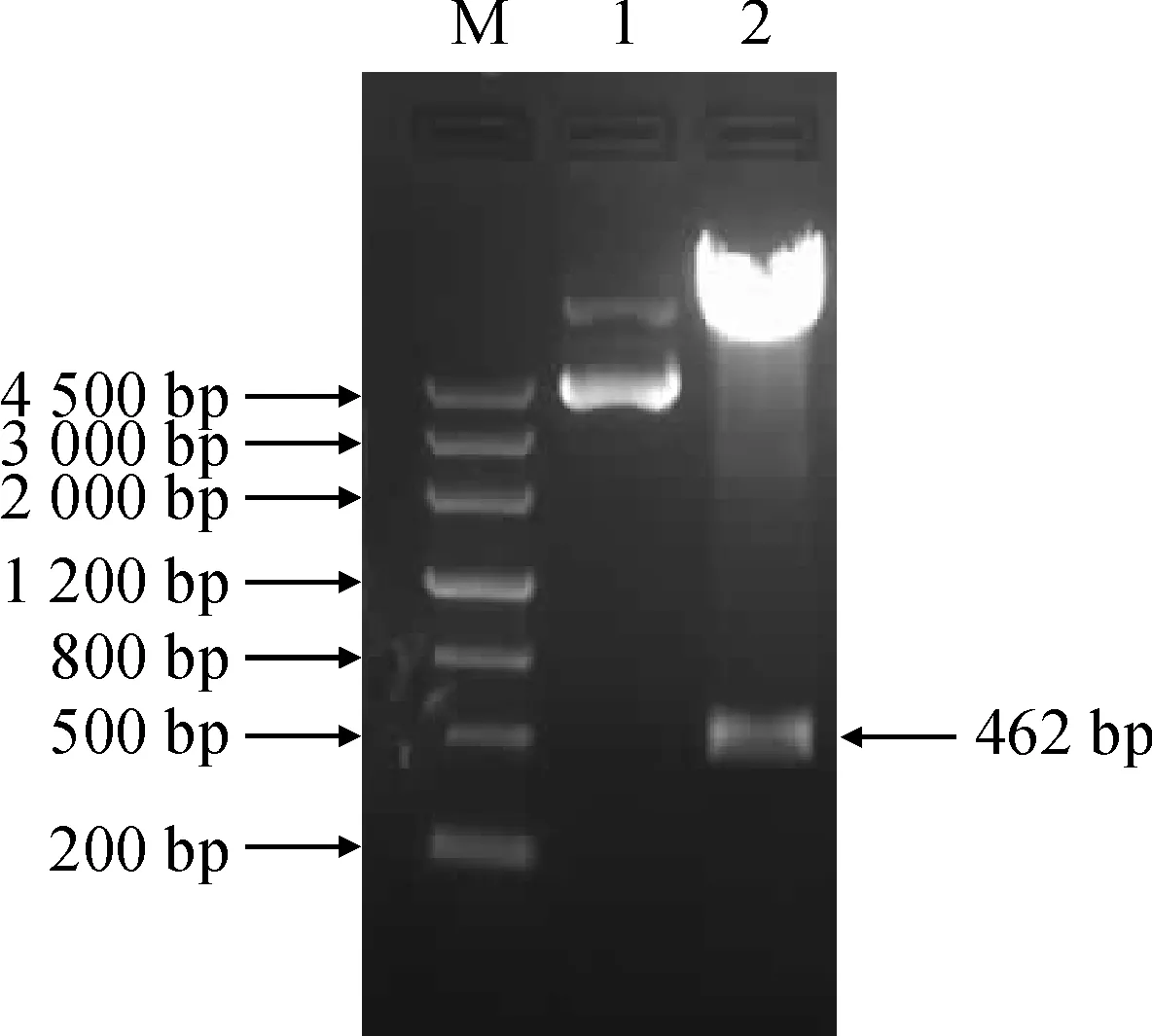
M. DNA marker Ⅲ; 1. 质粒对照; 2. 双酶切产物图4 pCAMBIA2300-35S-SiICE2-Nos载体的酶切鉴定M. DNA marker Ⅲ; 1. Plasmid; 2. Double digestion productFig.4 Restriction enzyme digestion of pCAMBIA2300-35S-SiICE2-Nos plasmid
2.3 转SiICE2基因番茄对低温胁迫的响应
2.3.1SiICE2基因在番茄表达量的变化选取长势良好的转SiICE2基因番茄3株(G1、G2、G3)置于0 ℃处理2、4、8、12、24 h,20 ℃恢复2 d。通过qRT-PCR测定SiICE2基因的相对表达量,结果(图8)表明,相同株系在不同的低温处理时间内,SiICE2基因的表达量变化差异不大;不同株系之间,SiICE2基因的表达量变化存在一些差异。
2.3.2叶片形态变化由图9可以看出野生型番茄在0 ℃处理2 h时,叶片出现少量坏死斑,4 h时叶片边缘失水萎蔫,8 h时失水更为严重且有冻僵的触感,12 h时植株顶端的叶片完全冻僵,其他的叶片出现黄色枯斑,24 h时大部分叶片已冻僵且出现大量明显枯斑;而转SiICE2基因番茄在0 ℃各处理时间叶片也出现了部分失水萎蔫、黄色枯斑的现象,但较野生型有显著的好转,经过5 d的恢复实验后,野生型整棵植株基本干枯,无法恢复到低温胁迫处理前的状态,转SiICE2基因植株基本恢复。表明天山雪莲SiICE2基因可提高番茄抗寒性。

A. 番茄无菌苗的种植; B. 子叶预培养; C. 诱导再生芽; D. 诱导生根; E. 移栽; F. 开花结果图5 转SiICE2基因番茄的遗传转化过程A. Aseptic seedling; B. Cotyledon preincubation; C. Bud induction; D. Rooting induction; E. Smelting plants; F. Blossom and bear fruitFig.5 Process of transforming SiICE2 gene in Lycopersicon esculentum
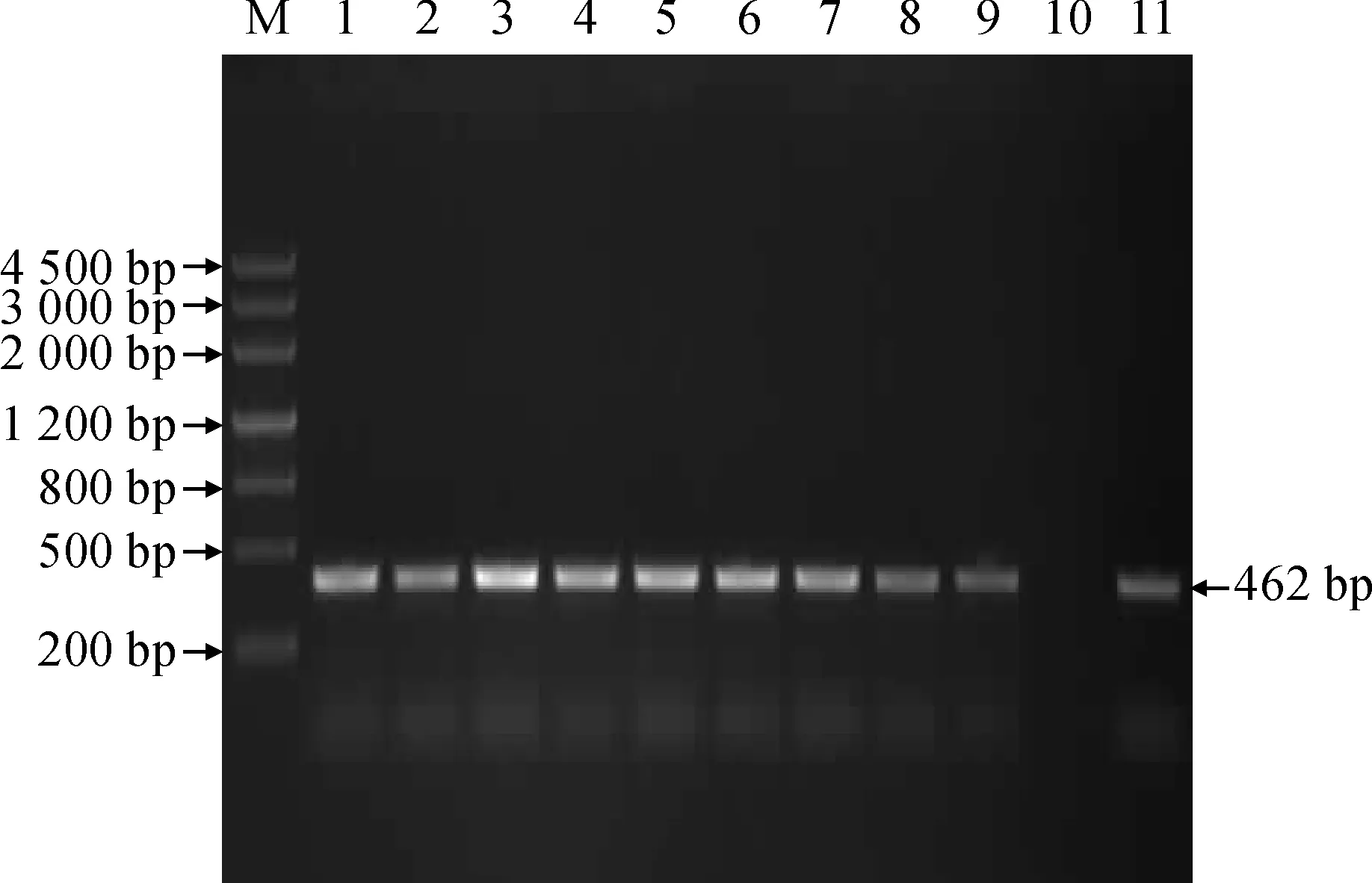
M. DNA marker Ⅲ; 1~9. 转SiICE2基因番茄植株; 10. 阴性对照; 11. 阳性对照图6 转SiICE2基因番茄的PCR鉴定M. DNA marker Ⅲ; 1-9. Transfer SiICE2 of Lycopersicon esculentum lines; 10. Negative control; 11. Positive controlFig.6 Transfer SiICE2 of Lycopersicon esculentum PCR amplification
2.3.3膜稳定性的变化由图10可以看出,随着0 ℃处理时间的增加,各株系相对电导率和丙二醛(MDA)均会随着处理时间的增加而升高,但是转SiICE2基因植株在各处理时间段内的相对电导率和MDA含量均显著低于野生型;在处理24 h时,野生型的相对电导率达到了75.4%,而转SiICE2基因型番茄平均只有43.7%,相比野生型低31.7%(图10,A);在处理24 h时,野生型MDA含量达到了12.3 μmol/g,而转SiICE2基因型番茄平均只有8.1 μmol/g,相比野生型低4.2 μmol/g。以上结果表明,转SiICE2基因的番茄相比野生型,可以更好地抑制植株相对电导率的升高和丙二醛含量的增加,从而缓解低温环境对植株生物膜的损害。
A. 目的基因(1~9. 转SiICE2基因番茄植株); B. 内参基因(1~9. GAPDH基因)图7 转SiICE2基因番茄的RT-PCR鉴定A. Target gene(1-9. Transfer SiICE2 of Lycopersicon esculentum); B. Reference genes(1-9. GAPDH)Fig.7 Transfer SiICE2 of Lycopersicon esculentum RT-PCR amplification
2.3.4抗氧化能力由图11得出,各材料POD和CAT活性在0 ℃处理前并无显著差异。0 ℃处理2~24 h期间,转SiICE2基因型番茄POD、CAT和SOD活性持续上升,野生型先逐渐升高后降低,并在12 h达到最大值。在12 h时,转SiICE2基因型POD活性的平均值相比野生型高33.3%;CAT活性的平均值相比野生型高32.7%;3株转SiICE2基因型的SOD活性分别为150(G1)、135(G2)、141(G3) μmol·g-1· min-1,野生型酶活性为108 μmol·g-1· min-1,转SiICE2基因型植株显著高于野生型植株。在生长恢复实验后,转SiICE2基因型POD、CAT和SOD活性基本恢复到了未处理前水平,而野生型未恢复。以上结果表明,低温处理下SiICE2基因可以提高番茄植株抗氧化酶的活性,从而减轻低温引起的细胞膜质氧化造成的损伤,增强了植株的低温耐受能力。
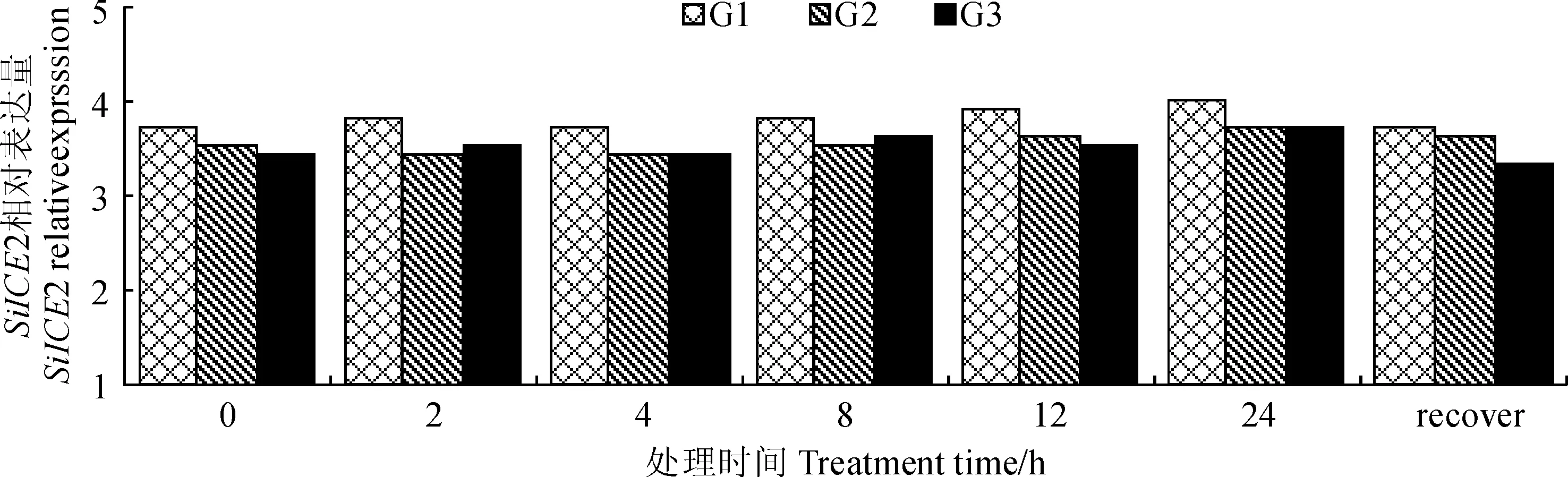
G1, G2, G3. 转SiICE2基因番茄;recover.20 ℃恢复处理2 d。下同图8 低温处理下转基因番茄SiICE2的相对表达量G1, G2, G3. Transgenic SiICE2 gene Lycopersicon esculentum;recover. Recovered for 2 days under 20 ℃; The same as belowFig.8 The relative expression of SiICE2 gene under low temperature stress

图9 不同低温处理时间下各株系番茄叶片的变化Fig.9 Changes of Lycopersicon esculentum leaves in different strains under different low temperature time
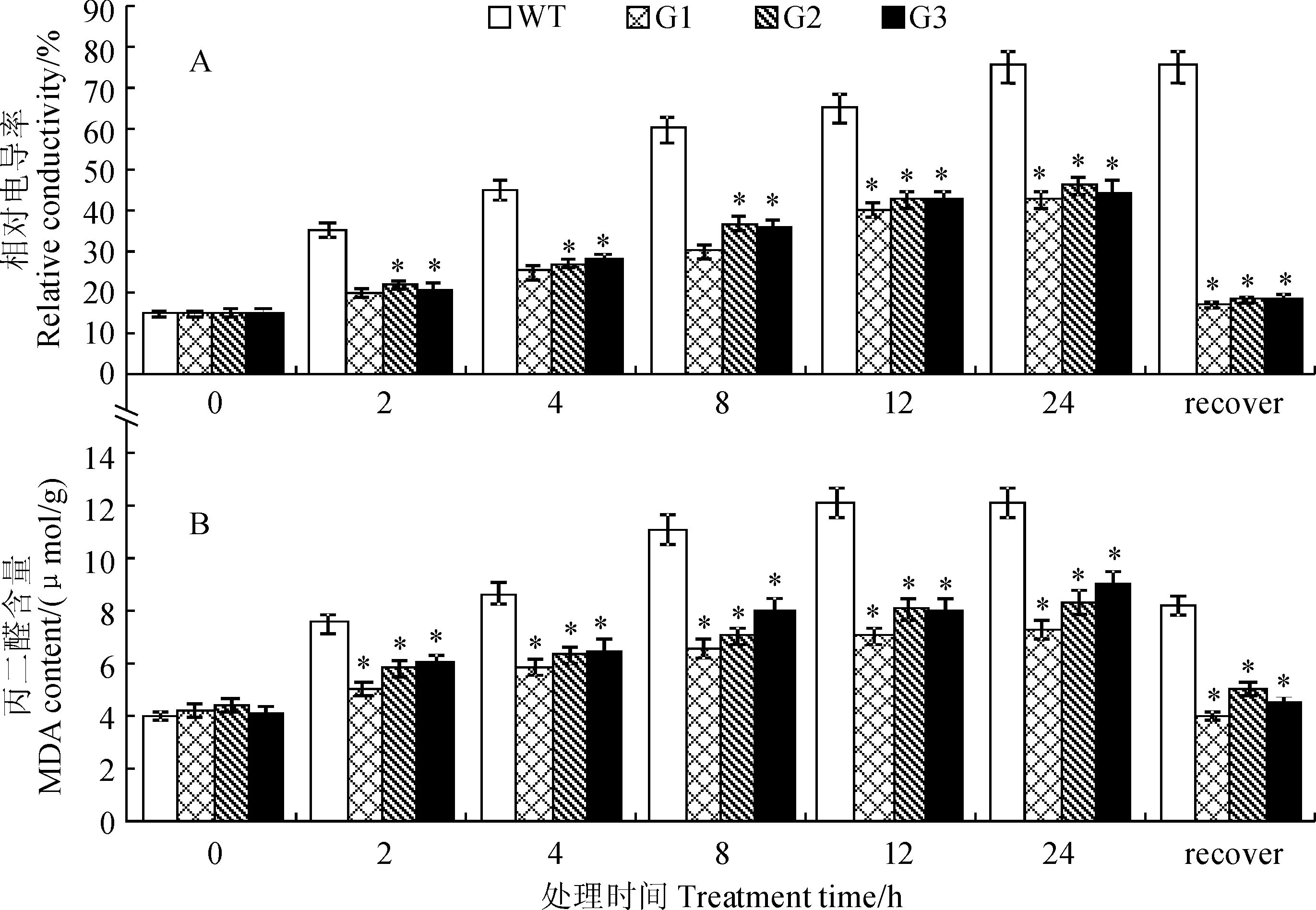
*表示同期转基因株系与野生型间在0.05水平存在显著性差异;下同图10 低温处理下各株系番茄膜生理指标的变化* stand for the significant difference between transgenic line and wild type within the same stage at 0.05 level. The same as belowFig.10 Changes of physiological indexes of Lycopersicon esculentum membrane under low temperature treatments
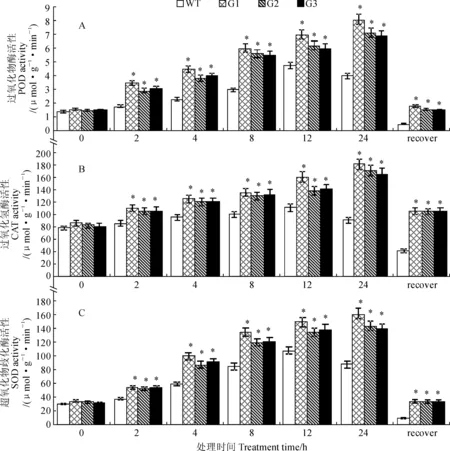
图11 低温处理下各株系番茄抗氧化酶活性的变化Fig.11 Changes of antioxidant enzyme activities of Lycopersicon esculentum under low temperature treatments
3 讨 论
低温是影响植物生长发育的主要环境因素之一,其危害一方面是损害了细胞膜的结构和膜上的酶系统,从而干扰细胞代谢过程,使有毒物质积累,进而引发代谢失调[19];另一方面是使体内活性氧(ROS)的产生与过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等保护酶系统失去动态平衡,导致活性氧的累积,造成氧化伤害,并影响植株正常的生长和发育[20-21]。ICE2是ICE1的同源基因,通过CBF1/CBF3的表达正调控植物对低温的响应,但ICE2与ICE1同样具有差别,Kurbidaeva等[22]研究发现ICE2和ICE1蛋白分别由450和494个氨基酸组成,其中有190个氨基酸区域为高保守区域,均由疏水性氨基酸组成,ICE1由不带电荷的氨基酸组成,而ICE2由带负电荷的氨基酸组成,同时Kurbidaeva还发现ICE2相比ICE1含有较多的谷氨酰胺和亮氨酸以及磷酸化位点,且这些蛋白质的长度较短,推测ICE2蛋白的活性受到严格的调控。Oksana等[23]发现ICE2由5个外显子构成,第1个外显子可以编码F-box结构域,该结构域为植物特异性蛋白,第2和第3外显子含有bHLH转录因子结构域,这个转录因子家族在整个细胞周期中都有重要作用,同时在植物受到低温刺激后ICE2转录因子并不是通过泛素依赖性蛋白水解途径响应,而是直接参与冷应激反应。
本研究运用农杆菌介导法将植物表达载体pCAMBIA2300-35S-SiICE2-Nos导入番茄,通过对低温处理下转天山雪莲SiICE2基因型和野生型番茄的叶片形态变化和丙二醛含量、相对电导率、POD、CAT和SOD的活性分析发现,转天山雪莲SiICE2基因的番茄在低温处理下,相比野生型植株可以更好地提高抗氧化酶活性,增强细胞膜的流动性,从而提高植株抗寒性。
ICE1基因在拟南芥、小麦[24]和甜杨[25]中是组成型表达,但芥菜ICE1 (Cbice53)[26]的表达水平会受到低温胁迫和盐胁迫诱导而提高。ICE2是ICE1的同源基因但是目前研究较少。本研究发现不同温度处理下,在同一转基因番茄株系中SiICE2基因的表达量变化很小,SiICE2基因是否与拟南芥等植物ICE1一样,是组成型表达,仍有待于进一步研究。同时还发现,当0 ℃处理前(0 h),转SiICE2基因番茄的MDA量及POD 、CAT和SOD活性与野生型植株基本相同,这是否说明SiICE2基因在常温下是钝化的,对植株的生理生化代谢是否有影响,还需进一步研究。本研究结果初步反映了天山雪莲SiICE2基因具有一定的抗寒性,这为今后进一步研究该基因以及天山雪莲物种资源的开发和利用提供了一定的理论基础和实验依据。

