同源四倍体紫菜薹的诱导鉴定及其营养品质比较
邵帅旭,陈 丽,杨 阳,李艳艳,侯喜林,刘同坤*
(1 南京农业大学 园艺学院,作物遗传与种质创新国家重点实验室,农业部华东地区园艺作物生物学与种质创制重点实验室,南京 210095;2 南京理想农业科技有限公司,南京 210095)
紫菜薹(BrassicacampestrisL. ssp.chinensisvar.purpureaTsen et Lee)又名红菜薹、红油菜薹,为十字花科芸薹属芸薹种白菜亚种的变种,一或二年生草本植物,为中国特产蔬菜,主要分布在长江流域一带,营养丰富,以其肥嫩多汁、色泽艳丽的花茎为食用器官[1]。利用人工诱变或自然变异等,通过细胞染色体组加倍可以获得多倍体植株[2]。多倍体植物与二倍体植物相比植株个体更大,一般在叶片、花器官、果实和种子中表现出巨大性。因此,诱导产生四倍体紫菜薹可获得更大的花茎,进而提高产量,稳定并推广四倍体品种可有效促进市场占有率。
多倍体植物的诱导一般分为离体诱导和活体诱导两种方法[3]。离体诱导是指通过植物组织培养与秋水仙素相结合的方法创制出新的种质,主要包括浸泡法和混培法[4-9];活体诱导是指使用一定浓度的秋水仙素或氨磺灵试剂对子叶期植株的茎尖生长点进行点滴处理[10-11]。由于离体诱导所需试验条件要求较高[3],大田种植不能提供离体诱导所需试验环境,因此,本试验采用活体诱导。参照前人使用秋水仙素对植物进行诱导加倍的结果,诱导不结球白菜‘依玲’使用浓度为0.2%的秋水仙素处理4次诱导效果最好,四倍体加倍率为7.64%[12],诱导萝卜使用浓度为0.15%秋水仙素处理4次诱导效果最好,四倍体加倍率为8.6%[13]。本试验以0.1%为梯度分别设置0.1%、0.2%和0.3% 3个浓度对紫菜薹茎尖生长点进行4次处理,尝试诱导获得四倍体紫菜薹植株。
鉴定多倍体的方法主要有形态学鉴定、解剖学鉴定、细胞学鉴定、流式细胞仪鉴定等[3, 14-15],流式细胞仪分析法通过测定细胞经碘化丙啶(Propidium Iodide)染色后显示的DNA荧光强度来比较染色体倍性,是近几年发展起来的较为快捷、准确的鉴定多倍体植株的方法,已在猕猴桃[16]、不结球白菜[12]等植物倍性鉴定上有所应用,但由于不同植物的细胞结构不同及次级代谢产物的特殊性和复杂性,流式细胞仪鉴定植株倍性的适用性与实验方法也存在差异[17-18]。本试验在使用流式细胞仪对紫菜薹植株进行倍性鉴定时首次提出以Tris-MgCl2为解离液并成功鉴定出二倍体和四倍体紫菜薹植株,为十字花科植物应用流式细胞仪进行倍性鉴定提供了一种新的试验方法。
多倍体植株在园艺生产中表现出来的营养器官和生殖器官增大、营养成分增多、优质、高产、抗逆性强等特征是人为诱导产生多倍体的根本原因[2, 14]。本试验使用秋水仙素对二倍体紫菜薹植株进行诱导获得四倍体植株,并对获得的四倍体紫菜薹植株与对照进行品质鉴定和农艺性状统计,以期得到优质、高产、营养丰富的新品种。
1 材料和方法
1.1 试验材料
以南京理想种苗有限公司种植的紫菜薹为试验材料,2n=2x=20。试验在南京农业大学白菜系统生物学实验室以及南京理想种苗有限公司试验基地进行。
1.2 诱导方法
在紫菜薹幼苗子叶完全展开时,采用秋水仙素溶液点滴幼苗生长点,每天上午(9:00)和下午(17:00)各处理1次,秋水仙素浓度设定为0.1%、0.2%、0.3% 3个水平,每个浓度分别处理4次,每次处理点滴0.2 mL,以蒸馏水作对照(CK)。
1.3 鉴定方法
1.3.1形态学与解剖学鉴定二倍体和四倍体植物在形态学与解剖学存在明显差异[10, 19-20],根据叶型、叶色、花器官、种子大小等相关形态学性状进行初步筛选与鉴定;解剖学鉴定则根据气孔大小、气孔密度、花粉大小、花粉形状等相关指标对诱导小区进行筛选,进一步确定诱导产生的疑似植株。
1.3.2细胞学鉴定将收取的紫菜薹疑似株种子在培养皿中催芽,待其生根后取1~2 cm根尖,在0.02 mg·L-18-羟基喹啉中预处理4 h,卡诺试剂固定24 h,再使用1 mol·L-1HCl在60 ℃条件下解离4 min,用压片法制片,使用改良品红进行染色,在Olympus倒置显微镜下观察并进行拍照。
1.3.3流式细胞仪鉴定通过流式细胞仪(美国 BD Accuri)对植株进行DNA含量分析鉴定。从疑似株上进一步选取0.05 g幼嫩的叶片,在装有1 mL解离液[200 mmol·L-1Tris,4 mmol·L-1MgCl2·6H2O,0.5%(V/V)TritonX-100, pH 7.5]的玻璃培养皿中快速切碎,40 μm过滤器过滤至1.5 mL离心管,冰上孵育5~10 min,1 000 r·min-1低温离心5 min弃上清液,再加入1 mL预冷的Tris-MgCl2缓冲液,1 000 r·min-1低温离心5 min后,弃上清液,再加入0.5 mL预冷的Tris-MgCl2缓冲液,加入核糖核酸酶(RNase A)和荧光染料碘化丙啶(Propidium Iodide)混匀,避光染色15 min后上机进行检测。
1.4 二倍体和四倍体紫菜薹营养品质鉴定以及农艺性状统计
对鉴定为四倍体的紫菜薹植株M0代进行严格的蕾期单株自交授粉并单株收种,将获得的M1代种子,与对照在2017年11月3日同时播种,在2018年1月8日进行品质鉴定以及农艺性状统计。各选取6株二倍体和四倍体紫菜薹植株,取各植株同一部位的叶片,测定硝态氮、可溶性蛋白、维生素C、游离氨基酸、可溶性糖、纤维素含量和叶绿素总浓度[21-22],并各取10株二倍体和四倍体紫菜薹植株进行农艺性状统计,考察性状主要包括株高、单株质量、叶片数、十叶厚、开展度、叶长、叶宽、叶柄长、叶柄宽、叶柄厚[14, 23]。
1.5 数据分析
采用Excel 2016对实验所得数据进行整理,使用SAS 9.2对实验数据进行统计分析。
2 结果与分析
2.1 不同浓度秋水仙素处理对二倍体紫菜薹诱导的影响
由表1可知,使用0.1%~0.3%浓度的秋水仙素处理4次均可以诱导紫菜薹植株发生变异,且随着秋水仙素浓度的提高,处理植株与对照植株相比形态上发生变化的比率越高,即紫菜薹植株变异率逐渐升高,其中秋水仙素浓度为0.3%时紫菜薹植株的变异率为17.24%;而秋水仙素对紫菜薹植株进行诱导产生四倍体植株的加倍率却随着秋水仙素浓度的升高而先升高后降低,并在秋水仙素浓度为0.2%时诱导效果最佳,总计诱导得到9株四倍体植株,四倍体加倍率为6.62%。
2.2 紫菜薹植株的形态学与解剖学鉴定结果分析
根据处理植株与对照植株之间存在的形态学和解剖学差异进行筛选鉴定,选出差异明显的标记为疑似植株并拍照记录,结果如图1。其中,疑似植株与对照植株相比叶片颜色加深、变大、圆润、叶柄变宽、叶片边缘出现锯齿(图1,A、B);花朵形状相对于二倍体更加紧凑、单花瓣形状偏圆,与二倍体相比雌蕊个体变大(图1,C);花簇变大、颜色鲜艳(图1,

表1 不同浓度秋水仙素诱导四倍体紫菜薹的效果
注:成活率%=成活株数/总样本量(于成株期统计);变异率%=变异数/总样本量(于苗期统计);加倍率%=四倍体株数/总样本量(于成株期统计)
Note: Survival rate% =Survival number/Total sample size (in the adult statistics); Variation rate%=Variation number/Total sample size (in seeding statistics); Double rate%=Tetraploid number of plants/Total sample size (in the adult statistics)
D)。种子直径变大,角果变粗、颜色加深(图1,E、F);显微镜观察下视野内气孔密度变小、气孔变大(图1,G、H)。花粉呈现出明显的不同于二倍体植株的不规则状,显微镜下观察到矩形、梯形、菱形花粉(图1,I、J)。
2.3 紫菜薹植株的细胞学鉴定分析
取部分经过形态学与解剖学鉴定过的疑似四倍体紫菜薹植株收获的种子进行催芽使其生根,对收获的根尖进行染色体鉴定,部分疑似植株染色体鉴定结果如图2所示,二倍体植株染色体数目为2n=2x=20,疑似植株根尖染色体数目为2n=4x=40,直观的鉴定出本次试验诱变成功,并得到四倍体紫菜薹植株。
2.4 紫菜薹植株的流式细胞仪鉴定分析
选取疑似植株0.05 g新鲜叶片通过流式细胞仪进行DNA含量鉴定。结果如图3,图中峰值横坐标的位置显示为被测紫菜薹的DNA荧光强度,对照组紫菜薹DNA荧光强度显示为956 725.15,疑似株DNA荧光强度为2 092 385.03,约为二倍体植株的2倍,表明疑似植株是四倍体(4x)。
2.5 二倍体和四倍体紫菜薹植株营养品质比较
由表2可知,四倍体紫菜薹硝态氮、可溶性蛋白、可溶性糖、维生素C、纤维素含量分别比二倍体降低了48.99%、43.20%、44.50%、45.81%和59.97%,并差异极显著;而四倍体紫菜薹叶绿素总浓度和游离氨基酸总量分别比二倍体增加了110.02%和228.58%,两者间也差异极显著。
2.6 二倍体与四倍体紫菜薹植株农艺性状比较
由表3可知,四倍体紫菜薹植株的单株质量、十叶厚、叶宽、叶柄宽、叶柄厚分别比二倍体植株上升了37.79%、46.01%、20.57%、16.67%和24.48%,且十叶厚、叶宽、叶柄宽差异达极显著水平,单株质量、叶柄厚达差异显著水平;同时,在开展度方面,四倍体植株相对于二倍体植株在开展长度上降低17.62%,并具有显著差异,而在开展宽度上四倍体植株降低了12.55%,但没有显著性差异;另外,四倍体株高、叶片数分别比二倍体增加2.58%和2.38%,而叶长、叶柄长却分别减少5.59%和13.13%,但这些指标在二倍体和四倍体植株之间均没有显著性差异。

A.植株;B.叶片;C.花器官;D.花;E.种子;F.角果; G、H.气孔;I、J.花粉图1 二倍体与四倍体紫菜薹植株各器官差异比较A. Plant; B. Leaf; C. Floral organ; D. Flower; E. Seed; F. Silique; G and H. Stomata; I and J. PollenFig.1 Comparing the differences of organs between diploid and tetraploid purple tsai-tai

图2 二倍体与四倍体紫菜薹细胞学鉴定结果Fig.2 The cytological identification of diploid and tetraploid Purple Tsai-tai

图3 二倍体与四倍体紫菜薹流式细胞仪倍性鉴定结果Fig.3 The ploidy identification results of diploid and tetraploid Purple Tsai-tai by flow cytometry
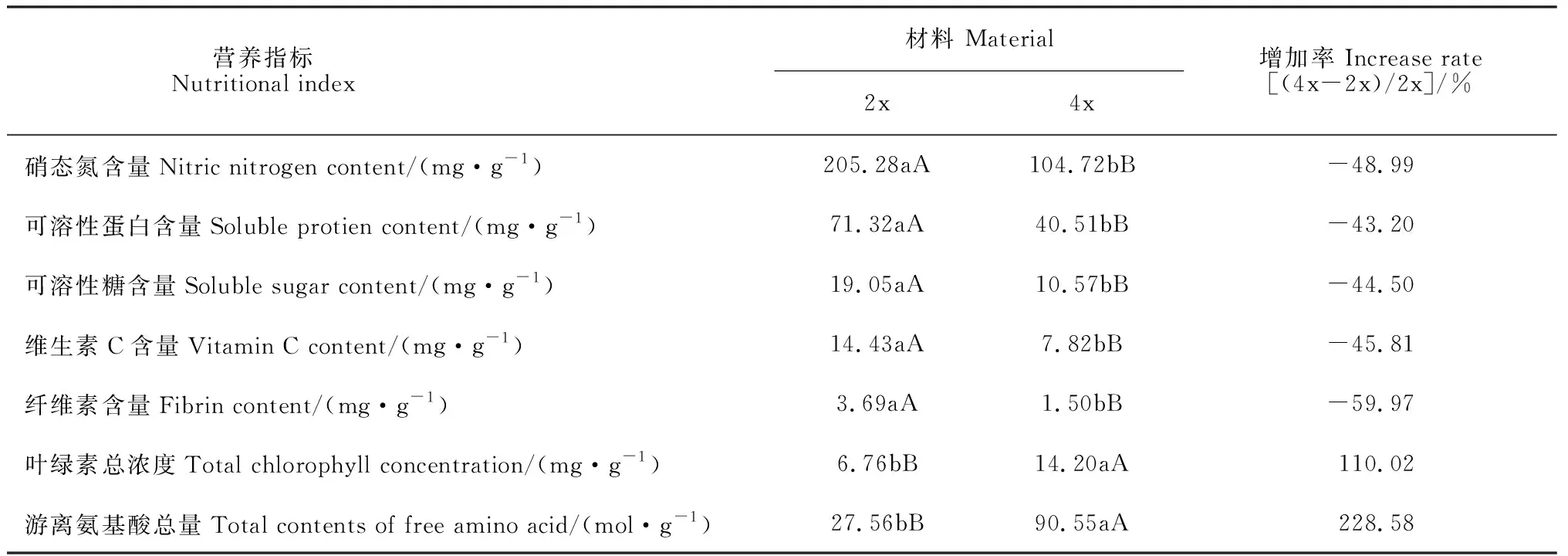
营养指标 Nutritional index 材料 Material2x4x增加率 Increase rate[(4x-2x)/2x]/%硝态氮含量Nitric nitrogen content/(mg·g-1)205.28aA104.72bB-48.99可溶性蛋白含量Soluble protien content/(mg·g-1)71.32aA40.51bB-43.20可溶性糖含量Soluble sugar content/(mg·g-1)19.05aA10.57bB-44.50维生素C含量Vitamin C content/(mg·g-1)14.43aA7.82bB-45.81纤维素含量Fibrin content/(mg·g-1)3.69aA1.50bB-59.97叶绿素总浓度Total chlorophyll concentration/(mg·g-1)6.76bB14.20aA110.02游离氨基酸总量Total contents of free amino acid/(mol·g-1)27.56bB90.55aA228.58
注:同行数据后不同小写和大写字母分别表示差异达显著水平(P<0.05)和极显著水平(P<0.01);下同
Note: Different normal and capital letters indicate significant difference at 0.05 and 0.01 levels,respectively. The same as below
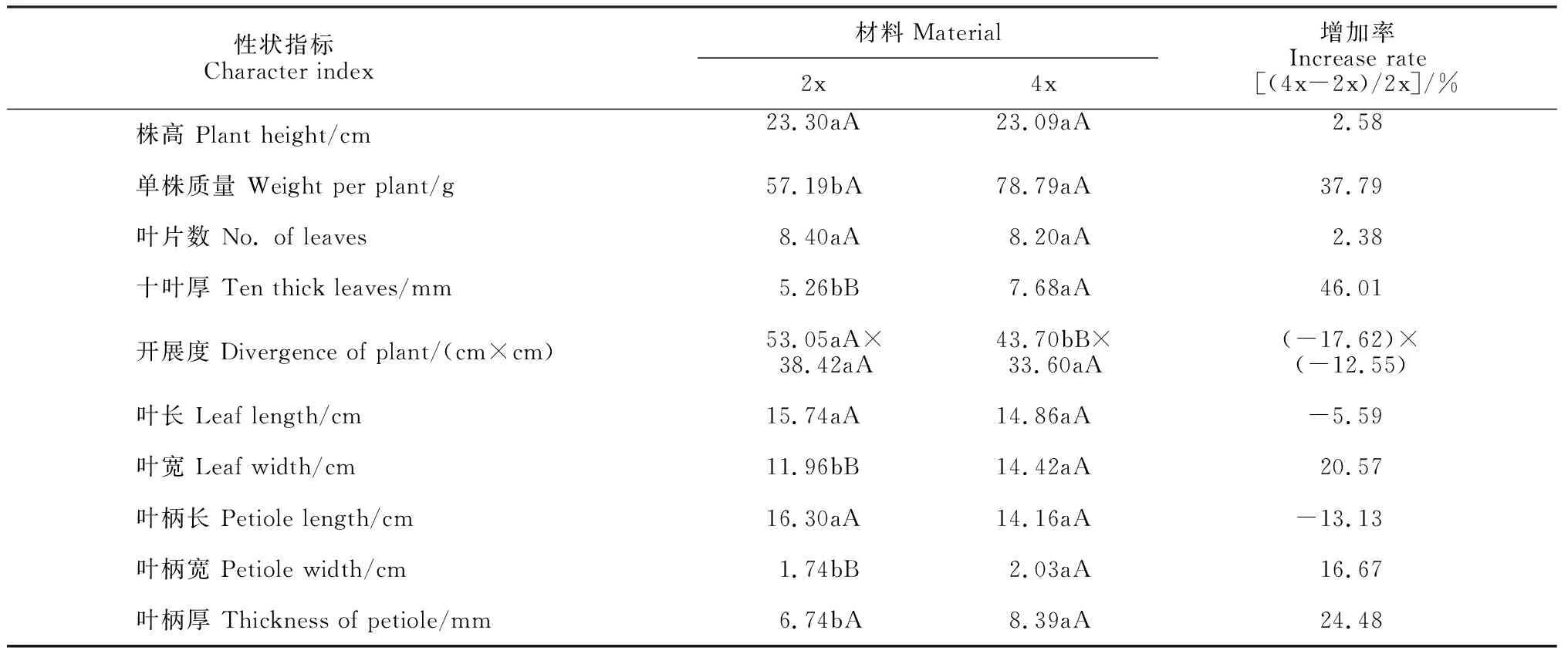
表3 二倍体与四倍体紫菜薹主要农艺学性状比较
3 讨 论
多倍体植株的鉴定方法主要有形态学鉴定、解剖学鉴定、细胞学鉴定、流式细胞仪鉴定等[3, 14-15]。形态学鉴定主要依据二倍体和四倍体植株存在的表观性状差异性进行鉴定,解剖学鉴定则依据二倍体和四倍体植株在花粉、气孔等方面存在的差异进行鉴定,因此在对四倍体植株进行鉴定时通过形态学与解剖学观察植株的生长状况特征与花粉、气孔的差异进行初步筛选鉴定可有效提高鉴定效率。细胞学鉴定与流式细胞仪鉴定法则可以直观准确地区分二倍体和四倍体植株[23],细胞学鉴定则根据取材部位与观察时期的不同一般可分为花粉母细胞鉴定和根尖染色体鉴定[20, 24]。
本试验采用根尖染色体进行鉴定,将经过形态学和解剖学鉴定筛选后的疑似植株在蕾期单株授粉,以收获的种子为材料进行鉴定。细胞学鉴定法可以准确、直观地分辨出二倍体和四倍体植株,但是操作流程复杂无法大规模进行鉴定[25-26],且以根尖为材料进行染色体鉴定需取用诱变植株收获的种子作为试验材料,无疑大大增加了四倍体育种的育种年限。流式细胞仪鉴定法则是通过检测植物体内DNA相对含量[27-29]进而鉴定植物的倍性,整个试验高效、准确,还可以鉴定出来非整倍体和嵌合体[28],相对于根尖染色体的鉴定更加方便,且可以在四倍体育种过程中对诱变的初代植株进行鉴定,明显缩减了育种周期。在以后的四倍体植株鉴定过程中,以流式细胞仪鉴定结果为主并以细胞学鉴定结果为辅,将会显著降低育种工作量,缩减育种周期,在指导生产方面具有实际应用价值。
多倍体植株在园艺生产中普遍比二倍体植株具有更高的营养品质、产量和抗逆性[2,30-31],而本试验中对诱导得到四倍体紫菜薹植株与二倍体植株进行营养品质鉴定,发现四倍体紫菜薹的硝态氮、可溶性蛋白、可溶性糖、维生素C、纤维素含量均低于二倍体紫菜薹植株,而叶绿素总浓度和游离氨基酸总量高于二倍体紫菜薹植株,明显不符合四倍体植株营养品质高于二倍体植株的预期。对二倍体和四倍体植株的农艺性状鉴定结果则显示:四倍体紫菜薹相对于二倍体紫菜薹单株质量有明显提高,而株高没有明显差异性,进而不能表现出‘巨大性’,同时,开展长度小于二倍体植株,而在叶厚、叶宽、叶柄宽、叶柄厚等方面却显著增加,使四倍体的株高特征向矮小、紧凑型发展[14,32-33],在生产时可以使小区内种植密度增加,进而增加单位面积产量。
通常来讲,人工诱导四倍体植株使其染色体发生变异,是四倍体相对于二倍体植株具有优势的根本原因[15],而本次试验诱导得出四倍体植株营养品质却低于二倍体植株,出现这种情况的原因仍需进一步研究。但在自然界中植物的多倍体化是推进植物进化与物种形成的一个重要原因[34],因此人工诱导多倍体的产生在多倍体育种过程中仍然具有十分重要的指导意义。

