免疫抑制剂对小鼠流感病毒性肺炎模型建立的影响①
吴佳敏 张晨阳 卢芳国 魏 科 邓雅琪 李博杨 吴肖男 李 玲
(湖南中医药大学中西医结合学院,长沙410208)
流感病毒性肺炎是由于感染流感病毒而引起,其传染率高,流行面广,死亡率高,且流感病毒感染后临床表现轻重不一,又以A型流感病毒抗原变异性最强[1-3]。而目前实验室流感病毒性肺炎动物模型的建立有一定的难度,主要是由于许多动物对人类常见的A型流感病毒具有天然的免疫力,通常情况下很难引起动物的肺部感染,虽然我们采用的A型流感病毒属于小鼠肺适应株,但是在病毒性肺炎的程度上还未达到临床相似症状,因此为开发有效防治流感病毒性肺炎的药物,流感病毒性肺炎模型的制备是实验室目前亟待解决的问题。环磷酰胺作为免疫抑制剂可以抑制机体的体液免疫和细胞免疫,同时有研究表明一定剂量的环磷酰胺可使动物免疫功能受到抑制,于注射环磷酰胺第4天白细胞数量降到最低,而后可逐步恢复,并且不同剂量的环磷酰胺对于机体的免疫抑制作用存在差异[4]。目前环磷酰胺被广泛运用于动物免疫抑制模型的制备,并取得了较好的效果[5],故我们推测将环磷酰胺应用于病毒性肺炎小鼠模型的制备,极有可能使小鼠免疫受到抑制而更易于感染流感病毒。本研究将免疫抑制剂应用于流感病毒性肺炎小鼠模型的制备,并筛选出适宜的免疫抑制剂浓度,从而建立一个稳定的流感病毒性肺炎小鼠模型。
1 材料与方法
1.1材料
1.1.1实验动物 从湖南斯莱克景达实验动物有限公司购得昆明小鼠,雌雄各半,共120只;动物质量合格证号43004700016764;实验单位使用许可证编号SYXK(湘)2013-0005;许可证号SCXK(湘)2011-0003。
1.1.2病毒株及病毒攻毒量配制 流感病毒小鼠肺适应株(A型,IAV,A/PR/8/34),由湖南师范大学病毒研究室惠赠。经10日龄鸡胚尿囊腔接种培养传代,血凝效价1∶640以上者供试验用。将病毒尿囊液以灭菌生理盐水稀释成50 LD50/0.1 ml(MOI=2.0)置于冰袋中备用。
1.1.3药物制备 磷酸奥司他韦胶囊(瑞士罗氏公司,批号H20090377),环磷酰胺(索莱宝公司,批号302A034),按动物体表面积剂量换算法,磷酸奥司他韦胶囊21.63 mg/(kg·d)。
1.1.4主要试剂及设备 Trizol Reagent(北京百泰克,批号0020131114);ELISA试剂盒(上海晶天;批号20161108);HE染色试剂盒(索莱宝,批号20160831);BCA试剂盒(上海康为;批号00171509);ELX800-酶标仪(美国Bio-tek,ELX800);IHC试剂盒(艾佳生物;批号:01110317)。
1.2方法
1.2.1实验分组及干预方式 ①免疫抑制剂适宜剂量的筛选:分别用100 mg/(kg·d)、75 mg/(kg·d)、50 mg/(kg·d)的环磷酰胺经腹腔注射0.4 ml/只,1次/2 d,一共2次,于4 d后进行A型流感病毒滴鼻感染。建立免疫抑制剂环磷酰胺高(Cytoxan-H)、中(Cytoxan-M)、低(Cytoxan-L)剂量组、对照组(Control)和正常组(Sham),共使用小鼠40只。②流感病毒性肺炎小鼠模型建立:腹腔注射剂量为75 mg/(kg·d)的环磷酰胺0.4 ml/只,1次/2 d,一共2次。于4 d后进行A型流感病毒滴鼻感染。建立环磷酰胺单用组(Cytoxan)、病毒单用组(Virus)、环磷酰胺+病毒组(Cytoxan+ Virus)、正常组(Sham),共使用小鼠80只。
1.2.2脾指数 计算公式:脾指数=脾重量(mg)/小鼠体重(g)×10。
1.2.3ELISA法检测血清中IL-4的含量 采取眼眶取血的方式,采集小鼠的血液,静置5~10 min后,3 000 r/min离心15 min,取血清置-80℃冰存。用ELISA法检测各组小鼠血清中炎性因子IL-4的含量。
1.2.4肺、脾病理切片 取肺、脾组织,10%的中性甲醛固定、梯度脱水、二甲苯透明、石蜡包埋,间断连续5 μm厚切片,HE染色、脱水、透明、封片。光学显微镜下观察肺组织病理改变。

2 结果
2.1免疫抑制剂适宜剂量的筛选结果
2.1.1各组小鼠一般情况的比较 如图1A和图1B所示,免疫抑制剂各剂量组和对照组平均每日体重增长量下降,脾指数增大,与正常组比较,差异有统计学意义(P<0.05或P<0.01)。如表1所示,各组死亡情况显示环磷酰胺高剂量组死亡数量最多,中剂量组与低剂量组次之,对照组与正常组小鼠未出现死亡。
2.1.2各组小鼠肺组织病理变化的比较 如图2所示,免疫抑制剂各剂量组和对照组肺泡结构损伤严重,明显肺泡间质增宽,充血、水肿伴大量炎症细胞浸润,与正常组比较,差异显著;其中免疫抑制剂高、中剂量组中的炎症表现较对照组与低剂量组严重,低剂量组的肺部炎症程度与对照组无明显的差异。

图1 各组小鼠平均每日体重增长量、脾指数的比较Fig.1 Average daily weight gain and spleen index in miceNote: Vs sham,*.P<0.05,**.P<0.01.
表1环磷酰胺对小鼠死亡情况的影响(只)
Tab.1Effectofcyclophosphamideondeathofmice(n)

GroupsMean of interventionFatalityMortalityShamNS00/8ControlVirus00/8Cytoxan-LCytoaxn+Virus22/8Cytoxan-MCytoaxn+Virus22/8Cytoxan-HCytoaxn+Virus55/8
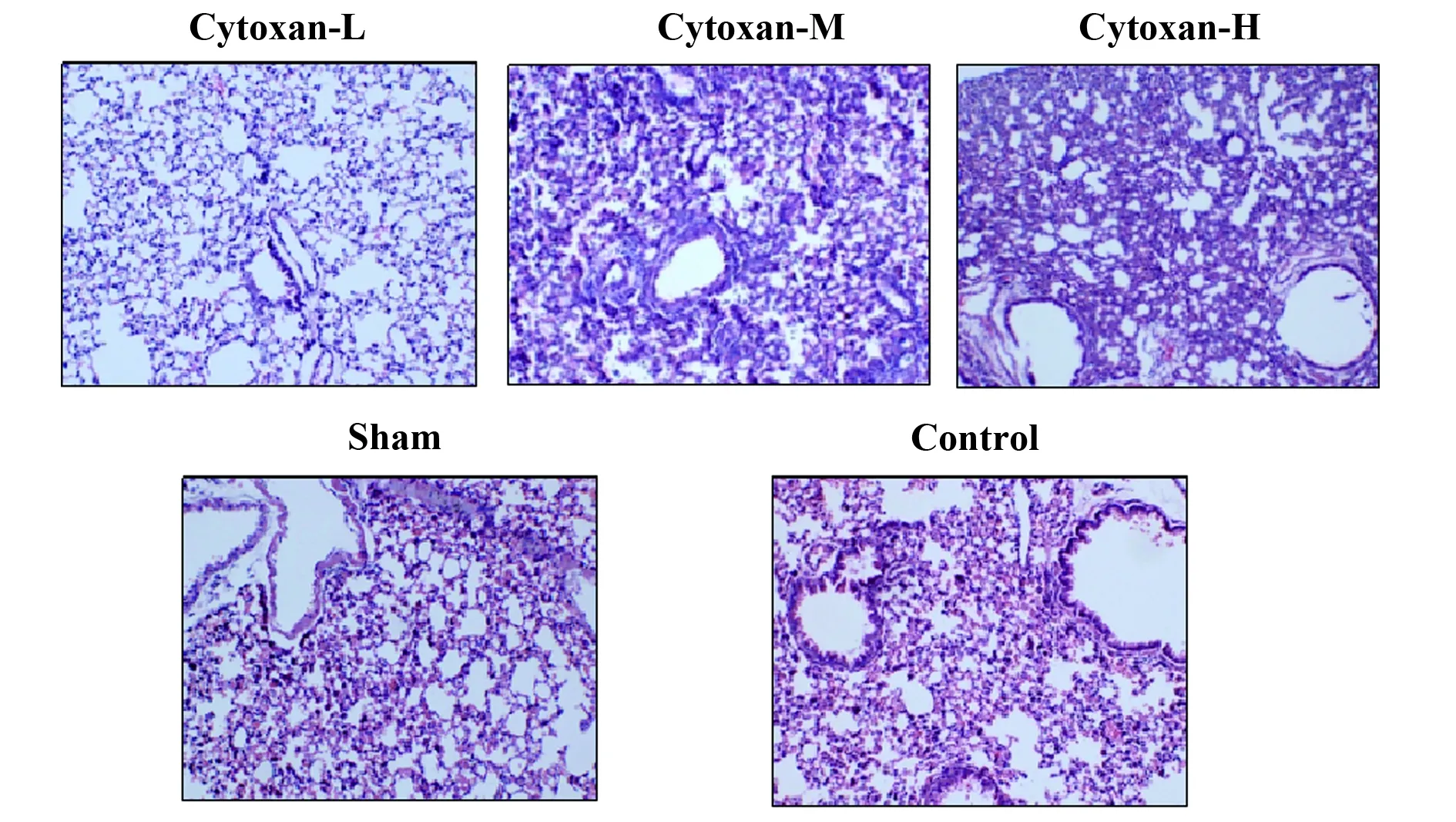
图2 各组小鼠肺组织病理变化的比较(HE染色,×200)Fig.2 Comparison of pathological changes of lung tissue in each group(HE,×200)
2.1.3各组小鼠脾组织病理变化的比较 脾脏实质分为白髓、红髓和边缘区。如图3所示,正常组脾索由富含血细胞的淋巴组织构成,脾索之间可见脾窦,脾小体边界明显,生发中心清晰可见;对照组中可见红髓增宽充血,淋巴细胞增多,并伴有大量多核巨细胞浸润,而脾小体边界仍较为清晰;环磷酰胺低剂量组可见脾小体边界不清,红髓增宽充血;环磷酰胺高、中剂量组红髓中有大量的淋巴细胞细胞浸润,红髓增宽明显,脾小体边界不清,其中高剂量中淋巴细胞更为弥散,甚至脾小体消失,与对照组相比差异显著,与同期脾重增加相对应。
2.1.4各组小鼠血清IL-4表达情况的比较 如图4所示,免疫抑制剂各剂量组和对照组小鼠肺组织中IL-4表达减少,与正常组比较,差异有统计学意义(P<0.05);但免疫抑制剂各剂量组IL-4表达量,与对照组比较,差异无统计学意义。

图3 各组小鼠肺组织病理变化的比较(HE染色,×100)Fig.3 Comparison of pathological changes of spleen tissue in each group(HE,×100)

图4 各组小鼠血清IL-4含量的比较Fig.4 Comparison of IL-4 expression in lung tissue of miceNote: Vs sham,*.P<0.05.
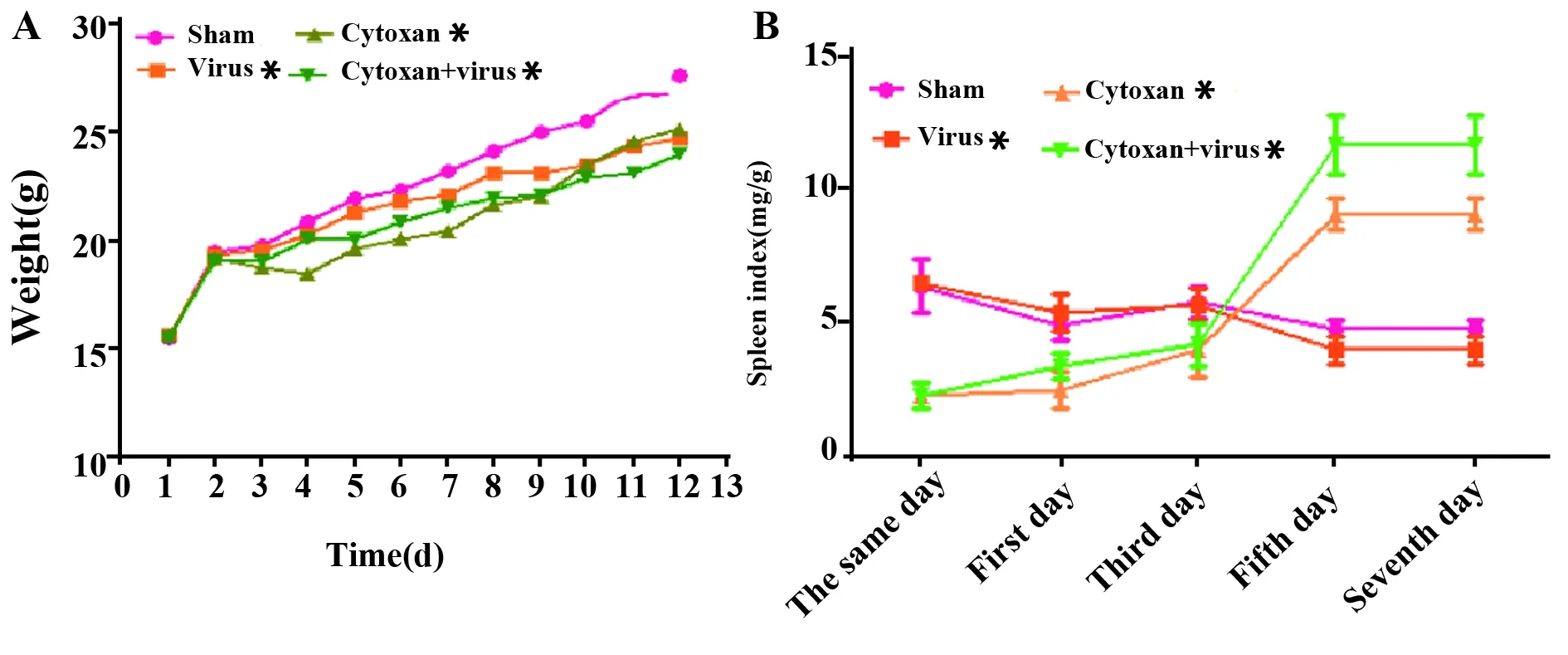
图5 各组小鼠体重比较Fig.5 Weight and spleen index comparison of mice in each groupNote: Vs sham,*.P<0.05.

图6 各组小鼠肺组织病理变化的比较(HE染色,×200)Fig.6 Comparison of pathological changes of lung tissue in each group (HE,×200)
2.1.5免疫抑制剂适宜剂量的筛选结果 综合上述结果,且根据免疫抑制剂环磷酰胺的药物毒性和最少用药原则,本研究拟选择环磷酰胺中剂量组的用药剂量75 mg/(kg·d)为造模免疫抑制剂适宜剂量。
2.2流感病毒性肺炎小鼠模型建立的结果
2.2.1各组小鼠一般情况的比较 如图5A所示,流感病毒和环磷酰胺能不同程度抑制小鼠体重的增长,与正常组比较差异有统计学意义(P<0.05),两者合用更为显著。如图5B所示,环磷酰胺能一定程度抑制免疫器官脾的功能,体现在脾指数下降,与正常组比较,差异有统计学意义(P<0.05),而自感染病毒后第3天起脾指数升高甚至高于正常组,与感染病毒当天比较,差异有统计学意义(P<0.05),可能与病毒感染后引起脾脏增生有关。
2.2.2各组小鼠肺组织病理变化的比较 如图6所示,环磷酰胺+病毒组与病毒单用组的肺组织中均有支气管炎症浸润,上皮增生脱落,肺泡间质增宽,并伴大量炎症细胞浸润,与正常组比较,差异显著。其中环磷酰胺+病毒组的炎症浸润与肺泡结构损伤均较病毒组严重;环磷酰胺单用组与正常组肺组织无明显差异。
2.2.3各组小鼠脾组织病理变化的比较 如图7所示,病毒感染当天(即环磷酰胺注射第4天),环磷酰胺组与环磷酰胺+病毒组,脾小结显著收缩,同时细胞数量降低且结构分界不清,生发中心不明显,与病毒组和正常组差异显著,与同期小鼠脾重显著下降相对应。于病毒感染第7天,环磷酰胺+病毒组红髓中有大量的淋巴细胞细胞浸润、弥散,红髓增宽明显,脾小体边界不清,与环磷酰胺单用组差异显著,且大量的多核巨细胞浸润与病毒组相比差异显著,这与同期小鼠脾重显著增加相对应。

图7 于感染病毒当天和第7天各组小鼠肺组织病理变化的比较(HE染色,×100)Fig.7 Comparison of pathological changes of spleen tissue at same day and seventh day (HE,×100)

图8 各组小鼠血清中IL-4含量的比较Fig.8 Comparison of IL-4 expression in serum of miceNote: Vs sham,*.P<0.05.
2.2.4各组小鼠肺血清中IL-4表达情况的比较 如图8所示,环磷酰胺可使小鼠IL-4表达增加,表现为感染病毒当天环磷酰胺+病毒组与环磷酰胺单用组IL-4的表达低于正常组,差异有统计学意义(P<0.05)。环磷酰胺+病毒组与环磷酰胺单用组IL-4的表达于感染病毒后逐渐增高,于第3天后,IL-4表达水平与正常组相比,差异无统计学意义(P>0.05)。
3 讨论
由于动物对于流感病毒具有天然的免疫力,使得流感病毒性肺炎动物模型的建立有一定的难度,然而流感病毒性肺炎是临床上高发的一种疾病,所以免疫抑制模型制备的研究有其必要性[6]。环磷酰胺是目前临床上常用的抗肿瘤药物和细胞毒性药物,是一种免疫抑制剂,并广泛地运用于动物免疫抑制模型的制备[7]。环磷酰胺具有细胞毒性,并可抑制机体的免疫功能,但短期用药可使机体免疫功能短暂抑制并得到很快恢复[8]。
在免疫抑制剂适宜剂量的筛选实验结果中发现,注射不同浓度的免疫抑制剂可使小鼠体重增长减慢甚至下降,其中小鼠的死亡情况,以及小鼠肺炎的严重程度都与注射的环磷酰胺浓度成正相关。这一结果表明免疫抑制剂环磷酰胺可使小鼠更易于感染流感病毒而患病毒性肺炎甚至死亡,然而环磷酰胺本身也具有一定的药物毒性可进一步造成小鼠死亡情况的发生。由脾脏的病理结果可以看出,实验组与对照组中红髓明显增宽,体现为同期脾指数的增大,而脾小体缩小,淋巴细胞减少,这体现环磷酰胺的免疫抑制作用,在流感病毒的刺激下,脾脏中还可见到大量的多核巨细胞浸润,红髓中出现大量淋巴细胞弥散,其中高、中剂量组的脾脏病理改变皆明显于环磷酰胺低剂量组和对照组。环磷酰胺高、中剂量组的小鼠肺炎程度以及脾脏病理改变无明显差异,而环磷酰胺高剂量的小鼠死亡率明显高于环磷酰胺中剂量组,本研究目的是使小鼠感染流感病毒的同时,减少因为环磷酰胺的毒副作用而引起的小鼠死亡情况;故可得出环磷酰胺中剂量[75 mg/(kg·d)]更适合于该模型的制备。流感病毒性肺炎小鼠模型建立的实验结果中发现,注射环磷酰胺后小鼠的脾指数下降,在病理结果表现为脾小结显著收缩,同时淋巴细胞数量降低且结构分界不清,生发中心不明显,这与环磷酰胺的免疫抑制作用有关,于感染流感病毒后第3天起,脾指数可逐渐恢复甚至高于正常水平,第7天脾脏病理表现为红髓大量的淋巴细胞浸润,弥散,增宽明显,脾小体缩小,边界不清,多核巨细胞增多,这是由于脾脏受到免疫抑制而脾小体缩小,与空白组和病毒单用组差异显著,又因为在流感病毒的刺激下使得红髓中淋巴细胞代偿性增多、弥散,与环磷酰胺单用组相比差异显著,红髓是脾脏免疫应答的主要场所。而感染病毒的当天和感染病毒后第1天IL-4的表达均小于正常组与病毒单用组,随后呈逐渐上升的趋势,于感染病毒后第5天,环磷酰胺单用组IL-4的表达量接近正常,说明停止注射环磷酰胺后不影响机体IL-4的表达。环磷酰胺+病毒组的炎症浸润与肺泡结构损伤最为严重,可见环磷酰胺可以使小鼠的免疫功能短暂地受到抑制,停止给予免疫抑制剂后免疫功能可逐渐恢复,这一方面有利于小鼠感染流感病毒;另一方面停止给予环磷酰胺后小鼠的免疫功能很快得以恢复,从而可用于药物的筛选。
综上所述,应用浓度为75 mg/(kg·d)的环磷酰胺作为免疫抑制剂,可使小鼠暂时处于免疫抑制状态,再进行流感病毒攻毒,使小鼠更容易感染流感病毒,有利于得到完整且稳定的流感病毒性肺炎小鼠模型。

