shRNA干扰长链非编码RNA PVT1对甲状腺乳头状癌IHH-4细胞增殖、凋亡和周期的影响①
常 亮 袁红敏 赵立言 马明德
(河南大学淮河医院乳腺甲状腺外科,开封475000)
甲状腺癌是最常见的内分泌恶性肿瘤,近20年来发病率呈逐年上升的趋势[1,2]。甲状腺癌分为甲状腺乳头状癌(Papillary thyroid carcinoma,PTC)、甲状腺滤泡癌和甲状腺未分化癌3种类型[3]。其中,PTC占所有甲状腺癌发病的80%~90%[4]。经过手术、放化疗等治疗后,大多数PTC患者预后较好,但仍有近30%患者会出现淋巴转移,出现转移后生存率仅51%[5,6]。家族遗传、辐射和碘的异常摄入是诱导PTC的主要因素[7,8]。近年来研究表明,基因不稳定和基因异常表达在PTC发病过程中发挥了重要调控作用[9]。长链非编码RNA (Long non-coding RNA,LncRNA)PVT1(Plasmacytoma variant translocation 1)在多类癌细胞中呈高表达状态,在调控癌症发生发展过程中发挥重要作用[10,11]。但其对PTC细胞增殖、凋亡及周期的影响还较少见报道。本文以PTC细胞IHH-4为研究对象,探讨下调PVT1表达对PTC细胞增殖、凋亡和细胞周期的影响,以期为临床PTC的治疗研究提供新的思路。
1 材料与方法
1.1材料 RPMI1640培养液、胎牛血清购自美国Gibco公司。Trizol试剂购自美国Promega公司。逆转录试剂盒和实时定量PCR试剂盒购自美国ThermoFhisher公司。CCK8试剂盒购自武汉默沙克生物技术公司。PI染色液和FITC-Annexin V购自美国BD公司。抗Ki67、Caspase-3和Cyclin A一抗购自英国Abcam公司。HRP标记山羊抗小鼠二抗购自北京博奥森生物科技公司。PVT1 shRNA由汉恒生物科技公司设计合成,慢病毒包装也由汉恒生物科技公司完成。PTC细胞株IHH-4购自中国科学院细胞库。
1.2方法
1.2.1细胞培养及转染 用含有10%胎牛血清的RMPI1640培养液将IHH-4细胞培养于37℃、5% CO2饱和湿度的恒温培养箱中,待细胞融合率达到85%时进行传代培养。
转染前24 h将细胞以1×105传代培养于24孔板中。将细胞分为IHH-4组、sh-Ctrl组和sh-PVT1组,每组6个复孔。第2天 sh-PVT1组加入用完全培养液稀释的慢病毒稀释液构建PVT1低表达的IHH-4细胞,sh-Ctrl组加入不含目的基因的慢病毒,IHH-4组则加入正常培养液。转染24 h后更换为正常培养液,继续培养48 h后进行检测。
1.2.2动物分组及甲状腺乳头癌肿瘤移植模型复制 36只裸鼠由昆明中国科学院动物研究所提供,许可证号SCXK(滇)K2015-0003。将36只裸鼠随机分为IHH-4组、sh-Ctrl组和sh-PVT1组,分别取转染后的细胞,将细胞密度调整至2×107个/ml,于裸鼠右前背部皮下注射IHH-4细胞,连续饲养25 d,每天用游标卡尺测量肿瘤生长情况,计算肿瘤体积(肿瘤体积=长×宽×高/2)。
1.2.3取材 连续饲养裸鼠25 d后,腹腔注射过量10%水合氯醛处死裸鼠,并立即取出肿瘤,将肿瘤组织置于-20℃保存备用。
1.2.4RT-PCR检测PVT1的表达 用Trizol试剂提取各组细胞总RNA,用反转录试剂盒合成cDNA,用实时定量PCR试剂盒检测PVT1表达量,以GAPDH为内参。所用到的引物序列如下:PVT1上游引物:5′-TGAGAACTGTCCTTACGTGACC-3′,下游引物:5′-AGAGCACCAAGACTGGCTCT-3′;GAPDH上游引物:5′-GGGTGGAGCCAAACGGGTC-3′,下游引物:5′-GGAGTTGCTGTTGAAGTCGCA-3′。
1.2.5CCK8检测细胞增殖 用sh-PVT1转染细胞24 h后,将细胞传代培养于96孔板中,每组6个复孔,分别培养0、1、2、3和4 d后,小心吸去细胞上清液,每孔加入10 μl CCK8试剂,于培养箱继续孵育4 h 后,用酶标仪检测细胞吸光度,测定波长为450 nm。
1.2.6流式细胞术检测细胞凋亡和细胞周期 用胰酶消化后收集细胞,将细胞密度调整为1×106个/ml,用结合缓冲液清洗细胞,重悬沉淀后加入FITC-Annexin V和 PI溶液,室温避光孵育15 min 后,用流式细胞仪检测细胞凋亡情况。
用胰酶消化后收集各组细胞,PBS清洗后,加入乙醇溶液于4℃固定30 min。30 min后加入预冷的PBS清洗细胞,加入PI溶液室温避光染色30 min,最后用流式细胞仪检测细胞周期分布情况。
1.2.7Western blot检测蛋白表达 用RIPA裂解液提取各组细胞总蛋白,BCA试剂盒检测细胞总蛋白浓度。每组取等量蛋白质用10%SDS-PAGE分离蛋白,转移蛋白至PVDF膜,TBST清洗3次后,5% 脱脂牛奶室温封闭2 h。封闭完成后加入适宜浓度一抗(Ki67,1∶1 200;Caspase-3,1∶1 000;Cyclin A,1∶1 000)于4℃封闭过夜,第2天小心吸走一抗,清洗PVDF膜后,加入相应二抗室温封闭1 h,滴加ECL显色液,用凝胶成像系统获取蛋白条带图片,用Image J对蛋白质表达量进行定量分析,以GAPDH为内参。

2 结果
2.1sh-PVT1对IHH-4细胞PVT1表达的影响 与sh-Ctrl组比较,sh-PVT1组IHH-4细胞PVT1表达水平明显降低(P<0.01,图1),差异有统计学意义,提示转染成功。
2.2sh-PVT1对IHH-4细胞增殖的影响 如图2所示,sh-PVT1转染细胞后4 d,与sh-Ctrl组比较,sh-PVT1组细胞增殖倍数显著降低(P<0.05,图2);同时,sh-PVT1组IHH-4细胞Ki67蛋白表达水平明显低于sh-Ctrl组(P<0.01,图3),表明沉默PVT1能抑制IHH-4细胞增殖。
2.3sh-PVT1对IHH-4细胞凋亡的影响 流式细胞术实验结果表明,sh-PVT1组IHH-4细胞凋亡率与sh-Ctrl组比较明显升高(P<0.01,图4);同时,sh-PVT1还能诱导细胞凋亡标志蛋白Caspase-3表达(P<0.01,图3),表明沉默PVT1能诱导甲状腺乳头状癌细胞凋亡。
2.4sh-PVT1对IHH-4细胞周期的影响 与sh-Ctrl组比较,sh-PVT1组G2/M期细胞比例明显增多,G0/G1期细胞比例有所减少,S期变化不明显,表明sh-PVT1可显著诱导IHH-4细胞G2/M期阻滞(P<0.05,图5);同时sh-PVT1还能显著抑制周期蛋白Cyclin A的表达(P<0.01,图3),提示沉默PVT1可诱导甲状腺乳头状癌细胞发生细胞周期阻滞。

图1 sh-PVT1对IHH-4细胞PVT1表达的影响Fig.1 Effect of sh-PVT1 on expression of PVT1 in IHH-4 cells Note: n=6,vs sh-Ctrl group,**.P<0.01.

图2 sh-PVT1对IHH-4细胞增殖的影响Fig.2 Effect of sh-PVT1 on cell proliferation of IHH-4 cells Note: n=6,vs sh-Ctrl group,*.P<0.05.
2.5sh-PVT1对肿瘤生长的影响 与IHH-4组比较,sh-Ctrl组裸鼠肿瘤大小无明显变化;与sh-Ctrl组比较,sh-PVT1组裸鼠肿瘤组织体积显著减小(P<0.01,图6),表明干扰PVT1表达能抑制甲状腺乳头瘤的生长。
2.6sh-PVT1对肿瘤组织蛋白表达的影响 Western blot实验结果表明,sh-PVT1能显著抑制甲状腺乳头瘤模型裸鼠肿瘤组织细胞增殖相关蛋白Ki67和细胞周期相关蛋白Cyclin A表达(P<0.01,图7),还可明显上调肿瘤组织细胞凋亡相关蛋白Caspase-3的表达水平(P<0.01,图7),提示sh-PVT1能抑制肿瘤组织细胞增殖,诱导细胞凋亡和细胞周期阻滞。

图3 sh-PVT1对Ki67、Caspase-3和Cyclin A蛋白表达的影响Fig.3 Effects of sh-PVT1 on expressions of Ki67,Caspase-3 and Cyclin ANote: GAPDH was used as loading control.n=6,vs sh-Ctrl group,**.P<0.01.

图4 sh-PVT1对IHH-4细胞凋亡的影响Fig.4 Effect of sh-PVT1 on cell apoptosis of IHH-4 cellsNote: n=6,vs sh-Ctrl group,**.P<0.01.

图5 sh-PVT1对IHH-4细胞周期的影响Fig.5 Effect of sh-PVT1 on cell cycle of IHH-4 cellsNote: n=6,vs sh-Ctrl group,*.P<0.05.
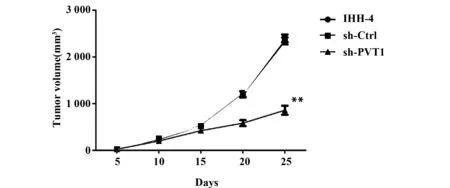
图6 sh-PVT1对肿瘤生长的影响Fig.6 Effect of sh-PVT1 on tumor growthNote: n=6,vs sh-Ctrl group,**.P<0.01.

图7 sh-PVT1对肿瘤组织Ki67、Caspase-3和Cyclin A表达的影响Fig.7 Effects of sh-PVT1 on expressions of Ki67,Caspase-3 and Cyclin ANote: n=6,vs sh-Ctrl group,**.P<0.01.
3 讨论
近年来大量研究表明,LncRNA在细胞生长和人类的疾病发展过程中发挥重要的调控作用[12]。LncRNA的异常表达与癌症的发生发展具有密切关系[13,14]。研究发现,LncRNA PVT1在正常细胞和组织中表达较少,但在胃癌、肝癌、宫颈癌及黑色素瘤等多种癌细胞中呈高表达状态,并可作为诊断癌症恶化的指标[11,15-17]。也有研究表明,PVT1在IHH-4、FTC-133和8505C三类甲状腺癌细胞系中表达水平明显升高[18]。本文研究也发现PVT1在IHH-4细胞中呈高表达状态,表明PVT1可能与甲状腺癌的发生发展密切相关。
调控癌细胞增殖是影响癌症发展的关键。研究表明,PVT1在肺癌细胞的高表达与肺细胞的异常增殖有关,抑制PVT1表达能明显抑制肺癌细胞增殖[19]。Iden等[10]研究发现,PVT1在121例出现癌症转移的宫颈癌患者癌组织中均呈高表达状态,表明PVT1与宫颈癌患者的预后密切相关。在本研究中,我们采用RNA干扰技术,设计合成sh-PVT1,用慢病毒将sh-PVT1转染入IHH-4细胞,采用RT-PCR检测PVT1的表达水平,发现sh-PVT1转染细胞后,IHH-4细胞PVT1表达水平显著降低,表明转染成功。sh-PVT1转染细胞后4 d,IHH-4细胞增殖倍数和肿瘤生长速度显著降低,同时sh-PVT1还能明显抑制IHH-4细胞和肿瘤组织细胞增殖标志蛋白Ki67的表达,表明抑制PVT1表达能抑制IHH-4细胞增殖。
研究表明,PVT1的促癌作用还与其抑制癌细胞凋亡有关。Wu等[20]研究发现,PVT1可通过下调Bcl-2家族蛋白Mcl-1的表达抑制肾癌细胞凋亡,还可通过上调凋亡蛋白Caspase-3和Caspase-9的表达抑制前列腺癌肿瘤的生长[21]。卵巢癌细胞对顺铂化疗抵抗性的形成与PVT1调控卵巢癌细胞凋亡有关[22]。但PVT1对甲状腺癌细胞凋亡的作用还未见报道。本研究发现,沉默PVT1可显著降低IHH-4细胞凋亡率,同时还能降低癌细胞和肿瘤组织Caspase-3的蛋白表达水平,表明下调PVT1表达能通过抑制Caspase-3的表达诱导PTC细胞凋亡。
细胞周期阻滞是导致细胞增殖抑制、细胞凋亡的主要原因之一。研究表明,LncRNA可参与癌细胞周期的调控。Marza等[23]研究发现,下调LncRNA GAS5表达可通过激活BRCA1和p53诱导成神经细胞瘤细胞周期阻滞,从而诱导癌细胞凋亡。沉默LncRNA Linc0015能诱导多种胃癌细胞系发生G1期阻滞,抑制癌细胞凋亡和转移[24]。也有研究表明,PVT1可通过靶向调控miR-26b表达抑制黑色素瘤细胞发生G0/G1期细胞周期阻滞[25]。本文研究结果表明,沉默PVT1表达能显著增加IHH-4细胞G2/M期的细胞比例,减少处于G0/G1期的细胞比例,对细胞S期无明显影响,表明sh-PVT1能诱导甲状腺乳头状细胞发生G2/M期阻滞。Cyclin A是一类真核细胞周期调控蛋白,主要参与G1-S期和G2/M期细胞周期调控[26,27]。研究表明,Cyclin A在甲状腺乳头状癌细胞中表达异常增多,表明Cyclin A可能通过调控细胞周期影响甲状腺癌的发展[28]。但PVT1是否能通过调控Cyclin A的表达影响IHH-4细胞周期分布还未知。本文研究表明,sh-PVT1能显著下调IHH-4细胞和肿瘤组织Cyclin A的蛋白表达水平,提示敲除PVT1可能通过抑制Cyclin A的表达诱导IHH-4细胞G2/M期周期阻滞。
综上所述,sh-PVT1能降低IHH-4细胞增殖倍数、抑制肿瘤生长、升高癌细胞凋亡率和细胞周期G2/M期细胞比例,并且还能抑制细胞增殖标志蛋白Ki67和周期蛋白Cyclin A的表达,上调Caspase-3表达水平,表明敲除PVT1能抑制甲状腺乳头状癌细胞增殖,并能诱导细胞凋亡和细胞周期阻滞,从而发挥抗PTC的作用。本研究初步探究了shRNA干扰PVT1对甲状腺乳头状癌的作用,后期将进一步探究具体作用机制。

