TNFAIP8(TIPE)抑制p53蛋白乙酰化促进宫颈癌增殖机制研究①
姜 杰 周玉明 姜 茹 王美蓉 杨明浩 赵培庆
(滨州医学院烟台附属医院检验科,烟台264199)
TIPE(Tumor necrosis factor-α-induced protein 8,TNFAIP8)基因家族是近期发现的一类新基因家族,与免疫和肿瘤发生密切相关[1]。该家族包括4个成员:TIPE(TNFAIP8)、 TIPE1(TNFAIP8L1)、TIPE2(TNFAIP8L2)和TIPE3(TNFAIP8L3)[2,3]。TIPE是第一个发现的TIPE基因家族蛋白,它在转移性头颈鳞状细胞癌中高表达,是细胞凋亡的负调节分子。随后发现其在包括胰腺癌、胃腺癌及子宫内膜癌等肿瘤中高表达,并可促进肿瘤增殖与迁移[4]。但到目前为止,还未发现其与宫颈癌的关系及可能的机制。
课题组前期研究发现,TIPE2在糖尿病及强直性脊柱炎等炎症性疾病中表达上调且与疾病状态密切相关[5,6];TIPE2可促进顺铂诱导的耐药骨肉瘤细胞凋亡增多,同时发现TIPE1可促进宫颈癌细胞增殖并抵抗顺铂诱导的细胞凋亡(结果待发表)。鉴于TIPE家族与炎症及肿瘤的高度相关性和成员之间功能不均一性,促使我们验证TIPE在宫颈癌中的表达及可能的致病机制。
1 材料与方法
1.1材料
1.1.1抗体及试剂 TIPE免疫组化抗体购自Abcam公司(Ab166804;Abcam,USA),即用型山羊超敏二步法超敏试剂盒购自中杉金桥(PV9003,#K1568220),DAB显色系统液体DAB酶底物显色试剂盒购自福州迈新生物技术有限公司(#DAB-0031/1031),细胞培养板购自Corning公司(Corning,USA),WB抗体TIPE、P53及Acetyl-P53(k373)购自Abcam公司(Ab166804,Ab26,Ab62376,respectiv-ely;Abcam,USA),多功能酶标仪为Thermofisher公司产品(VarioskanFlash,Thermo,USA),CCK8及细胞周期试剂盒购自上海碧云天生物科技公司(#C0038,#C1052),TIPE慢病毒干扰载体购自Santa cruz公司(sc-76698,Santa cruz,USA),人宫颈癌细胞系Siha购自中国科学院上海细胞生物研究所。
1.1.2病例来源 患者来自淄博市中心医院及滨州医学院烟台附属医院妇科手术患者且经病理确证为宫颈鳞状细胞癌患者,所有患者皆符合本院伦理委员会制定的伦理学标准,并得到该委员会批准启动,其中Ⅰ、Ⅱ期患者45例,Ⅲ、Ⅳ期40例。最后根据患者TIPE表达水平分析生存期并绘制Kaplan-Meier曲线。
1.2方法
1.2.1免疫组化分析 石蜡切片置于60℃烤箱烤片30 min,按操作说明脱蜡及水化;用微波进行抗原修复,然后用Tris-HCl缓冲液进行冲洗,PBS洗3次,每次5 min;3%双氧水-甲醇对内源性过氧化物酶进行封闭10 min,PBS洗3次,每次5 min;滴加TIPE抗体(1∶80),置于4℃冰箱过夜;用0.1%Tween-20 PBS洗3次,每次5 min;然后滴加聚合物辅助剂,洗涤后滴加辣根酶标记抗山羊IgG多聚体,室温孵育15 min;0.1%Tween-20 PBS洗3次,每次5 min;最后进行DAB显色,苏木素进行复染,常规脱水透明,最后用中性树胶封片。免疫组化结果按着色强度进行综合评判,随机观察8~10个HPF,结果取均值。
1.2.2细胞培养 Siha细胞于含10%胎牛血清的DMEM培养基中(Gibco,Australia),置于37℃、5%CO2温箱中培养。
1.2.3克隆形成实验 Siha细胞转染干扰慢病毒及对照病毒颗粒后取对数生长期细胞,常规种6孔板(800个/孔),待细胞形成肉眼可见克隆(细胞数>50个)后0.1%结晶紫染色,置光学显微镜下观察并拍照。克隆形成率的计算按下列公式:克隆形成率=(克隆数/接种细胞数)×100%。
1.2.4绘制生长曲线 Siha细胞转染干扰慢病毒及对照病毒颗粒后,取对数生长期的细胞用含10%胎小牛血清得培养液配成单个细胞悬液,以每孔1 000个细胞密度接种到96孔板,每孔体积200 μl。第二天后每孔加CCK8溶液10 μl,继续孵育1 h,选择450 nm波长,在酶标仪上测定各孔光吸收值,记录结果。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.5细胞周期测定 Siha细胞转染干扰慢病毒及对照病毒颗粒后,离心收集细胞并用预冷PBS洗细胞2次。加入预冷70%乙醇,于4℃固定过夜,离心收集细胞,以1 ml的PBS洗细胞一次,加入500 μl PBS含50 μg/ml PI(溴化乙锭),4℃避光孵育30 min。用BD Aria2流式细胞仪进行检测,结果用细胞周期拟和软件ModFit进行分析。
1.2.6蛋白印迹实验 细胞转染含TIPE干扰慢病毒载体及空载体对照后,RIPA蛋白裂解液提取两组细胞总蛋白,酶标仪进行蛋白定量,SDS-PAGE 80 V恒压电泳,250 I恒流转膜3 h,5%脱脂奶粉封闭 1 h,然后分别与TIPE、p53、p21抗体4℃冰箱孵育过夜(稀释比例TIPE1 1∶500,p53和p21为 1∶1 000),TBST洗膜3次,每次5 min钟后,与二抗室温作用1 h,ECL法显影曝光。以GAPDH为内参进行比照分析。
1.3统计学分析 采用Graphpad Prism5.0软件(GraphPad Software,San Diego,CA)进行统计学分析,数据采用T检验进行分析,单变量分析对数秩检验分析宫颈癌患者生存率,以P<0.05为差异有统计学意义。
2 结果
2.1宫颈癌患者肿瘤组织中TIPE高表达且与生存期负相关 如图1A、B所示,宫颈癌患者肿瘤组织中较癌旁组织TIPE表达明显上调,结果有统计学意义(P<0.001);同时患者按TNM分期分为两组,A组为Ⅰ、Ⅱ期患者共计45例,B组为Ⅲ、Ⅳ期患者共计40例。分析结果如图1C所示,A组TIPE表达量明显低于B组,差异有统计学意义(P<0.05),该结果提示TIPE可能也参与了宫颈癌的转移与侵袭过程。为更进一步探讨TIPE在宫颈癌中的意义,我们跟踪收集了40例宫颈癌患者5年总体生存率数据,结果如图1D所示,结果表明TIPE表达与生存率存在负相关(P<0.05),该结果进一步提示高表达的TIPE影响了宫颈癌患者的预后。

图1 TIPE在宫颈癌组织中高表达且与预后负相关Fig.1 TIPE is highly expressed in cervical cancer tissues and negatively correlated with prognosis

图2 TIPE促进宫颈癌细胞Siha增殖Fig.2 TIPE promotes Siha cells proliferation
2.2TIPE明显促进宫颈癌细胞系Siha的增殖能力
结果如图2A、2B所示,克隆形成实验显示转染TIPE干扰病毒组较空载体组其克隆形成能力显著下降(P<0.001),表明TIPE对宫颈癌细胞增殖具有明显促进作用。同时,采用生长曲线实验检测转染TIPE干扰慢病毒后Siha细胞的增殖能力,结果如图2C所示,提示其对细胞增殖亦明显促进,差异有统计学意义(P<0.001)。
2.3TIPE促进Siha细胞S期比值 结果如图3所示,转染TIPE干扰病毒组较正常对照组,细胞周期中S期比值明显下调(P<0.01),G0/G1期及G2/M期则上调,特别是G0/G1期阻滞明显,表明TIPE促进宫颈癌细胞的增殖过程。
2.4TIPE抑制p53乙酰化及其下游分子p21的表达 结果如图4所示,TIPE可抑制p53蛋白乙酰化水平,同时转染TIPE干扰病毒后其下游分子p21表达上调,表明TIPE可能通过抑制p53蛋白乙酰化水平后,从而间接抑制其下游分子p21的表达。

图3 TIPE明显增高Siha细胞S期比值Fig.3 TIPE significantly increased the ratio of S phase in Siha cell
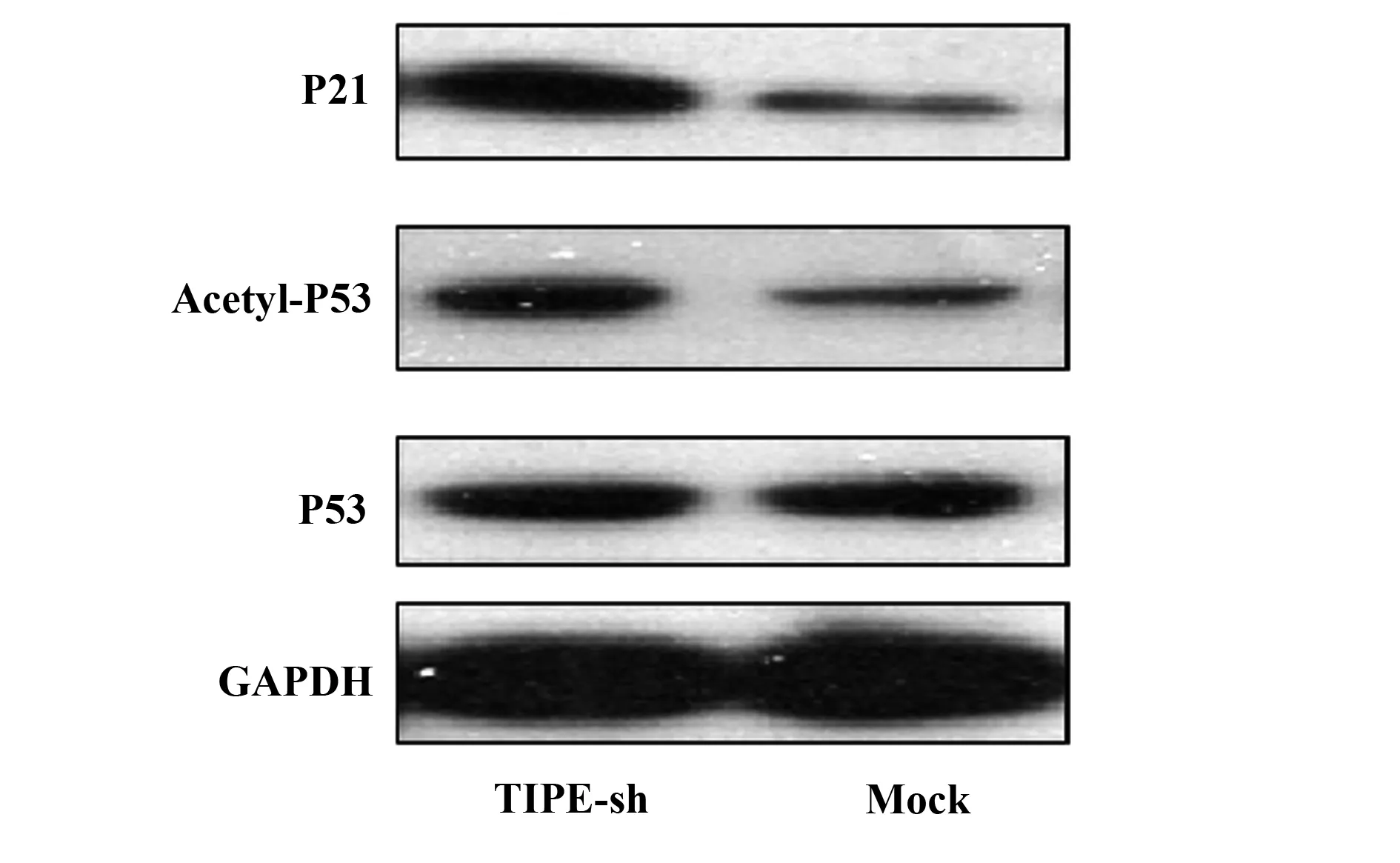
图4 TIPE抑制p53乙酰化并抑制其下游分子p21的表达Fig.4 TIPE inhibits p53 acetylation and inhibits expression of p21
3 讨论
宫颈癌是最常见的女性生殖道恶性肿瘤,特别是在发展中国家,其全球癌症发病率中高居第4位,是女性癌症主要死亡原因之一。其每年新发病例约53万人,死亡人数可达27万[7]。全球约85%的宫颈癌死亡人数发生在不发达国家或发展中国家,许多欠发达国家的宫颈癌3~5年生存率不足50%[7]。因此阐明其发病机制、发现新型诊断及治疗靶点刻不容缓。
TIPE的表达水平与肿瘤的增殖、浸润及淋巴结转移(TNM)正相关,例如在食管癌鳞状细胞癌、胰腺癌、胃腺癌等肿瘤中[8-10],高表达水平的TIPE可导致细胞过度增殖和细胞迁移增加。本研究中,我们发现宫颈癌组织中TIPE表达水平较癌旁组织显著增高,提示TIPE可能参与了宫颈癌的发生发展过程。同时TIPE高表达组(++、+++)生存率远低于低表达组(-、+),提示TIPE可作为预示宫颈癌预后的分子标志物,并可能在宫颈癌的转移与复发中发挥关键作用。同时表明TIPE可成为宫颈癌靶向治疗的重要靶点,也将成为宫颈癌早期诊断与预后的重要分子。有研究证明,TIPE蛋白由NF-κB活化诱导,是其抗细胞凋亡、促进细胞增殖的分子机制之一[11]。TIPE表达降低可导致血管内皮生长因子受体-2(VEGFR-2)和基质金属蛋白酶1和9(MMP1和MMP9)表达下调[12]。另外,TIPE可通过Gβγ亚基与Gαi蛋白直接互相作用,参与Gi介导的细胞凋亡抑制[13]。同时,敲除TIPE基因加重葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎模型,可能的机制是TIPE降低了化学品表面上皮细胞的存活[14]。本研究中,发现TIPE可明显促进宫颈癌细胞系Siha的增殖能力及增加Siha细胞S期比值,表明TIPE可通过降低G0/G1期阻滞,促进宫颈癌细胞增殖。有研究已经提示TIPE可能与p53蛋白互相作用[15],但没有确切的及更深入的机制研究,本实验发现p53乙酰化水平在转染TIPE干扰慢病毒后升高,且下游分子p21表达上调,提示TIPE可能通过抑制p53乙酰化水平,从而导致p21蛋白表达下调。p21基因亦称CDKN1A,主要功能为调控细胞周期捕获。当细胞暴露于生存压力下时,p53基因被激活并启动Cdk抑制剂p21的转录,p21结合细胞周期蛋白E1/Cdk2和细胞周期蛋白A2/Cdk2复合物并使其失活,导致pRb低磷酸化和细胞周期停滞于G1期[16,17]。本研究结果提示TIPE通过抑制p53蛋白活性,从而导致p21表达下调,进而影响宫颈癌细胞的增殖与细胞周期。
总之,我们的研究结果表明TIPE可成为宫颈癌靶向治疗的重要靶点及早期诊断与预后的重要分子,也提示我们继续探讨TIPE在宫颈癌发生发展中发挥生物学作用的其他机制。

