低氧诱导因子在肿瘤中的表达
李鑫,王凯宇,姜洋,安彩艳
(1.内蒙古大学生命科学学院,内蒙古呼和浩特 010021;2.内蒙古医科大学附属医院临床医学研究中心,内蒙古呼和浩特 010050)
低氧诱导因子(HIFs)是一种调控与氧有关的转录激活因子,在系统和细胞水平的稳态变化中起着中心调控作用,目前已发现HIF1、HIF2和HIF3。肿瘤细胞因其快速增殖、能量供应不足,导致缺氧微环境的产生,肿瘤中的缺氧可促进血管生成异常、去毛细胞增生和炎症。肿瘤细胞还能促进选择具有更恶性表型的癌症细胞,促进肿瘤进展和转移,从而作为疾病结局的指标。低氧肿瘤细胞也对放疗和大多数化疗有抵抗作用。肿瘤除了肿瘤细胞外,还包括间质细胞和细胞外基质(ECM),它们也受到低氧环境的影响[1]。越来越多的研究强调了肿瘤微环境在调控肿瘤进展和扩散方面的重要性[2],肿瘤细胞可通过启动一系列低氧适应性反应来调节和适应缺氧环境。许多研究已经确定了HIFs在各种癌细胞中的高表达,并且发现它与肿瘤的生物学行为密切相关。HIFs在肿瘤起始、代谢适应缺氧、凋亡抵抗、肿瘤干细胞生长、炎性细胞招募、血管生成和转移等方面有重要的作用[1,3],使其更有利于生存,从而促进了肿瘤的发展,导致了缺氧和恶性进展的恶性循环。本文对低氧诱导因子以及其参与肿瘤的血管生成、代谢、增殖等过程进行了阐述。
1 HIFs的发现
HIF-1α是HIF转录因子家族的第一个成员,1992年Semenza和Wang通过其作为促红细胞生成素的转录激活物而发现[4],随后发现它控制着整个身体的细胞内缺氧反应。HIF-1α普遍存在于人和哺乳动物细胞内,在常氧条件下(21%O2)也有表达,但合成的HIF-1α蛋白很快降解,只有在缺氧条件下才可稳定表达。HIF-1α之后又发现了HIF-2α,称为内皮pas域蛋白1(EPAS1),它与HIF-1β亚基结合形成HIF-2异二聚体[5]。虽然HIF-1α和HIF-2α有着高度的序列相似性和类似的蛋白质结构[6-7],但与HIF-1α的普遍存在相反,HIF-2α只在特定的细胞类型和肿瘤类型中表达,并介导不同的信号通路,具有相反的功能[8]。HIF-3α是HIF的最新成员,与其他两个同系物相比,人们对HIF-3α知之甚少。然而一些最近的研究表明,HIF-3α有多个变体[9]。HIF-3存在一个剪接变异体,被称为抑制PAS(Inhibitory PAS,IPAS),主要表达于小脑的浦肯野细胞和角膜上皮中。这对维持角膜中的无血管表型至关重要[10]。IPAS不具有内源性转录活性,但它也可以和HIF-let氨基末端区域作用,从而阻止其DNA结合,发挥HIF-let负性调控子的作用。但也有数据表明,HIF-3在某些情况下也可以作为转录激活剂[11]。
2 HIF的结构与作用机理
HIFs是由α亚基(HIF-1α、HIF-2α、HIF-3α)和β亚基(HIF-1β、HIF-2β、HIF-3β)组成的异二聚体。α亚基是HIF DNA结合和转录活性的主要决定因素,受到缺氧信号的调节。三个α亚基都包含氧依赖性降解区域(Oxygen-dependent degradation domain,ODD)和N端反式激活结构域(N-transactivation Domain,N-TAD),HIF-1α 和 HIF-2α也包含一个C端反式激活结构域(C-transactivation Domain,C-TAD)[12]。β亚基也叫芳香烃受体核转运子(Aryl hydrocarbon re-eptor nuclear translocator,ARNT),在细胞核中表达,活动不受缺氧的影响[13-14]。这两个亚基同属于螺旋-环-螺旋(basic-he-lix-loop-helix-Per/Amt/Sim,bHLH-PAS)蛋白家族[15]。
目前,对HIF1α与HIF2α的作用机理研究的比较广泛,在常氧条件下,HIF-1α亚基进行C-TAD的天冬氨酸残基羟基化,降低了其转录活性[16];或者在ODD的多肽序列内的保守性脯氨酸残基被脯氨酰羟化酶结构域(Prolyl hydroxylase domain,PHD)蛋白发生氧依赖的脯氨酰羟化[17],并通过肿瘤抑制蛋白(Von Hippel-Lindau,pVHL)介导的泛素-蛋白酶体通路降解[18]。因此,HIF-1α持续表达并快速降解,维持在一个很低的水平之内。然而在低氧条件下,脯氨酰羟化和蛋白酶体降解被抑制,导致HIF-1α的稳定和积累,HIF-1α亚基被转移到细胞核中,与HIF-1β相结合,HIF复合物与氧调节基因启动子区域的缺氧反应元件(HRE)结合,导致其转录激活,进而激活大量下游靶基因。这些靶基因都参与了肿瘤细胞对缺氧条件的适应,并通过诱导血管生成、局部浸润和转移传播等方式促进肿瘤的发展[19]。
3 HIFs对肿瘤细胞的作用与影响
低氧肿瘤微环境是许多实体瘤组织的关键特征[20]。大多数实体肿瘤如正常的组织一样,需要定期供应氧气和营养物质,以及消除细胞代谢废物的过程。但随着肿瘤的不断扩大,宿主血管供应不足,于是肿瘤发展自己的功能性血管供应。但新形成的肿瘤血管不仅紊乱,而且还伴随许多结构和功能异常[21],因此,它仍然无法满足肿瘤生长的所有需求(尺寸为2~3mm),于是在肿瘤内部形成了一种以缺氧为主的恶性微环境,虽然缺氧对肿瘤细胞生长有一定的影响,但一系列抗低氧蛋白的诱导能够保护细胞免受侵害,HIFs是协调这种保护作用最主要的转录因子[22]。HIFs通过减少氧气消耗和增加氧气供应来调控许多帮助细胞适应缺氧条件的基因的表达。一般来说,这包括刺激血管生成基因以增加流向缺氧区域的血管流量[23],将能量代谢转化为需要较少氧的糖酵解途径和扰乱细胞周期使其细胞增殖不受控制等。HIFs可以上调各种下游靶基因表达以及蛋白质的生物合成,如红细胞生成、糖酵解、EMT、转移、血管生成和治疗抵抗[24-28],这不仅提高了肿瘤的生存潜力,而且还能增加它们的侵袭性和转移性[29],其介导的信号通路如图1所示。
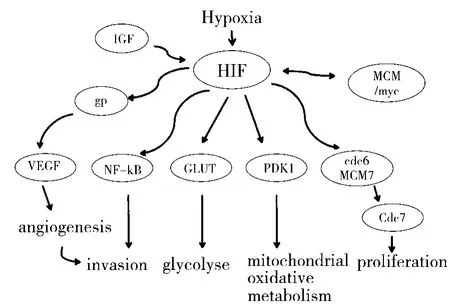
图1 缺氧条件HIF调控基因的信号通路
3.1 HIFs对肿瘤血管生成与转移的影响
氧是正常组织中必不可少的营养物质,也是促进肿瘤扩散转移的重要因素。在缺氧微环境中,由于缺氧诱导因子高表达,导致血管生长因子(Vascular growth factor,VGF)上调,进而引起血管生成的一系列过程[30-31]。血管内皮生长因子(Vascular endothelial growth factor,VEGF)是最重要的血管生成因子,许多研究表明,VEGF在促进骨、肺、肾、脑、血管内皮细胞、肿瘤和其他组织的增殖、迁移和趋化反应方面起着重要作用[32-36]。VEGF在正常组织中表达非常低或缺失,但在许多恶性肿瘤如卵巢癌、乳腺癌、胃癌、膀胱癌中表达较多[37]。VEGF的表达水平与晚期肿瘤分级、恶性肿瘤及肿瘤组织血管发生呈正相关[38]。肿瘤细胞表达高水平的VEGF和VEGF受体2(VEGFR2)诱导血管内皮细胞的生长,内皮细胞的增殖和新血管的形成[39]。除了VEGF外,其他血管生成相关的基因产物和受体也受HIF-1的调控。胰岛素样生长因子1(Insulin-like growth factor,IGF1)能够通过激活HIF-1α/VEGF信号通路促进肿瘤血管生成,最近研究表明,IGF1/IGF1R激活ERK1/2和AKT信号进而激活HIF-1α/GPER/VEGF转导通路诱导乳腺肿瘤血管生成[40]。G蛋白雌激素受体(G protein estrogen receptor,GPER)是新发现的HIF-1α靶基因,在缺氧乳腺肿瘤微环境参与调节VEGF[41-42]。还有研究表明,HIF-1α能通过NF-κB通路促进肝癌细胞的迁移和入侵[43],并且HIF-1α还可以上调上皮间充质过渡相关转录因子(EMT-TFs),并对抗 p53[44-45]。因此,HIF-1不仅通过VEGF诱导介导血管生成,加速细胞的扩散与侵袭,以及癌细胞向转移表型的转移[3],而且通过更复杂的机制影响肿瘤的发展。
3.2 HIFs对肿瘤代谢过程的影响
为了促进合成代谢过程,肿瘤细胞消耗的葡萄糖比正常细胞要多得多,并且主要通过糖酵解代谢,甚至在富氧条件下,代谢表型通常为有氧糖酵解或Warburg效应[46]。在正常分化的哺乳动物细胞中,葡萄糖通过糖酵解、线粒体三羧酸(TCA、Krebs)循环和氧化磷酸化(OXPHOS)的方式分解为CO2。然而在肿瘤细胞中,因为线粒体氧化大大减少,葡萄糖主要是由糖酵解作用被消化吸收,只有大约5%的葡萄糖通量进入线粒体,通过TCA循环和OXPHOS氧化。HIF-1介导葡萄糖转运蛋白(GLUT1、GLUT3)和糖酵解酶(ALDOA、ENO1、GAPDH、HK1、HK2、PFKL、PGK1、PKM2和 LDHA)的基因表达,提高糖酵解速率,并且产生大量的乳酸,酸化癌细胞的微环境,更加促进了癌细胞的增殖、侵袭和迁移等能力[47-48]。HIF-1还通过增加丙酮酸脱氢酶激酶1(PDK1)的表达,抑制线粒体氧化代谢[49]。在某些细胞类型中,HIF-1还可以介导戊糖磷酸途径(PPP)的转肽酶(TKT、TKTL2)的表达[50]。通过信号转导通路,中间代谢与癌症生物学之间的联系变得越来越明显[51-53]。HIFs积极调控一系列糖酵解等细胞代谢有关的基因,有利于肿瘤细胞适应低氧应激。
3.3 HIFs对肿瘤细胞增殖的影响
有研究表明,多种癌细胞系在缺氧情况下,细胞周期阻滞,细胞增殖受到抑制[54-55]。然而,某些癌细胞在缺氧的情况下仍然可以维持细胞增殖[56]。HIF-1增强了细胞分裂周期蛋白6(Cell division cycle protein 6,Cdc6)和微小染色体维持蛋白(Minichromosome maintenance protein,MCM) 之间的物理相互作用,但减少了对激活细胞分裂周期蛋白7(Cell division cycle protein 7,Cdc7)和下游蛋白的招募,最终导致了DNA复制的减少,细胞周期阻滞。这些结果表明,HIF-1α通过对DNA复制机制的直接(负)效应,抑制细胞周期的进展。但MCM除了具有解旋酶的作用,多个MCM蛋白还可以与HIF-1α结合并抑制HIF-1α活性[57]。MCM7直接与HIF-1α和VHL泛素连接酶复合物的组成部分结合,从而提高HIF-1的氧依赖降解。从而提供了一种机制,通过这种增殖信号,HIF-1α和MCM蛋白质之间相互敌对的平衡,可以覆盖缺氧对细胞周期的影响[58]。还有一种解释是Myc(原癌基因)和HIF-1α之间存在一定的平衡,在决定细胞周期对缺氧的敏感性方面起作用。在高水平的Myc和HIF-1α的癌细胞中,这两个因素共同促进了编码糖酵解酶的靶基因的转录激活[59]。因此,通过中和HIF-1α对细胞周期的影响,同时促进HIF-1α介导的转录,从而促进肿瘤的生长。
4 讨论
缺氧是实体肿瘤的共同特征,与癌症进展有关。低氧反应的主要调控因子是HIFs,它通过基因激活引导细胞适应缺氧。癌症的进展不仅受癌细胞本身的调控,也受由细胞和细胞外成分组成的整个肿瘤微环境的调控[60]。低氧诱导因子(HIFs)介导自适应对缺氧的生理反应。在人类癌症中,可以使用O2电极测量,瘤内缺氧是常见的,并与增加的死亡风险有关。肿瘤细胞的特征是细胞增殖异常,而在实体瘤内形成的血管通常结构和功能异常,导致严重的缺氧[61]。在体内所遇到的各种环境压力往往会影响特定的遗传调控因子以促进细胞的存活。在缺氧条件下,当O2的可用性降低时,癌症细胞会激活HIFs诱导下有信号通路调节细胞的生长和代谢,但这种失调的机制和后果,从一个癌症到另一个,甚至从癌细胞到另一个癌症细胞都有很大的不同。在一些癌细胞中,O2仍然控制着细胞增殖的速率,而其他的细胞即使在严重的缺氧条件下仍会继续分裂,单个癌细胞的代谢反映了特定基因改变的存在,这可能会改变O2独立的人体内的代谢,以及在肿瘤微环境中O2的空间和时间的异质性。提高HIF-1α水平也能增加癌症死亡率的风险,包括膀胱、大脑、乳腺癌、结肠癌、食道癌、头部和颈部/口咽、肝、肺、胰腺、皮肤、胃癌、子宫以及在急性淋巴细胞和骨髓性白血病[62]。临床数据表明在某些癌症中,如肾透明细胞癌,HIF-2α超表达而HIF-1α经常基因缺失不表达[63]。在结肠癌中,HIF-1α超表达而HIF-2α不表达[64]。很明显,HIF转录因子的调控是一种复杂的方式,并受到除氧以外的许多因素的控制。
肿瘤干细胞在肿瘤的发生和发展中起着至关重要的作用[65]。目前,癌症研究的一个主要焦点是在肿瘤发生和治疗过程中,肿瘤干细胞的作用。这些细胞占活肿瘤细胞总数的1%~25%[66],它具有自我更新和分化的双重特性,但它们被认为是必须完全消除以获得肿瘤控制的细胞,缺氧和癌症干细胞之间可能存在联系[67]。缺氧可通过缺氧诱导因子的上调,使肿瘤干细胞产生和维持。有研究表示,缺氧时激活HIF-1诱导癌症干细胞样细胞,或介导乳腺癌细胞与间充质干细胞之间的旁分泌信号传导,促进转移[68-69]。

