miR-148b基因对高糖诱导的肾小球系膜细胞增殖、凋亡及免疫抑制因子的影响研究
汤夏莲 陈 平 唐义平 张 敏 曹晓红
(四川省医学科学院·四川省人民医院老年内分泌科,成都 610072)
糖尿病肾病(Diabetic nephropathy,DN)是常见的一种糖尿病微血管并发症,高血糖引起的肾小球系膜细胞的凋亡在DN发病过程中有重要作用,也是DN肾损伤的主要机制[1]。miRNA(microRNA)是一类单链的小分子RNA,约由19~25个核苷酸组成,不编码蛋白,在个体发育、细胞增殖、凋亡、分化及肿瘤形成等过程中发挥重要作用[2]。目前已发现多个miRNA影响DN的发生及发展,且肾小管上皮细胞、肾小球系膜细胞等的功能及结构也受到miRNA的调节[3,4]。miR-148b是miRNA大家族中的一员,目前关于miR-148b在DN中的研究较少,有研究发现,mTORC1的异常激活可通过抑制miR-148b-3p引起肾小球上皮细胞损伤或凋亡[5];miR-148b的异常表达可促进IgA肾病IgA1的异常糖基化[6],这提示miR-148b可能在DN的发生发展中发挥重要作用。本研究旨在观察抑制miR-148b表达对高糖诱导的肾小球系膜细胞增殖、凋亡及免疫抑制因子TGF-β1表达的影响,并进一步研究对其影响的可能分子机制,以期为DN的治疗提供理论基础。
1 材料与方法
1.1试剂和仪器 低糖、高糖培养基及胎牛血清均购自美国Gibco;miR-148b scramble和miR-148b inhibitor由广州瑞博生物科技有限公司设计并合成;CCK8试剂购自日本同仁研究所;RNA提取试剂盒及逆转录试剂盒均购自日本TaKaRa;Annexin V-FITC/PI细胞凋亡试剂盒购自南京凯基;TGF-β1、p-IκBα、cyclinD1、Bax抗体购自美国Abcam;Lowry蛋白定量试剂盒购自上海生工;实时荧光定量PCR仪购自美国ABI;酶标仪购自美国Bio-Rad;流式细胞仪购自美国BD。
1.2方法
1.2.1细胞及培养 小鼠肾小球系膜细胞(MMCs)购自美国菌种保藏中心(Manassas,VA)。复苏冻存在液氮罐中的MMCs细胞,复苏后的细胞在DMEM-F12培养液(含有10%胎牛血清及青链霉素双抗)中,置于5%体积分数的CO2培养箱中37℃常规培养,每天换液1次,细胞达80%左右生长融合时消化传代。实验为生长至对数期的细胞。
1.2.2实验分组及转染 分组:①低糖+miR-148b scramble组(LG组,5.6 mmol/L的葡萄糖处理细胞后瞬时转染miR-148b scramble);②高糖+miR-148b scramble组(HG组,30 mmol/L的葡萄糖处理细胞后瞬时转染miR-148b scramble);③高糖+miR-148b inhibitor组(HG+miR-148b inhibitor组,30 mmol/L的葡萄糖处理细胞后瞬时转染miR-148b inhibitor)。其中miR-148b scramble和miR-148b inhibitor的转染参照脂质体LipofectamineTM2000转染说明进行瞬时转染。转染前1 d以每孔3.6×105个细胞接种细胞于6孔板,细胞达80%~90%生长融合率时进行转染。收集转染后48 h的三组细胞用于后续实验研究。
1.2.3各组细胞miR-148b的表达检测 采用qRT-PCR法。利用Trizol法提取转染后48 h的三组细胞的总RNA,用Oligo6.0软件设计目的基因miR-148b及内参基因U6引物。参照试剂盒说明设置反应体系及参数,进行实时荧光定量PCR检测。
1.2.4细胞活力检测 采用CCK8法。以每孔5 000个细胞接种转染后的三组细胞于96孔板,每组设置5个重复孔,收集按照上述分组处理后的细胞,在每个细胞孔中加入CCK8试剂10 μl,酶标仪检测各孔的吸光度值(OD值),波长为570 nm。实验重复3次。
1.2.5细胞凋亡率检测 以每孔1×106个细胞接种三组细胞于96孔板,培养48 h后,PBS洗涤细胞,Binding缓冲液500 μl悬浮细胞,分别加入FITC标记的Annexin V及PI各5 μl,轻柔混匀,室温避光染色10~15 min,上机,流式细胞仪检测三组细胞的凋亡情况。实验重复3次。
1.2.6TGF-β1、p-IκBα、cyclinD1、Bax蛋白表达检测 在转染48 h的三组细胞中加入适量的RIPA裂解液提取细胞总蛋白,Lowry法测定蛋白浓度,每孔道上样等量蛋白(40 μg)行SDS-PAGE,电泳后切掉多余的凝胶,电转移目的凝胶至PVDF膜,5%脱脂奶粉封闭膜1 h,4℃摇床孵育1∶1 000稀释的TGF-β1、p-IκBα、cyclinD1、Bax抗体过液,洗膜,加入辣根过氧化物标记的二抗,37℃孵育1 h,洗膜,ECL试剂显色,凝胶成像系统观察结果。以GAPDH作为内参基因,计算TGF-β1、p-IκBα、cyclinD1、Bax蛋白的相对表达量。

2 结果
2.1各组细胞中miR-148b的表达 各组细胞中miR-148b的mRNA表达结果如表1所示,HG组miR-148b的mRNA表达显著高于LG组(P<0.05),而HG+miR-148b inhibitor组miR-148b的mRNA表达显著低于HG组(P<0.05)。
2.2抑制miR-148b表达对高糖诱导的MMCs活力的影响 通过CCK8法检测各组细胞活力,结果如表2所示,HG组细胞活力显著高于LG组(P<0.05),而HG+miR-148b inhibitor组细胞活力显著低于HG组(P<0.05)。
2.3抑制miR-148b表达对高糖诱导的MMCs凋亡的影响 通过FITC标记的Annexin V 及PI双染法,流式细胞仪检测各组细胞凋亡率,结果如图1和表3所示,HG组细胞凋亡率显著高于LG组(P<0.05),而HG+miR-148b inhibitor组细胞凋亡率显著低于HG组(P<0.05)。
2.4抑制miR-148b表达对高糖诱导的MMCs免疫抑制因子TGF-β1表达的影响 通过Western blot检测各组细胞中免疫抑制因子TGF-β1的蛋白表达,结果如图2和表4所示,HG组细胞TGF-β1的蛋白表达显著高于LG组(P<0.05),而HG+miR-148b inhibitor组TGF-β1的蛋白表达显著低于HG组(P<0.05)。
表1各组细胞中miR-148b的表达
Tab.1ExpressionofmiR-148bincellsofeachgroup

GroupsmRNA expression of miR-148bLG group1HG group7.183±0.6651)HG+miR-148b inhibitor group2.526±0.2782)
Note:Compared with LG group,1)P<0.05;compared with HG group,2)P<0.05.
表2抑制miR-148b表达对高糖诱导的MMCs活力的影响
Tab.2EffectofinhibitingmiR-148bexpressiononMMCsactivityinducedbyhighglucose

GroupsODLG group0.772±0.072HG group1.269±0.1121)HG+miR-148b inhibitor group0.987±0.1032)
Note:Compared with LG group,1)P<0.05;compared with HG group,2)P<0.05.

图1 抑制miR-148b表达对高糖诱导的MMCs凋亡的影响Fig.1 Effect of inhibiting miR-148b expression on MMCs apoptosis induced by high glucose
2.5抑制miR-148b表达对高糖诱导的MMCs中NF-κB信号通路的影响 通过Western blot检测各组细胞中NF-κB信号通路p-IκBα及下游相关基因cyclinD1和Bax的蛋白表达,结果如图3和表5所示,HG组细胞p-IκBα、cyclinD1和Bax的蛋白表达均显著高于LG组(P<0.05),而HG+miR-148b inhibitor组p-IκBα、cyclinD1和Bax的蛋白表达均显著低于HG组(P<0.05)。
表3抑制miR-148b表达对高糖诱导的MMCs凋亡的影响
Tab.3EffectofinhibitingmiR-148bexpressiononMMCsapoptosisinducedbyhighglucose

GroupsApoptosis rate(%)LG group2.06±0.27HG group13.47±1.211)HG+miR-148b inhibitor group5.18±0.572)
Note:Compared with LG group,1)P<0.05;compared with HG group,2)P<0.05.

图2 抑制miR-148b表达对高糖诱导的MMCs免疫抑制因子TGF-β1表达的影响Fig.2 Effect of inhibiting miR-148b expression on expression of TGF-β1 in MMCs induced by high glucose
表4抑制miR-148b表达对高糖诱导的MMCs免疫抑制因子TGF-β1表达的影响
Tab.4EffectofinhibitingmiR-148bexpressiononMMCsonexpressionofTGF-β1inMMCs

GroupsRelative expression of TGF-β1 proteinLG group0.051±0.008HG group0.487±0.0561)HG+miR-148b inhibitor group0.122±0.0152)
Note:Compared with LG group,1)P<0.05;compared with HG group,2)P<0.05.
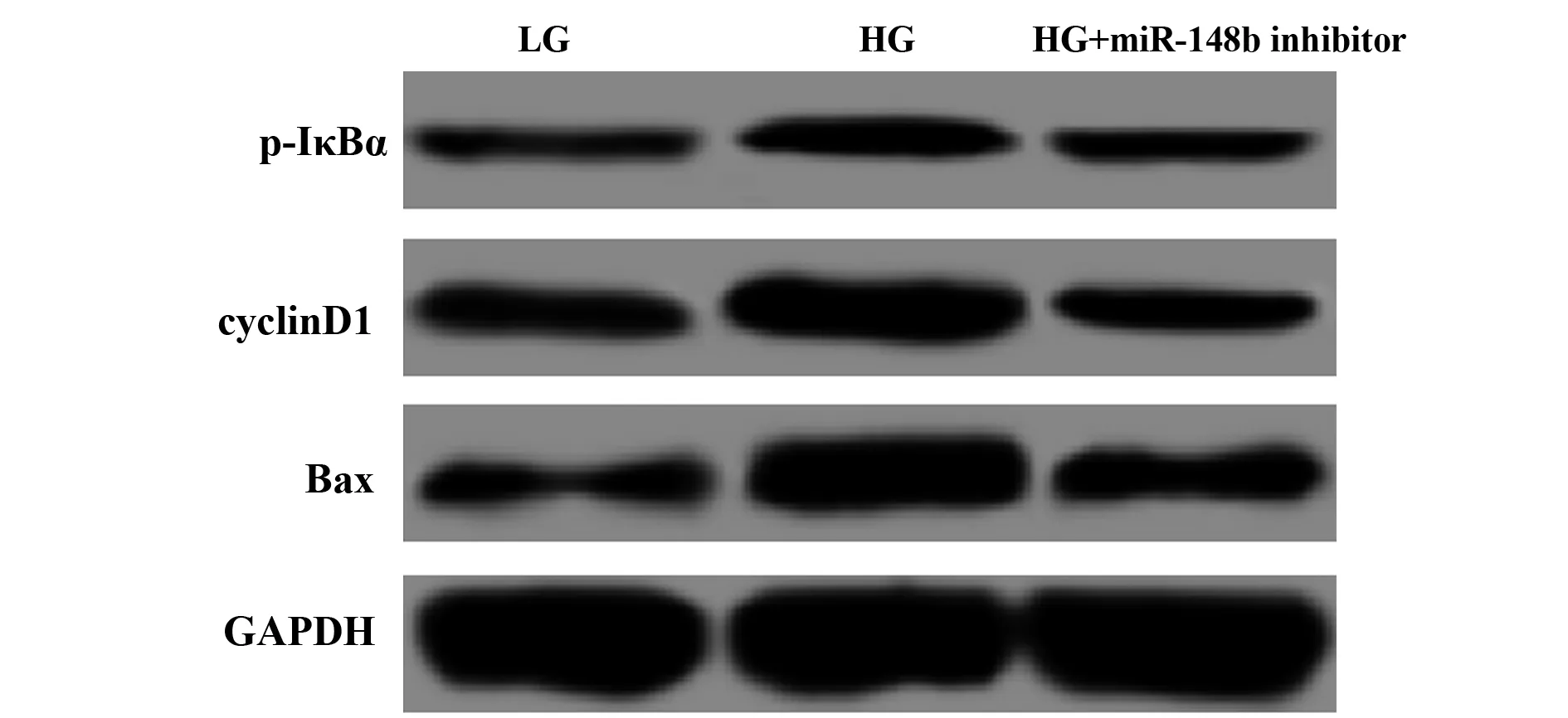
图3 抑制miR-148b表达对高糖诱导的MMCs中NF-κB信号通路的影响Fig.3 Effect of inhibiting miR-148b expression on NF-κB signaling pathway in MMCs induced by high glucose
表5抑制miR-148b表达对高糖诱导的MMCs中NF-κB信号通路的影响
Tab.5EffectofinhibitingmiR-148bexpressiononNF-κBsignalingpathwayinMMCsinduced
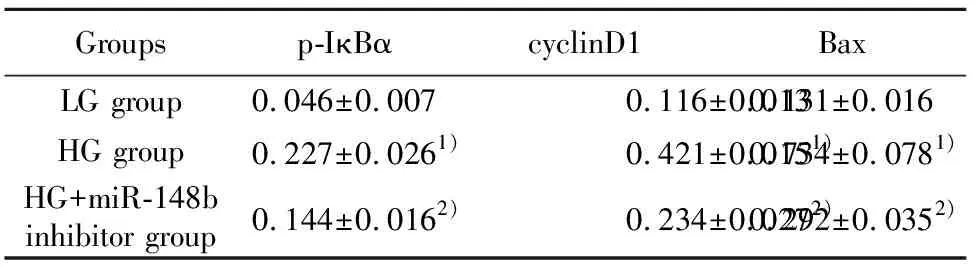
Groupsp-IκBαcyclinD1BaxLG group0.046±0.0070.116±0.0130.131±0.016HG group0.227±0.0261)0.421±0.0151)0.734±0.0781)HG+miR-148binhibitor group0.144±0.0162)0.234±0.0272)0.292±0.0352)
Note:Compared with LG group,1)P<0.05;compared with HG group,2)P<0.05.
3 讨论
DN是常见的糖尿病微血管并发症之一,病变涉及到包含肾小球内皮细胞、系膜细胞、肾小管上皮细胞等在内的多种细胞,最终可发展为肾小管间质纤维化及肾小球的硬化[7,8]。以往研究表明,高糖引起的系膜细胞缺失和凋亡是导致糖尿病发生肾损伤的一个主要机制[9,10],因此,探讨高糖对肾小球系膜细胞增殖、凋亡等生物学特性的影响对于DN早期防治和机制研究具有重要意义。miRNA在动植物体内有广泛存在,可通过降解或抑制靶基因的mRNA表达而影响生物体的病理及生理过程,多项研究发现,miRNA可作为诊断DN发生及发展的一个生物标记物[11],但仍需发现更多有效的用于DN诊疗的分子靶点。miR-148包含miR-148a和miR-148b,不仅可影响肿瘤的发生发展[12],在肾病和糖尿病中也发挥重要作用,有研究发现,mTORC1的异常激活可通过抑制miR-148b-3p引起肾小球上皮细胞损伤或凋亡[5];miR-148b的异常表达可促进IgA肾病IgA1的异常糖基化[6]。关于miR-148对肾小球系膜细胞增殖凋亡的影响及机制研究尚未清楚。
本研究旨在观察抑制miR-148b表达对高糖诱导的肾小球系膜细胞增殖、凋亡及免疫抑制因子TGF-β1表达的影响,结果显示,高糖可诱导肾小球系膜细胞增殖和凋亡,上调TGF-β1表达,而抑制miR-148b表达后可逆转这一效应。NF-κB是一个核转录因子,调节炎症、免疫等过程,多个影响肾脏疾病进展的因子均有NF-κB的结合位点,可增加肾小球毛细血管的损伤[13,14]。有研究发现,DN患者呈现出更大的与NF-κB结合活性,其结合活性的程度与DN的严重程度有密切关系[15]。而抑制NF-κB信号通路可降低DN中TGF-β1、cyclinD1和Bax的表达[16,17]。TGF-β1是一个免疫抑制因子,可诱导肾小球系膜细胞增殖[18]。cyclinD1是一个细胞周期蛋白,Bax是Bcl-2家族成员之一,发挥促凋亡作用,DN可通过调节cyclinD1和Bax的表达影响肾小球系膜细胞的增殖和凋亡[19,20]。本研究结果显示,高糖可上调NF-κB信号通路p-IκBα及下游相关基因cyclinD1和Bax的蛋白表达,抑制miR-148b表达后可降低p-IκBα、cyclinD1和Bax的表达。这提示抑制miR-148b表达可通过下调NF-κB信号通路影响DN的发生发展。
综上所述,抑制肾小球系膜细胞miR-148b基因表达可抑制高糖诱导的细胞活力、凋亡率及免疫抑制因子TGF-β1表达的增加,机制可能与下调NF-κB信号通路有关。该研究提示miR-148b可能是DN诊疗的一个新靶点,但还需更多研究及临床实践支持。

