HvSAPK3基因在‘凤大麦7号’抗白粉病中的功能研究
李庆伟,宗英杰,郭 娇,刘成洪,陆瑞菊,许建华,黄剑华*
(1上海海洋大学水产与生命学院,上海201306;2上海市农业科学院,上海201106;3光明种业有限公司,上海 202171)
为了应对洪涝、干旱、冷、盐和病虫害等各种环境胁迫,植物在长期的进化过程中形成了复杂的抗逆机制。蛋白质的磷酸化和去磷酸化是细胞中极其重要的一种蛋白质翻译后调控方式,与植物应答环境胁迫信号机制有关[1]。SnRK蛋白是一种高度保守的SerThr蛋白激酶,在植物中广泛存在。SnRK蛋白激酶可以通过磷酸化修饰靶蛋白来调控植物应答胁迫中的多种信号途径,在植物胁迫应答过程中起着至关重要的作用[2]。研究表明,根据蛋白结构差异,SnRK家族的38个成员可划分为SnRK123三个亚家族;其中SnRK1蛋白与酵母SNF1蛋白以及哺乳动物AMPK蛋白存在着较高的序列相似性,而SnRK2和SnRK3蛋白是植物所特有的一类蛋白激酶[3]。
研究表明,SnRK2蛋白在植物脱落酸(ABA)胁迫中调节参与植物渗透胁迫信号通路[4]。当ABA存在时,SnRK2蛋白的抑制因子PP2C的活性被抑制,SnRK2蛋白的功能开始作用[5]。活化后的SnRK2蛋白可以通过磷酸化ABA响应元件ABFs来调节ABA响应基因的转录,还可以作用于下游的一些元件,如离子通道、bZIP转录因子、NADPH氧化酶[6],这些蛋白与植物抗逆性关系密切。在SnRK2蛋白参与的抗逆研究中,关于非生物胁迫的报道最为常见,如将玉米的SnRK2蛋白激酶基因转到拟南芥中,明显增强了拟南芥的耐盐能力;过表达苹果的MpSnRK2.10基因明显增强了转基因拟南芥的抗旱性[7-8]。也有一些SnRK2蛋白相关的植物抗病报道,如胡丹丹等[9]研究表明,沉默水稻中的SnRK2类基因OsSAPK2,转基因水稻感白叶枯病比对照显著提高。SnRK2基因是否参与大麦对白粉菌的抗性反应还未有报道。
白粉病是我国大麦生产中的重要病害,大麦感病后一般可造成20%以上的产量损失,严重时损失达30%[10-11]。培育抗白粉病大麦品种不但能减少产量损失,还能减少化学农药的使用,是控制白粉病害最有效的手段。大麦抗白粉病相关基因的克隆和抗病机理研究是抗病育种的重要基础。‘凤大麦7号’是一个高抗白粉病的大麦品种[12],本试验前期对‘凤大麦7号’进行白粉菌侵染后的转录组测序,发现一个SnRK2家族基因HORVU1Hr1G055340在受白粉菌侵染的‘凤大麦7号’叶片中上调表达。本试验拟对该基因进行克隆,并初步分析其在大麦抗白粉病中的功能,以期对‘凤大麦7号’抗白粉病机理进行更深入的研究。
1 材料与方法
1.1 材料
‘凤大麦7号’为大理白族自治州农业科学推广研究院引进的大麦品种,抗白粉病;‘花30’为本实验室育成的大麦品种,感白粉病。大麦白粉菌取于上海本地大麦试验田。
1.2 白粉菌处理大麦幼苗
‘凤大麦7号’和‘花30’幼苗生长至二叶一心期时,在叶片上均匀抖落新鲜白粉菌孢子,取处理后0 h、6 h、12 h、24 h的大麦叶片,用于总RNA 的提取。
1.3 大麦总 RNA 的提取和cDNA第I链的合成
参照李颖波等[13]方法提取大麦总RNA。所提取的RNA采用1%甲醛变性胶电泳检测RNA 的完整性,同时测定OD230、OD260、OD280吸收值以检测纯度。cDNA第Ⅰ链合成具体步骤按照RevertAidTMFirst Strand cDNA Synthesis Kit(Life)说明书进行。
1.4 HvSAPK3基因序列分析、开发阅读框(ORF)全长克隆
1.5 生物信息学分析
HvSAPK3蛋白理论相对分子质量和等电点采用Expasy的ProtParam在线分析软件(http:web.expasy.orgprotparam)分析并预测。HvSAPK3蛋白的同源蛋白、结构域利用NCBI的BlastP在线分析软件(https:blast.ncbi.nlm.nih.gov)查找。
多重序列比对通过Clustal X 1.83软件进行,采用 MEGA 4.1 软件构建系统进化树(neighbor-joining 方法),其中bootstrap设为1 000 replicates。
1.6 荧光定量PCR(qRT-PCR)分析
qRT-PCR分析使用ABI 7500 fast 定量PCR仪进行。反应体系20 μL,包括2×SYBR Mix(Life),上、下游引物各0.4 μmolL,每个反应含大约 30 ng cDNA,3 个重复,阴性对照不加模板体系。qRT-PCR 反应程序为:94 ℃预变性30 s;94℃变性5 s,60℃退火20 s,72℃延伸20 s,45个循环。通过产物溶解曲线分析 qRT-PCR 引物扩增的特异性。利用2-ΔΔCT方法计算相对表达量。qRT-PCR引物根据HvSAPK3基因序列设计:上游引物5’-CAAGGAACTTCCGGAAAACA-3’,下游引物5’-CTCAGGCTCCTTGAAGTTGG-3’;采用大麦的Actin基因作为内参基因(Actin-F:5’-GACTCTGGTGATGGTGTCAGC-3’,Actin-R:5’-GGCTGGAAGAGGACCTCAGG-3’)。
1.7 大麦条纹花叶病毒诱导的基因沉默(BSMV Virus induced gene silencing,VIGS)
VIGS试验过程参照Wang等[14]方法。特异性引物VIGS-F:5’-CTAGCTAGCTACGAGGCGTTGAAG-GAGTTGG-3’,VIGS-R:5’-CTAGCTAGCTTCGAAGAGTTCTCCGCCAGCA-3’,序列长度为252 bp。在接种大麦条纹花叶病毒(Barley stripe mosaic virus,BSMV)病毒10 d后观察‘凤大麦7号’的叶片病毒症状。以沉默八氢番茄红素脱氢酶基因(PDS)植株为参照,分别对Mock(接种缓冲液)和接种BSMV:HvSAPK3植株取样,进行qRT-PCR分析,检测目的基因的沉默效率。取出现病毒表型的植株叶片,整齐地摆放于已灭菌的6-BA保鲜培养基上,用抖落法接种新鲜白粉菌孢子,接种6—8d后观察叶片发病情况。
2 结果与分析
2.1 HvSAPK3基因的克隆和序列分析
根据HORVU1Hr1G055340设计跨ORF引物,进行PCR扩增并测序,发现该PCR产物含有编码长度为1 026 bp的完整ORF核苷酸序列。该基因编码的蛋白质相对分子质量为38.54 ku,理论等电点为6.03。将该蛋白氨基酸序列进行BLASTp同源比对,发现该蛋白在5—243位氨基酸与SnRK2蛋白激酶家族典型的结构域Cdd:cd14662相似度很高(图1),表明该基因属于SnRK2基因家族,故将该基因命名为HvSAPK3。

“”表示序列一致,“:”表示保守性突变,“.”表示弱半保守性突变图1 HvSAPK3蛋白与SNRK2保守结构域Cdd:cd14662序列比对 Fig.1 Sequence alignment of HvSAPK3 protein with the conserved domain Cdd:cd14662 of SNRK2
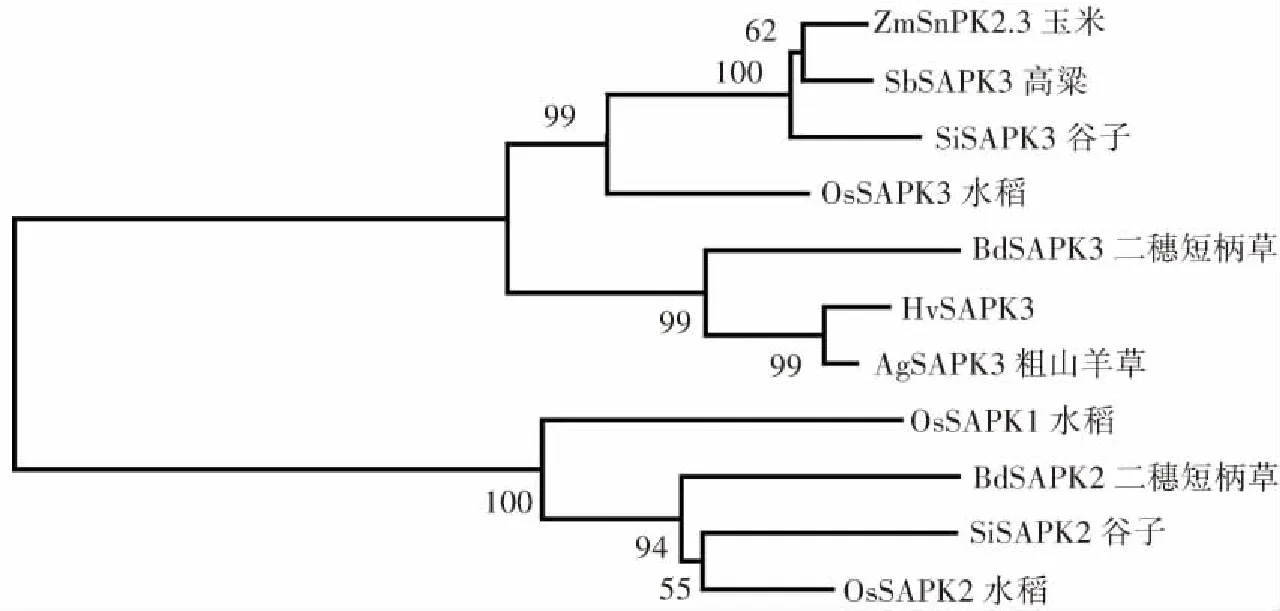
GenBank序列号:AgSAPK3(XP_020185663.1),BdSAPK3(XP_003574349.1),OsSAPK3(XP_015614267.1),ZmSnRK2.3 (NP_001136496.1),SbSAPK3(XP_021306693.1),SiSAPK3(XP_004983620.1),BdSAPK2(NP_001304800.1), SiSAPK2(XP_004958353.1),OsSAPK2(Q0D4J7.1),OsSAPK1(Q75LR7.1)图2 部分禾本科植物SAPK同源蛋白的系统进化分析Fig.2 Phylogenetic analysis of SAPK homologous proteins in some Gramineae plants
2.2 HvSAPK3同源蛋白的系统进化分析
将HvSAPK3蛋白与粗山羊草、谷子、二穗短柄草、玉米、高粱、水稻的SnRK2 类蛋白进行系统进化分析表明:HvSAPK3蛋白和其他禾本科植物的SAPK3蛋白形成一个群(图2),其中HvSAPK3蛋白和粗山羊草SnRK2 类蛋白AgSAPK3亲缘关系最近,表明SAPK3蛋白在禾本科中进化比较保守。
2.3 白粉菌侵染后HvSAPK3基因的表达特征分析
在白粉菌侵染的‘凤大麦7号’叶片中,HvSAPK3基因在12h时开始上调表达,随后表达量逐渐恢复到侵染前水平(图3A);而在感白粉病品种‘花30’ 叶片中,HvSAPK3基因在白粉菌侵染后下调表达(图3B),表明HvSAPK3基因可能参与‘凤大麦7号’的抗病反应。
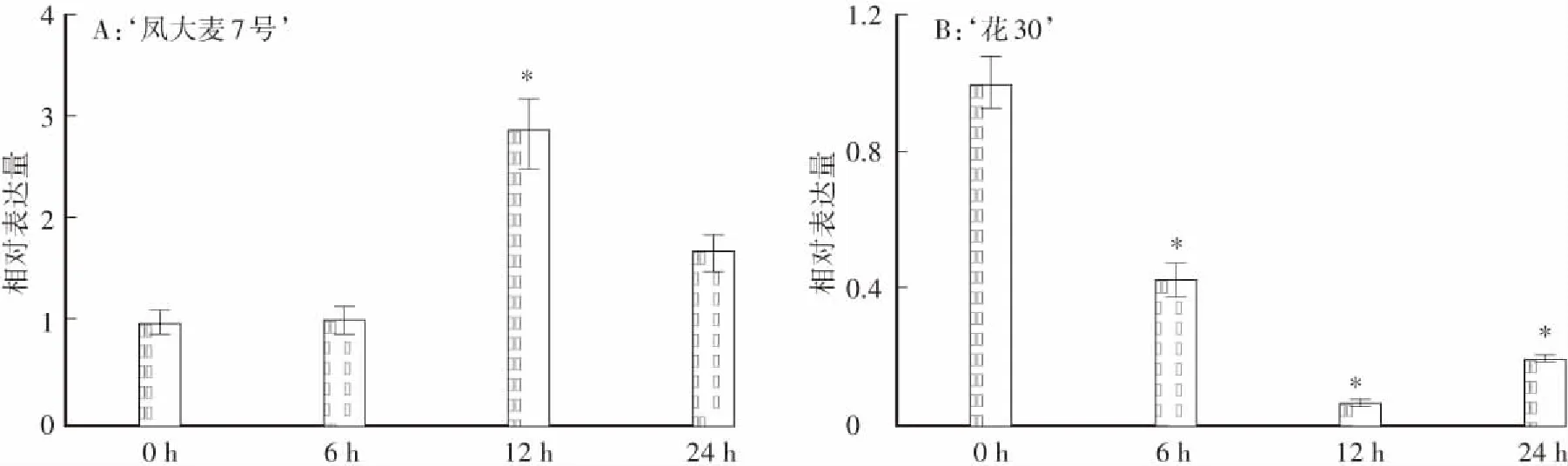
*表示P<0.05图3 HvSAPK3基因在受白粉菌侵染的抗感大麦材料中的表达特征Fig.3 Expression characteristics of HvSAPK3 gene in resistant and susceptible barley infected by powdery mildew
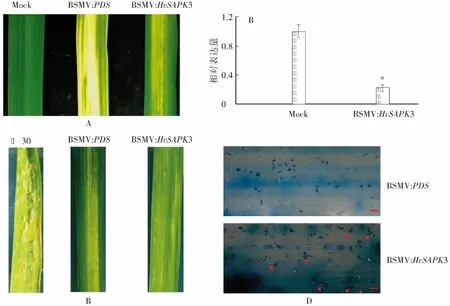
A:在‘凤大麦7号’叶片上接种BSMV病毒载体10 d后叶片的症状;B:利用qRT-PCR检测HvSAPK3基因的沉默效率,*表示P<0.05;C:沉默HvSAPK3基因植株叶片离体接种大麦白粉菌后的表型,以BSMV:PDS为对照,‘花30’为感病对照;D:接种BSMV:PDS和BSMV:HvSAPK3病毒重组载体的‘凤大麦7号’叶片接种白粉菌后白粉菌侵染比较,红色箭头表示形成的分生孢子,标尺=100 μm图4 利用VIGS分析HvSAPK3基因在‘凤大麦7号’中的功能Fig.4 Analysis of the function of HvSAPK3 gene in ‘Fengdamai 7’ by VIGS
2.4 VIGS沉默‘凤大麦7号’的HvSAPK3基因
将BSMV病毒α链、β链体外转录物分别与BSMV:PDS、BSMV:HvSAPK3体外转录物混合,接种二叶一心期‘凤大麦7号’植株的第二张叶片,10d后观察叶片上的病毒侵染症状。结果显示,在参照植株(接种BSMV:PDS)的叶片上产生明显的长条状光漂白表型,表明植株内PDS基因已被成功沉默,病毒已成功侵染(图4A);而在接种BSMV:HvSAPK3的叶片上,也出现明显褪绿的病毒花斑症状。
病毒载体接种10 d后,利用qRT-PCR分析沉默植株中HvSAPK3基因的表达情况,同时离体接种鉴定其白粉病抗性。结果显示,沉默植株中的HvSAPK3基因表达量和对照植株相比显著降低,说明接种病毒叶片中HvSAPK3基因已被沉默(图4B)。接种白粉菌孢子后,BSMV:PDS、BSMV:HvSAPK3和Mock的植株叶片上未观察到明显的白粉菌孢子堆生成(图4C)。进一步通过显微观察发现,接种BSMV:PDS植株的叶片上白粉菌尽管能够侵染,但无法形成分生孢子梗;而接种BSMV:HvSAPK3的植株叶片上,部分白粉菌能正常繁殖并形成次生菌丝(图4D)。以上结果表明,在‘凤大麦7号’中沉默HvSAPK3基因可降低其抗病性,证明该基因在抗白粉病中发挥作用。
3 讨论
SnRK2是胁迫相关蛋白激酶,通过传递的信号诱发植物胁迫应答反应[2]。本研究以转录组数据为基础,在高抗白粉病大麦品种中克隆了一个响应白粉菌侵染的SnRK2类基因HvSAPK3,进化分析显示:HvSAPK3蛋白和其他禾本科作物中同类蛋白聚类到同一个群,表明HvSAPK3基因在禾本科作物中进化较保守,推测HvSAPK3基因在禾本科作物中的功能也是保守的。
Xu等[15]研究认为,在没有抗病基因存在的条件下,水稻OsSAPKs家族基因不会被胁迫所诱导。在本研究中,HvSAPK3基因在‘凤大麦7号’中受白粉菌侵染后表达上调,而在感白粉病品种‘花30’中受白粉菌侵染后表达下调,表明HvSAPK3基因可能参与‘凤大麦7号’对白粉病的抗病反应。
胡丹丹等[9]沉默水稻中的OsSAPK2基因,转基因水稻感白叶枯病显著提高,显示OsSAPK2基因的正向调控作用。在本研究中,VIGS试验显示,沉默HvSAPK3基因后,白粉菌能在‘凤大麦7号’叶片上能形成次生菌丝,表明HvSAPK3基因在‘凤大麦7号’抗病反应中起正向调控作用。目前,大麦对白粉菌专化抗性的研究较多,已报道的大麦主效抗白粉病基因位点有22个[16],HvSAPK3基因究竟参与哪个基因的调控,还需要对‘凤大麦7号’进行更加深入的研究。
致谢:
感谢大理白族自治州农业科学推广研究院李国强研究员提供‘凤大麦7号’材料。

