MTERF3过表达对脑胶质瘤U251细胞线粒体基因表达及细胞增殖和迁移的影响*
孙美涛,梅 雯,王唯斯,李素芬,自加吉,张晓娟,熊 伟
脑胶质瘤是中枢神经系统发病率最高的原发性恶性肿瘤,约占成人原发性颅内肿瘤的30%~40%,多数脑胶质瘤恶性程度高,侵袭性强[1]。目前,脑胶质瘤以手术治疗为主,但因肿瘤浸润性生长的特点,导致手术治疗不能彻底切除,术后复发率高,患者的预后极差,因而多需要术后结合放化疗的综合性治疗[2]。随着对脑胶质瘤的深入研究发现,脑胶质瘤的生长侵袭与多种基因密切相关,基因靶向治疗可能是治疗脑胶质瘤的一种有效方法[3]。脑胶质瘤的一个重要的生物学异常表现是能量代谢的改变,从而使肿瘤细胞保持更强的增殖、侵袭及在不利环境中存活的能力[4]。其能量代谢的特征是,即使在有氧的条件下也主要采用糖酵解的方式产生能量,这一过程受一系列的基因调节,并促使肿瘤细胞表现出恶性特征[5]。线粒体DNA(mitochondrial DNA,mtDNA)是环境致癌物作用的重要靶标,其损伤程度和突变率显著高于核内DNA[6]。大量研究表明,脑胶质瘤的发生不仅取决于核内遗传物质,而且与核外的mtDNA突变和线粒体动力学改变有明显相关[7,8]。
线粒体转录终止因子3(mitochondrial transcription termination factor 3,MTERF3) 又被命名为线粒体转录终止因子结构域1(mitochondrial transcription termination factor domain containing 1,MTERFD1),是 MTERF 蛋白家族中最保守的成员[9]。人MTERF3基因位于 8q22.1,包含 11个外显子[10]。研究显示,哺乳动物MTERF3是一种线粒体蛋白质,且负调控线粒体DNA的基因表达和线粒体能量生成[11]。动物实验证明,MTERF3在小鼠胚胎发育过程中不可缺少,敲除MTERF3基因的小鼠胚胎发育迟缓并在妊娠过程中死亡[11]。还有研究报道,MTERF3基因在细胞中的作用类似于细胞癌基因,MTERF3基因拷贝数扩增及其过表达对肝细胞癌、乳腺癌、非小细胞肺癌和胰腺癌的发生、进展和预后有重要作用[12]。然而,目前关于MTERF3基因在脑胶质瘤发生发展中的作用及其机制仍不清楚。该研究通过构建MTERF3过表达的脑胶质瘤U251细胞稳定转染株,旨在探究MTERF3对U251细胞线粒体基因表达及细胞增殖和迁移的影响。
1 材料与方法
1.1 材料 人脑胶质瘤U251细胞株购自中国科学院典型培养物保藏委员会细胞库;DMEM高糖培养基、Opti-MEM培养基、胎牛血清购自美国Gibco公司;pEX-EGFP-Flag和pEX-MTERF3-Flag质粒购自广州复能基因有限公司;胰酶消化液、DMSO、D-PBS、青链霉素溶液、碘化丙啶(PI)、SDS-PAGE凝胶快速配制试剂盒、PVDF膜、ECL化学发光液、XTT细胞增殖检测试剂盒购自上海碧云天生物技术有限公司;DL 2000 DNA Marker、基因组DNA提取试剂盒、PCR试剂盒购自大连TaKaRa公司;Tranwell小室购自美国Corning公司;X-tremeGENE HP DNA转染试剂购自美国Roche公司;兔抗MTERFD1多克隆抗体(ab167067)、兔抗GAPDH多克隆抗体 (ab9485)、兔抗 VDAC1多克隆抗体(ab15895)、兔抗 MT-ND1 多克隆抗体(ab222892)、兔抗MT-ND6多克隆抗体 (ab81212)、兔抗MTCYB多克隆抗体 (ab81215)、HRP标记的山羊抗兔IgG(ab6721)购自美国Abcam公司。
1.2 方 法
1.2.1 细胞培养 将人脑胶质瘤U251细胞用含10%胎牛血清和100 U/ml青霉素、100 U/ml链霉素的DMEM高糖培养基进行培养,并置于37℃、5%CO2饱和湿度的恒温培养箱内,0.25%胰酶+0.02%EDTA消化传代。
1.2.2 细胞转染 将实验对象分为3组,空白对照组:无转染的U251细胞;阴性对照组:转染pEGFPFlag质粒的U251细胞;实验组:转染MTERF3-Flag质粒的U251细胞。取处于增殖期的U251细胞,待其生长至汇合度为80%~90%进行细胞转染。使用X-tremeGENE HP DNA转染试剂说明书进行转染操作,转染4~6 h后更换Opti-MEM培养基,继续转染至48 h,观察转染效率,拍片。然后用500 μg/ml G418筛选14 d,获得稳定表达株,扩大培养,用于后续实验。
1.2.3 半定量PCR检测线粒体DNA拷贝量变化按细胞基因组DNA提取试剂盒说明书进行细胞总DNA的提取。为减少DNA模板量的差异,扩增核基因组18 S rDNA基因,引物设计如下:18 S rDNAF:5'-CGCGCTCTACCTTACCTACC-3',18 S rDNAR:5'-CCGTCGGCATGTATTAGCTC-3',调整各样品模板浓度。以调整一致的模板浓度,扩增mtDNA的D-loop区片段,对mtDNA拷贝量进行相对定量,引物设计如下:D-loop-F:5'-GGGAACGTGTGGGCTA TTTA-3',D-loop-R:5'-TACTCAAATGGGCCTGT CCT-3'。进行3次独立实验,凝胶成像系统成像,QuantityOne 4.6软件 (Bio-rad)分析个条带灰度值,以线粒体D-loop与18S rDNA的扩增条带的灰度值比值代表线粒体DNA拷贝量变化[13]。实验重复3次。
1.2.4 Western blot检测蛋白质表达水平 取以上3组的U251细胞,每孔分别加入150 μl Western IP细胞裂解液(含1.0 mmol/L PMSF),置于冰上30 min,使其充分裂解。12 000 r/min离心10 min,将上清转移到各自标注好类别的1.5 ml的Eppendorf管内,BCA法测定蛋白浓度,煮沸变性。各组取100 μg样品进行上样,之后将蛋白转移至PVDF膜上,再用5%的脱脂奶粉室温下对PVDF膜进行抗原封闭1 h。倒掉封闭液,加入TBS-T稀释的一抗(均以1∶1000稀释),4℃孵育过夜。二抗室温孵育2 h,洗膜,ECL显色。采用Image J软件测量每个条带的IOD值,计算各蛋白质相对表达量。实验重复3次。
1.2.5 XTT细胞增殖检测 将3组U251细胞稀释至1×106/mL,分别向96孔板中加入2000个细胞/孔。每组设置3个复孔。待细胞贴壁,培养24 h、48 h、72 h、96 h后,分别在每孔加入50 μl XTT溶液,用铝箔包裹培养板,于37℃温育4 h。每孔加150 μl DMSO,置摇床上低速振荡10 min,溶解残留的甲臜结晶,用酶标仪检测波长在450 nm吸收值并绘制细胞增殖曲线。实验重复3次。
1.2.6 流式细胞术检测细胞周期 收集对数生长期的各组U251细胞,每管加入1 ml预冷的75%的乙醇溶液固定,置于4℃,固定过夜。次日,2000rpm,4℃离心5 min,收集细胞,弃上清。加入1 ml冰预冷的D-PBS重悬细胞,洗2遍,收集细胞,弃上清。每管加入500 μl的PI染色液,加入RNase A至终浓度0.5 mg/ml,轻轻涡旋重悬细胞,室温避光孵育30 min后进行流式细胞仪检测。利用Novo Express软件分析荧光强度直方图,统计不同处理下各时相细胞所占的比例,分析细胞周期G0/G1、S、G2/M不同时相分布情况。实验重复3次。
1.2.7 细胞划痕实验 在6孔板底部每个孔上画5条平行直线。重悬3组细胞,分别接种2.5×105/孔于6孔板内,并置于培养箱中培养待其汇合度达90%~95%。用PBS洗涤细胞3次,再用10 μl的枪头划1条垂线,加入无血清的培养基置于5%CO2,37℃恒温箱内孵育。最后分别于0、12和24 h时倒置显微镜(100×)下采相,采用Image J软件计算图片上划痕距离,计算公式如下:迁移率(%)=(0 h所测距离-预定时间所测距离)/0 h所测距离×100%。实验重复3次。
1.2.8 Transwell细胞迁移试验 收集对数生长期3组细胞,调整细胞密度为2.5×105/ml。选用孔径0.8 μm Transwell小室置于24孔板中,分别向小室中加入1×105个细胞和200 μl无血清培养基。下室(24孔板)中各加入600 μl完全培养基,置于培养箱中培养36 h。取出Transwell小室,用棉签擦掉小室内的细胞,4%多聚甲醛固定15 min后,再用0.1%结晶紫染色,PBS漂洗1~3次,至背景呈白色。最后在显微镜下观察穿膜细胞数,随机选取5个固定视野(×100)拍照,并评价各组细胞迁移能力。实验重复3次。
1.3 统计学分析 采用SPSS 22.0统计软件和Graphpad Prism 7.0软件进行统计学分析和绘图,计量值以(±s)表示,两组均值间的比较采用独立样本t检验,多组均值间的比较采用单因素方差分析。取P<0.05为差异具有统计学意义。
2 结果
2.1 稳定转染细胞株的荧光显微镜观察 将空白对照组和稳定转染EGFP-Flag的U251细胞在荧光显微镜下观察,结果表明,稳定转染EGFP-Flag的U251细胞可以看到清晰明亮的绿色荧光,说明转染的细胞内存在EGFP蛋白的表达,而空白对照组观察不到任何绿色荧光信号(图1)。初步的观察结果表明,已经成功的构建稳定转染EGFP-Flag的U251细胞株。
2.2 过表达稳转株中MTERF3蛋白的表达检测为进一步验证MTERF3稳定转染的U251细胞株,使用兔抗MTERF3多克隆抗体对各组细胞进行Western blot检测,结果发现,与空白对照组相比,稳定转染EGFP-Flag的阴性对照组细胞中MTERF3蛋白的表达量无明显变化(P>0.05)。而稳定转染重组质粒pEX-MTERF3-Flag的U251细胞中MTERF3蛋白的表达比对照组未转染细胞高4.6倍左右,且组间差异极其显著 (P<0.01),说明MTERF3稳转的U251细胞株中,外源MTERF3蛋白能够持续的表达。见图2。

图1 荧光显微镜下观察U251细胞内绿色荧光蛋白的表达情况(×100)

图2 Western blot检测MTERF3蛋白在各组U251细胞中的表达
2.3 MTERF3过表达对线粒体DNA拷贝量的影响 以核内18S rDNA基因的水平作为内参,以线粒体D-loop扩增产物与18S rDNA扩增产物的比值表示线粒体DNA与核DNA含量的相对比例,分析不同处理的U251细胞中线粒体DNA拷贝量的变化。结果显示,空白对照组和阴性对照组相比,U251细胞线粒体DNA拷贝量没有显著性差异(P>0.05),而过表达MTERF3基因能够显著抑制线粒体DNA的复制,导致线粒体DNA拷贝量下降,且差异具有统计学意义(P<0.05)。见图3。

图3 半定量PCR检测MTERF3对线粒体DNA复制水平的影响
2.4 MTERF3过表达对线粒体编码蛋白质表达水平的影响 以线粒体蛋白质VDAC1作为内参,Western blot检测MTERF3过表达对线粒体编码蛋白质表达水平的影响。结果表明,空白对照组和阴性对照组相比,U251细胞线粒体编码的ND1、ND6和CYTB蛋白表达水平没有明显差异 (P>0.05);实验组细胞过表达MTERF3后,导致重链编码的ND1、CYTB蛋白和轻链编码的ND6蛋白表达水平均出现显著下降(P<0.05)。见图4。
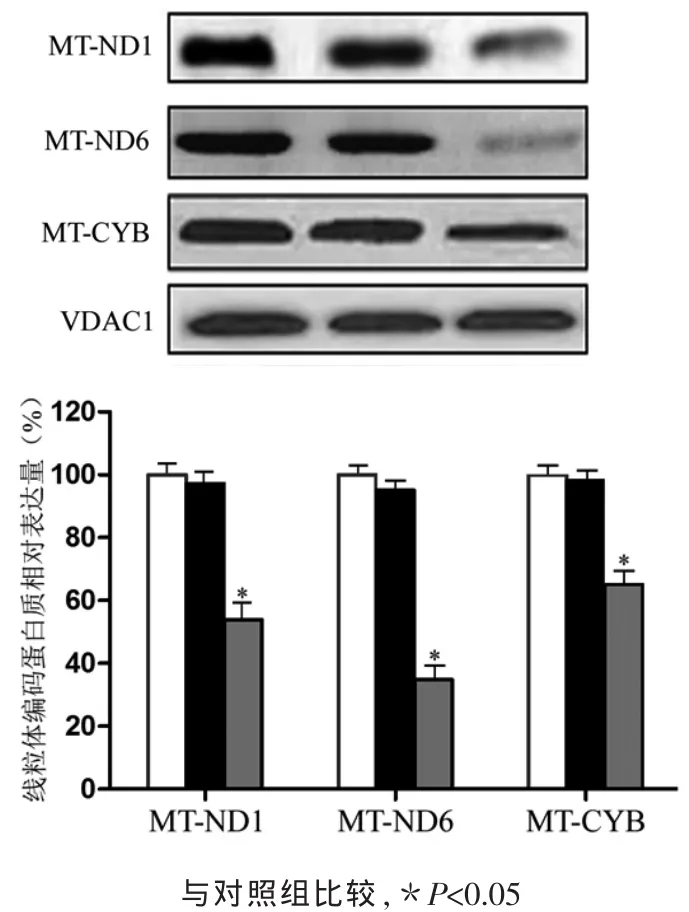
图4 Western blot检测MTERF3对线粒体编码蛋白质表达水平的影响
2.5 MTERF3过表达对U251细胞增殖的影响与空白对照组和阴性对照组相比,实验组U251细胞的增殖力在48 h、72 h和96 h时显著增高,差异有统计学意义(P<0.05);而空白对照组和阴性对照组的细胞增殖力未见明显变化(P>0.05)。结果表明,MTERF3基因过表达后能够显著促进U251细胞的增殖。见图5。

图5 XTT检测MTERF3过表达对U251细胞增殖的影响
2.6 MTERF3过表达对U251细胞周期的影响与空白对照组和阴性对照组相比,实验组细胞G0/G1期细胞百分比显著减少,S期细胞百分比显著增加,均具有统计学差异(P<0.05)。此外,3组细胞处于G2/M期的细胞百分比无统计学差异 (P>0.05)。结果表明,上调MTERF3基因表达后,能促进U251细胞通过G1/S控制点进而促进细胞增殖,且未出现细胞周期阻滞和细胞凋亡。见图6。
2.7 MTERF3过表达对U251细胞迁移能力的影响 在细胞划痕实验中,实验组的划痕愈合率[(68.22±8.53)%] 显著高于空白对照物 [(42.45±5.43)%]和阴性对照组[(41.32±5.65)%]。 同时,在Transwell小室检测细胞迁移的实验中,MTERF3稳定转染的实验组在每个视野下迁移的细胞数[(435.00±42.26)个]显著多于空白对照组[(259.00±30.22)个]和阴性对照组[(252.00±27.58)个],组间差异非常显著(P<0.01)。而阴性对照组和空白对照组之间的差异无统计学意义(P>0.05)。见图7。

图6 流式细胞术检测过表达MTERF3对U251细胞周期的影响

图7 Transwell检测稳定过表达MTERF3对U251细胞迁移能力的影响(×100)
3 讨论
脑胶质瘤是目前人类肿瘤中最为常见的原发性中枢神经系统肿瘤,起源于脑组织的神经外胚层细胞,是生存时间最短及预后最差的疾病类型之一[14,15]。 近年来,手术治疗、放疗及化疗等常规治疗手段取得了较大的进步,但由于脑胶质瘤浸润生长的特性,导致肿瘤部位难以彻底切除而复发,严重影响脑胶质瘤治疗的预后[16]。随着分子生物学研究的不断深入,分子靶向治疗逐渐成为恶性肿瘤新的治疗措施。研究表明,MTERF3蛋白能特异性地与线粒体DNA D-loop区的启动子区域结合,MTERF3在mtDNA的转录过程中起负调控作用[11]。由于MTERF3抑制线粒体DNA的基因表达,所以线粒体DNA所编码的呼吸链复合体亚基上的蛋白合成也会受到相应的影响,降低细胞氧化磷酸化水平[17]。Hyvarinen等用二维琼脂糖凝胶电泳法(neutral/neutral two-dimensional agarose gel electrophoresis,N/N2D-AGE)对mtDNA复制中间体的研究发现,在人胚肾293T细胞中过表达MTERF3,抑制线粒体DNA复制过程,导致细胞内线粒体DNA拷贝量下降[18]。此外,MTERF3不仅负调控mtDNA的复制和转录,还可以影响线粒体核糖体的合成[19]。MTERF3基因的表达异常,可能与线粒体心肌病、线粒体糖尿病、神经退行性疾病、线粒体脑病、恶性肿瘤等人类疾病的发生密切相关[17,20-22]。
该研究在分析了MTERF3过表达对U251细胞线粒体基因表达水平的影响后,进一步采用XTT检测细胞增殖,采用流式细胞术分析细胞周期。XTT结果显示,过表达MTERF3基因能够显著促进U251细胞的增殖。流式细胞术结果显示,过表达MTERF3基因的U251细胞G0/G1期细胞减少,S期细胞增多,促进U251细胞从G0/G1进入S期,进而促进U251细胞增殖,并且不会导致细胞周期阻滞和细胞凋亡。此外,细胞划痕实验和Transwell小室实验均表明,MTERF3稳定过表达能显著提高脑胶质瘤U251细胞的体外迁移能力。
综上所述,该研究提示MTERF3基因过表达能显著抑制脑胶质瘤U251细胞线粒体基因表达,并促进胶质瘤细胞增殖和迁移。本研究为进一步探讨MTERF3对脑胶质瘤细胞中线粒体氧化磷酸化活性及恶性生物学行为的影响及其分子机制提供了实验基础。

