造礁石珊瑚自然海区断枝培育技术研究
段晓伟肖宝华廖宝林杨小东谢子强谢勇琪
造礁石珊瑚自然海区断枝培育技术研究
段晓伟1,肖宝华2,3,廖宝林2,杨小东2,谢子强2,谢勇琪2
(1. 深圳市大鹏新区海洋生物产业服务中心/ 2. 广东海洋大学深圳研究院,广东 深圳 518108;3. 广东海洋大学广东省海洋开发研究中心,广东 湛江 524025)
【】研究探讨造礁石珊瑚自然海区断枝培育技术的条件和方法。在深圳大鹏新区大澳湾海区海底搭建海区断枝培育系统,并在系统上培育膨胀蔷薇珊瑚 () 、霜鹿角珊瑚()、盾形陀螺珊瑚()、十字牡丹珊瑚()和澄黄滨珊瑚()等5种造礁石珊瑚的断枝(每种珊瑚100株),开展为期12个月的实验。5种珊瑚在深圳市大鹏新区大澳湾海域的断枝培育系统上培育12个月后,5种造礁石珊瑚断枝存活率分别为96%、93%、95%、85%和83%。珊瑚断枝生长指标测量结果显示,5种珊瑚中霜鹿角珊瑚生长速度最快,其断枝横向增长长度平均可达46.2 mm;其次是膨胀蔷薇珊瑚,其断枝横向伸长长度平均可达38.2 mm;而澄黄滨珊瑚生长速度最慢,横向伸长长度都在24 mm以下。在合适海区,使用海区石珊瑚断枝培育系统进行造礁石珊瑚培育,可改善其存活率和生长。
造礁石珊瑚;石珊瑚断枝;断枝培育
珊瑚礁资源正在经历全球范围的急剧衰退,联合国环境规划署提供的数据表明, 目前全球珊瑚礁有11%已经衰退, 16%已不能发挥生态功能, 60%正面临严重威胁[1-3]。因此,开展珊瑚礁保护和修复工作已迫在眉睫。目前,通过有性繁殖技术手段对珊瑚礁进行修复,国内外学者已积累一定理论与经验,但由于对大部分珊瑚种类配子成熟与释放的生理过程及细胞调控机制还缺乏了解,人工环境下珊瑚的性成熟和有性繁殖还较为困难,尚不具备大规模产业化应用能力[4-8]。相对造礁石珊瑚有性繁育修复的受限,造礁石珊瑚无性繁殖方式有多种,通过出芽生殖、组织碎片脱落、水螅体释放等形式都可使造礁石珊瑚在生活史任何阶段从母体分离发育成独立的新个体[9]。从20世纪70年代开始,国外学者在夏威夷岛、加勒比海、南太平洋、东南亚等地区陆续开展造礁石珊瑚无性繁殖修复珊瑚礁的技术研究[10-13]。国内开展造礁石珊瑚无性繁育和移植始于20世纪90年代,随后陆续有学者在华南近岸、海南岛和南海海域开展造礁石珊瑚无性繁育研究[14-16]。珊瑚断枝培育技术是目前应用最广的造礁石珊瑚无性繁殖技术之一。该技术相比传统的珊瑚移植技术,能在提高珊瑚培育的成功率的同时,减少对原生珊瑚的破坏,并持续培育更多的珊瑚苗种进行珊瑚礁修复[13],但由于各地区珊瑚品种和移植海区环境的差异,目前尚无较为统一的断枝培育标准和方法[13,17]。根据各海域水文特征和珊瑚资源状态,选择合适的珊瑚断枝培育技术才能保证珊瑚断枝培育的成功率。本研究借鉴国内外珊瑚断枝培育技术,构建适应我国华南近岸自然海区的珊瑚断枝培育系统,为珊瑚礁生态修复提供技术参考。
1 材料与方法
1.1 珊瑚母枝采集和驯养
本实验所用5种珊瑚母枝采自深圳东部海域,来源于海区中由于拖网、抛锚破坏散落的未死亡珊瑚。种类分别是膨胀蔷薇珊瑚 () 、霜鹿角珊瑚()、盾形陀螺珊瑚()、十字牡丹珊瑚()和澄黄滨珊瑚()。造礁石珊瑚母株的鉴定根据邹仁林编著的《中国动物志•造礁石珊瑚》[18]。对其活性和健康状态挑选,此次用于实验的分枝状珊瑚母枝高约在120~200 mm,团块状珊瑚母枝大小约为150×100 mm。采集回的母枝应在运输过程浸没在海水并防止暴露在阳光之下,并于1 h内迅速转移至岸边人工海水养殖系统中进行母枝驯养。珊瑚母枝驯养5~10 d,待其珊瑚体颜色恢复正常,珊瑚虫活跃即可。
1.2 培育皿与珊瑚断枝的制备
本研究使用的断枝培育皿为陶瓷材料,浸泡在海水之中不遭腐蚀与破坏,同时也不会对珊瑚断枝产生毒害。培育皿底部设计有螺纹螺杆和螺帽,上部是一中空托盘结构(图1)。

图1 断枝培育皿实物
断枝截取前珊瑚母枝须在人工生态缸中停食静养3 d。断枝截取应在晚上关灯后进行,此时虫黄藻进入吸氧排二氧化碳阶段,珊瑚虫不活跃。霜鹿角珊瑚一般从母枝上截取10~20 mm的分枝作为培育断枝。膨胀蔷薇珊瑚、盾形陀螺珊瑚、十字牡丹珊瑚和澄黄滨珊瑚一般截取面积为20×20 mm的正方形方块。断枝截取后迅速将其用凝胶培养基固定在培育皿中。将固定好的繁殖小片放回海水人工养殖系统中暂养,等待海区移植实验进行。5种珊瑚各制备100株断枝进行移植实验。
1.3 实验海区选择
综合分析深圳大鹏半岛周边珊瑚生长情况、水文、气象、地质结构以及生物资源等环境因子,选择深圳市大鹏新区大澳湾海域(114°28′13.9″E, 22°33′08.1″N)作为此次实验海区(图2)。大澳湾海区水流不大,水交换率相对较好,水深小于10 m,水质达国家二类以上[19]。同时底质表层是具有少量泥沙的硬质底层,周边已有较为丰富的珊瑚覆盖,符合珊瑚断枝培育的海区选择标准[20]。
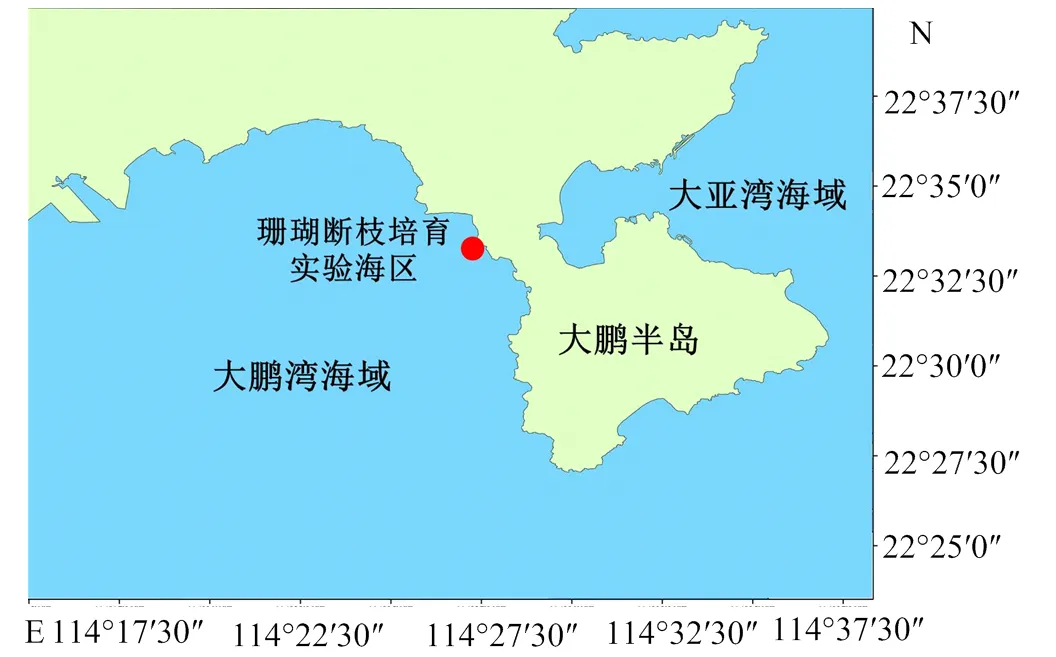
图2 珊瑚断枝培育实验海区
1.4 海区断枝培育系统构建
研究团队制作并在实验海区投放断枝培育系统(图3)。断枝培育系统以钢筋混凝土材质的空心半圆锥礁体稳固基底,以玻璃钢材质构建悬空网圃结构,具有较强抗海流和耐腐蚀能力。除提供珊瑚断枝培育功能,其礁体结构可以为其他珊瑚礁生物提供栖息空间,形成一个多维空间的小型生态系统。断枝培育系统的半圆锥礁体在陆地上制作完成,再由海上吊机平台在实验海区进行定点精确投放,然后由专业潜水员潜水拼接网圃与半圆锥礁体,组装成完整的珊瑚断枝培育系统。
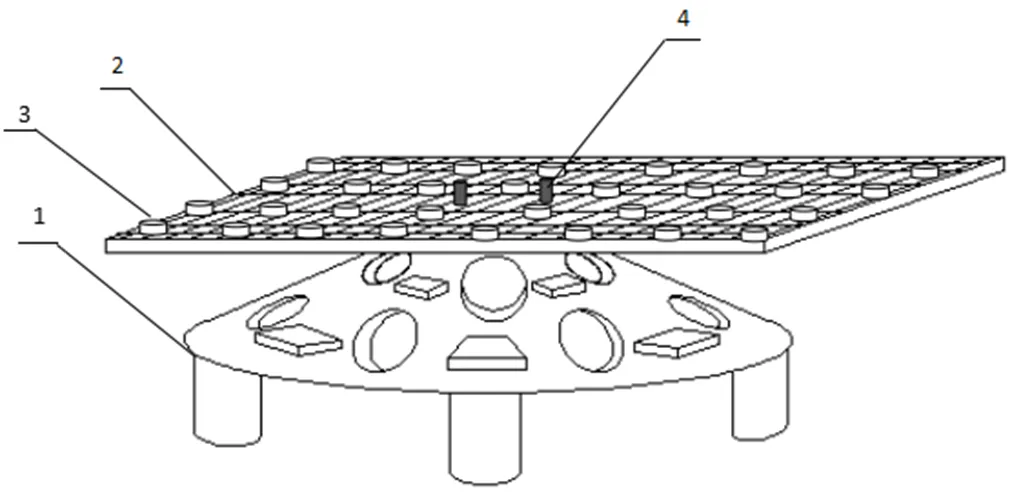
1.礁体;2.网圃;3断枝培育皿;4.礁体与网圃连接固定装置
1.5 珊瑚断枝海区培育
为方便后续存活率、生长情况数据的测量与记录,将制备好的珊瑚断枝编号,由专业潜水员分批移至实验海区断枝培育系统上进行培育。每个月定期组织专业潜水员对断枝培育系统进行维护,主要清理断枝培育系统上生长的藻类、沉积物、鱼线和渔网等,尽量保持珊瑚断枝生长不受外界不利条件的影响。
1.6 珊瑚断枝生长情况和存活情况检测
根据团块状和分枝状珊瑚的生长特点,测量珊瑚断枝的基部扩展长度、横向扩展长度、纵向扩展长度来评估珊瑚断枝在海区生长的情况(图4),统计分枝状珊瑚分枝增加数目;对珊瑚杯比较松散的珊瑚,则增加珊瑚杯测量数目,如盾形陀螺珊瑚。通过这些指标评估珊瑚生长趋势。造礁石珊瑚根据其生长形态可分为团块状、分支状、扁平皮壳状、叶片状等类型。此次进行培育的5种珊瑚分别属团块状(澄黄滨珊瑚、盾形陀螺珊瑚)、扁平皮壳状(膨胀蔷薇珊瑚)、叶片状(十字牡丹珊瑚)和分枝状(霜鹿角珊瑚)的种类。从基部长度、横向长度和纵向长度等3个方面对其生长情况进行综合全面评估。同时,经过长时间生长,很多分支会长出新侧枝,所以也有必要对新增分支数量进行统计,从而更全面评估其生长情况。对于团块状珊瑚、扁平皮壳状和叶片状珊瑚来说,其生长长度往往不及分支状珊瑚明显,主要以表面积增加状况进行衡量。由于盾形陀螺珊瑚杯分布比较稀疏,便于观察和统计,所以可用珊瑚杯数量作为评估其生长状况的一个参考。在测量断枝生长情况的同时,检测水温和盐度,探讨其生长相关性。根据季节变化,每4个月对5种珊瑚断枝存活的所有样本生长情况进行测量,最后随机抽取每种珊瑚断枝存活的30个样本作为代表进行统计分析,测量周期为12个月。
使用SPSS 18.0统计软件对珊瑚生长数据进行单因素方差分析、相关性分析和Duncan多重比较,以= 0.05作为差异显著水平,描述性统计值采用平均值±标准差表示。除对珊瑚断枝生长情况进行测量,也对珊瑚断枝存活情况进行记录统计,分别记录健康珊瑚断枝(颜色较正常、珊瑚虫活跃)数量、白化珊瑚断枝(珊瑚断枝表面有一半以上出现白化)数量、死亡珊瑚断枝(珊瑚断枝完全死亡只剩骨骼遗骸)数量等指标。

图4 海区珊瑚断枝测量
2 结果与分析
2.1 5种珊瑚断枝培育存活率
5种珊瑚断枝12个月存活率见表1。结果表明,膨胀蔷薇珊瑚存活率最高,存活率达96%;其次是盾形陀螺珊瑚和霜鹿角珊瑚,其存活率分别为95%和93%;十字牡丹珊瑚和澄黄滨珊瑚则出现了部分死亡的现象,死亡个体骨骼被沉积物、海藻和藤壶覆盖,存活率分别为85%和83%。
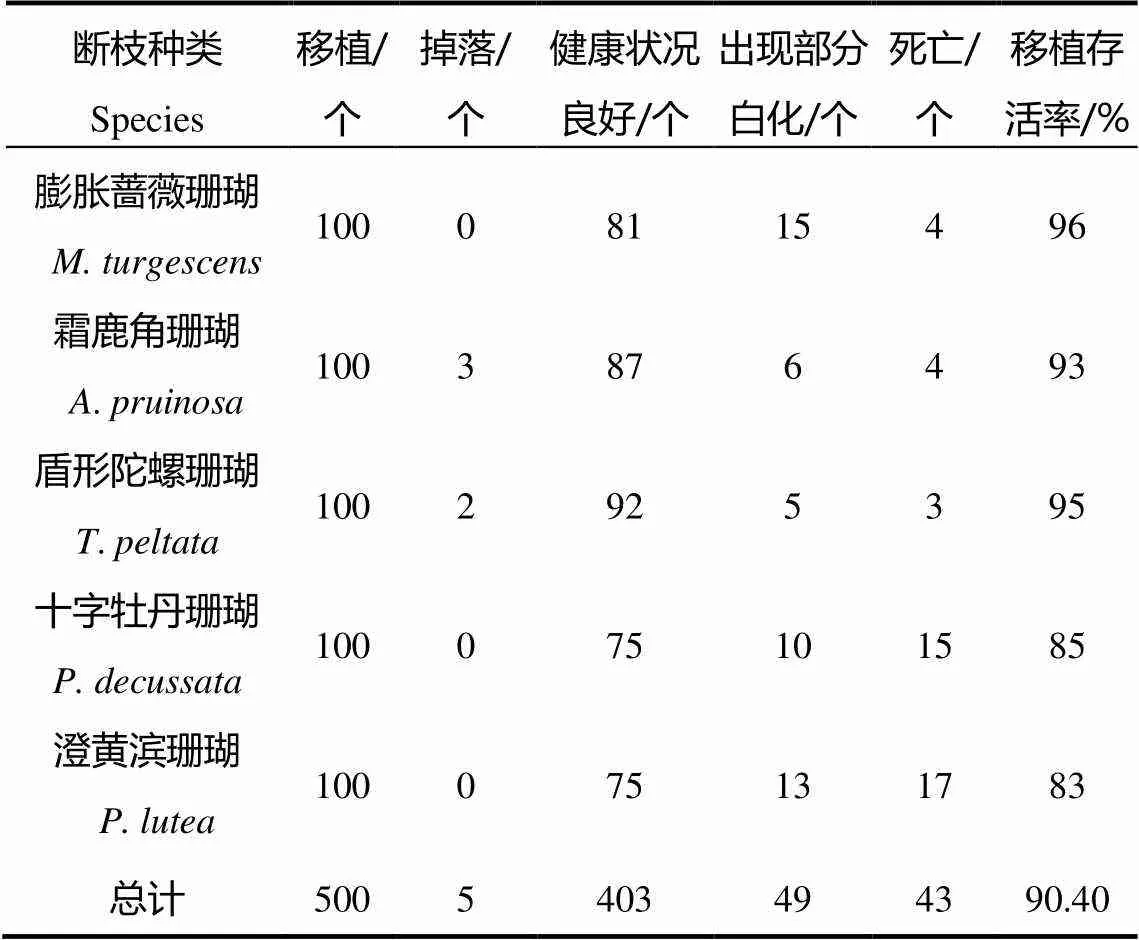
表1 5种珊瑚断枝12个月的存活率
2.2 5种珊瑚断枝培育生长情况
本研究5种珊瑚断枝培育生长情况见表2。霜鹿角珊瑚是5种珊瑚中生长速度最快的珊瑚,其断枝横向增长长度平均可达46.2 mm;其次是膨胀蔷薇珊瑚,其断枝横向伸长长度平均可达38.2 mm;而澄黄滨珊瑚是5种珊瑚中相对生长速度最慢的一种珊瑚,横向伸长长度和纵向伸长长度都在24 mm以下。从季节上看,5种珊瑚在夏秋季(平均水温25℃以上)的平均速度均快于春冬季(平均水温16℃)。
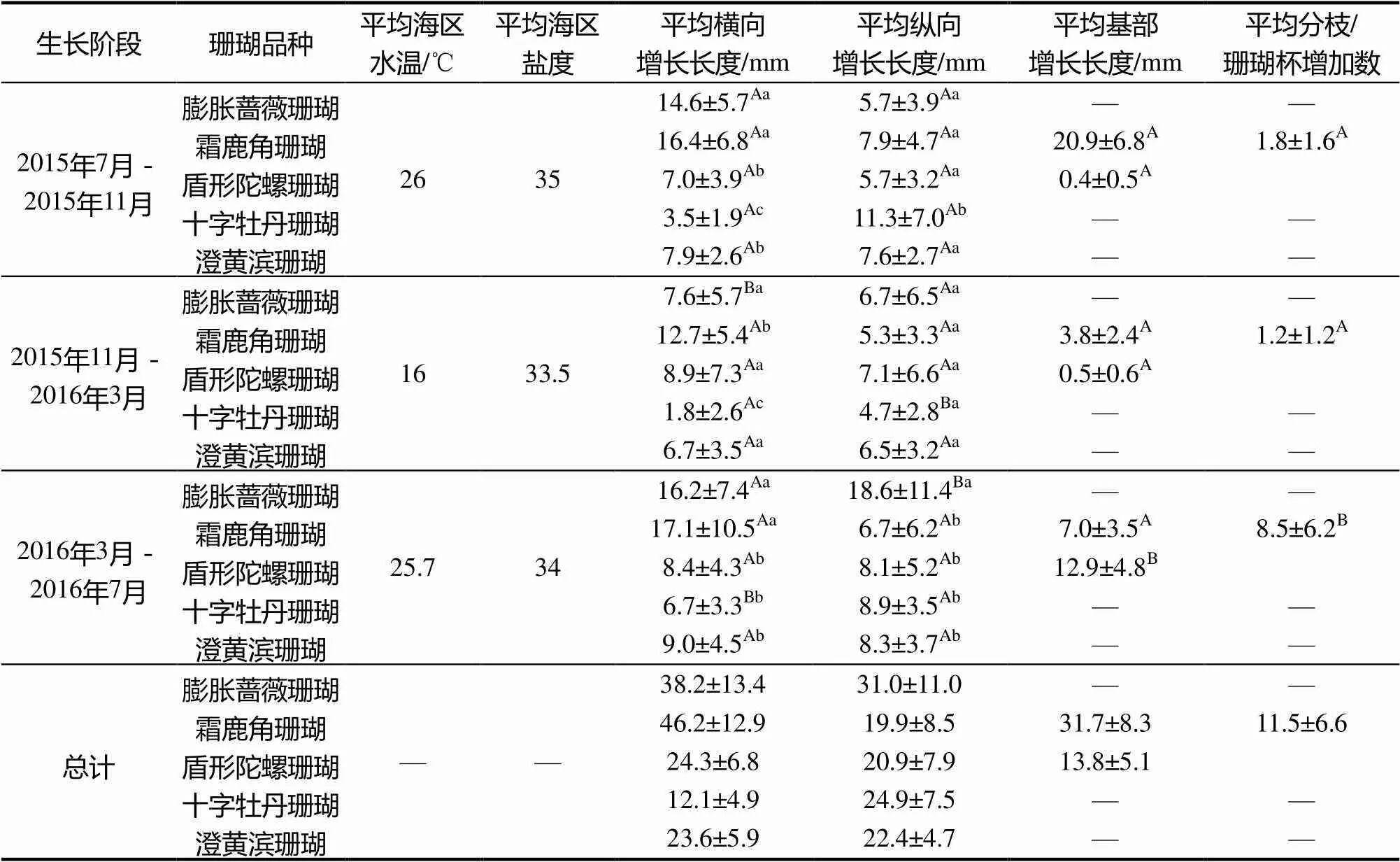
表2 珊瑚断枝12个月生长情况
注:不同大写字母表示单个检测项目中同种珊瑚不同生长阶段的生长数据差异显著(<0.05),不同小写字母表示单个<检测项目中不同珊瑚在同一阶段的生长数据差异显著(><0.05)。检测项目中不同珊瑚在同一阶段的生长数据差异显著(
3 讨论
3.1 5种珊瑚断枝生长测量及状况对比
珊瑚断枝生长测量的方法需根据其不同形状类型进行选择。对于分支状珊瑚断枝,如果只是以断枝总高度或总长度作为生长情况的衡量标准会有失偏颇。如20世纪90年代时国外学者曾经仅以鹿角珊瑚的纵向生长高度作为其生长的单一指标来衡量其生长率[21],而近10年来国内外学者对鹿角珊瑚生长率的测量则增加了横向长度、基部长度、分枝数、浮重等多个指标[13, 22-24]。本研究测量发现实际生长情况中有的分枝状珊瑚横向分枝生长状况会优于纵向分枝,有的情况则相反。
目前国外学者根据分子系统进化关系和骨骼钙化程度将现存造礁石珊瑚分为2大类群——坚实型类群(Robust)和复合型类群(Complex)[25]。Romano等[26]认为坚实型珊瑚骨骼钙化程度较高,具有坚实的骨骼结构,外观主要以碟片状和团块状为主,而复合型珊瑚骨骼钙化程度较低,具有较为复杂多变的生长形态。本研究5种造礁石珊瑚均属于典型复合型珊瑚,且其外观形态特征具有明显差异。国外相关珊瑚断枝培育研究报道中,主要以无性繁殖(生长)速度快的鹿角珊瑚科品种为研究对象[17]。陈刚等[14]在研究中同时移植了坚实型珊瑚和复合型珊瑚2大类群,以鹿角珊瑚为代表的复合型珊瑚在无性繁殖(生长)速度上明显优于坚实型珊瑚。本研究5种造礁石珊瑚都具有较为理想的无性繁殖(生长)速度,尤以鹿角珊瑚科2个品种(霜鹿角珊瑚和膨胀蔷薇珊瑚)生长速度最快。
本研究发现水温对造礁石珊瑚海区无性繁殖具有较大影响,5种造礁石珊瑚在水温20℃以上的月份无性繁殖(生长)速度明显优于水温20℃以下的月份。Okubo等[27]采用2种鹿角珊瑚断枝进行海区培育研究,其生长速度也受季节和海水温度变化影响,夏季无性繁殖(生长)速度明显优于冬季。国内鲍鹰等[15]曾在水质和水温条件相近的鹅公湾人工养殖基地开展霜鹿角珊瑚断枝培育研究,其4-12月份霜鹿角珊瑚断枝生长总长度约为17 mm,而本研究在自然海域培育的霜鹿角珊瑚断枝在相似月份生长总长度可达32.6 mm(2016年7-11月和2017年3月-7月)。这种差异显示,在珊瑚断枝培育技术应用中,自然海域培育环境相比人工养殖系统具有显著的促进珊瑚生长优势。此外自然海域培育相比人工养殖系统还可以大大降低培育成本,方便扩大培育规模和开展后续海区自然修复等[13]。
3.2 海区断枝培育系统的使用
Edwards等[13]编纂的珊瑚礁修复手册提及开展珊瑚断枝培育工作短时间内可以取得比较显著的培育效果,但也存在很大的移植培育失败风险,需慎重评估移植培育海区情况后才能进行科学合理的珊瑚培育工作。目前,国内外许多海区进行珊瑚断枝培育实验时往往只用简单框架结构作为支撑而在海底构建培育平台[14-15, 27-28]。但自然海域培育环境容易遭受极端气候灾害和生物敌害的影响,这也是目前自然海区开展珊瑚断枝培育最大的风险因素,在很多实践和研究报道中这种平台常常会受自然灾害(例如海啸和台风)的损坏,使得培育工作功亏一篑[17]。我国珊瑚礁或珊瑚群落主要集中在南海诸岛、海南沿海、广东沿海,这些海域每年夏季都会受到台风影响。许多自然的珊瑚礁资源往往在台风过境时受到严重损伤和破坏。因此,搭建稳定的海区珊瑚断枝培育系统,进行科学的培育系统管理与维护成为降低海区珊瑚断枝培育失败风险的关键。本研究使用海区断枝培育系统以钢筋混凝土结构制作的礁体作为支撑基底。一方面,这种基底经过了水动力学测试,具有消波减浪功能,为珊瑚繁殖小片构建了稳固安全的平台;另一方面,由于支撑基底抬高了整个培育系统,可以保证培育的珊瑚断枝在离海底较高位置生长,减少沉积物和捕食者的影响,改善生长环境;同时,支撑基底本身具有生物通道,为海洋生物提供栖息、庇护、繁衍等,与网圃上培育的珊瑚联合构成一个小型的生态系统,进一步促进珊瑚生长。
[1] SPALDING M D, GRENFELL A M. New estimates of global and regional coral reef areas[J]. Coral Reefs, 1997, 16(4): 225-230.
[2] COPPER P. Ancient reef ecosystem expansion and collapse[J]. Coral Reefs, 1994, 13(1): 3-11.
[3] 王丽荣, 赵焕庭. 珊瑚礁生态系统服务及其价值评估[J]. 生态学杂志, 2006, 25(11): 1384-1389.
[4] PETERSEN D. The role of sexual reproduction in captive population management—a review[J]. Advances in Coral Husbandry in Public Aquariums. Burgers' Zoo, Arnhem, 2008: 319-323.
[5] PETERSEN D, LATERVEER M, VAN BERGEN D, et al. The application of sexual coral recruits for the sustainable management of ex situ populations in public aquariums to promote coral reef conservation—SECORE Project[J]. Aquatic Conservation: Marine and Freshwater Ecosystems, 2006, 16(2): 167-179.
[6] 王淑红, 洪文霆, 陈纪新, 等. 珊瑚人工繁育技术研究进展[J]. 应用生态学报, 2015, 26(9): 2903-2912.
[7] CRUZ D W D , HARRISON P L . Enhanced larval supply and recruitment can replenish reef corals on degraded reefs[J]. Scientific Reports, 2017, 7(1):13985.
[8] 张浴阳, 黄晖, 黄洁英,等. 西沙群岛珊瑚幼体培育实验[J]. 海洋开发与管理, 2013, 30(b12):78-82.
[9] HIGHSMITH R C. Reproduction by fragmentation in corals[J]. Marine Ecology Progress Series. Oldendorf, 1982, 7(2): 207-226.
[10] CLARK S, EDWARDS A J. Coral transplantation as an aid to reef rehabilitation: evaluation of a case study in the Maldive Islands[J]. Coral Reefs, 1995, 14(4): 201-213.
[11] MILLER S L, McFall G B, Hulbert A W. Guidelines and recommendations for coral reef restoration in the florida keys national marine sanctuary: workshop report[M]. National Undersea Research Center, 1993: 1-85.
[12] FISK D A. Accelerated regeneration of hard corals: a manual for coral reef users and managers[M]. Great Barrier Reef Marine Park Authority, 1995.
[13] ALASDAIR J. EDWARDS. Reef Rehabilitation Manual[M]. Melbourne Australia:The Coral Reef Targeted Research & Capacity Building for Management Program. 2010: 1-123.
[14] 陈刚, 谢菊娘. 三亚水域造礁石珊瑚移植试验研究[J]. 热带海洋, 1995, 14(3): 51-57.
[15] 鲍鹰, 周学家, 黄美霞, 等. 鹿角珊瑚人工养殖的初步研究[J]. 海洋科学, 2012, 36(1): 69-72.
[16] 李元超, 兰建新, 郑新庆, 等. 西沙赵述岛海域珊瑚礁生态修复效果的初步评估[J]. 应用海洋学学报, 2014, 33(3):348-353.
[17] GUEST J R, DIZON R M, EDWARDS A J, et al. How quickly do fragments of coral “self‐attach” after transplantation?[J]. Restoration Ecology, 2011, 19(2): 234-242.
[18] 邹仁林. 中国动物志—造礁石珊瑚[M]. 北京: 科学出版杜, 2001:19-234.
[19] 谭上进, 朱小山, 周进, 等. 深圳近岸海域环境状况近10a变化趋势[J]. 海洋环境科学, 2014(1):154-160.
[20] 贾春斌, 黄敏红, 庄世鹏. 深圳珊瑚资源现状与保护对策[J]. 中国水产, 2008, 395(10):16-18.
[21] ATKINSON M J, CARLSON B, CROW G L. Coral growth in high-nutrient, low-pH seawater: a case study of corals cultured at the Waikiki Aquarium, Honolulu, Hawaii[J]. Coral Reefs, 1995, 14(4): 215-223.
[22] RENEGAR D A, RIEGL B M. Effect of nutrient enrichment and elevated CO2partial pressure on growth rate of Atlantic scleractinian coral Acropora cervicornis[J]. Marine Ecology Progress Series, 2005, 293: 69-76.
[23] 肖宝华, 廖宝林, 杨小东, 等. 光谱质量和光子照度对盾形陀螺珊瑚生长及代谢的影响[J]. 广东海洋大学学报, 2017,37(1):72-79.
[24] DUNN J G, SAMMARCO P W, LAFLEUR JR G. Effects of phosphate on growth and skeletal density in the scleractinian coral: A controlled experimental approach[J]. Journal of Experimental Marine Biology and Ecology, 2012, 411: 34-44.
[25] FUKAMI H, CHEN C A, BUDD A F, et al. Mitochondrial and nuclear genes suggest that stony corals are monophyletic but most families of stony corals are not (Order Scleractinia, Class Anthozoa, Phylum Cnidaria)[J]. PloS one, 2008, 3(9): e3222.
[26] ROMANO S L, PALUMBI S R. Molecular evolution of a portion of the mitochondrial 16S ribosomal gene region in scleractinian corals[J]. Journal of Molecular Evolution, 1997, 45(4): 397-411
[27] OKUBO N, TANIGUCHI H, MOTOKAWA T. Successful methods for transplanting fragments ofand[J]. Coral Reefs, 2005, 24(2): 333-342.
[28] GUEST J R, HEYWARD A, OMORI M, et al. Rearing coral larvae for reef rehabilitation[M] // EDWARDS A J. Reef Rehabilitation Manual. St. Lucia, Australia, 2010: 73-92.
Fragments Breeding Research of Hermatypic Corals in Natural Sea Area
DUAN Xiao-wei1,XIAO Bao-hua2,3,LIAO Bao-lin2,YANG Xiao-dong2,XIE Zi-qiang2,XIE Yong-qi2
(1/2.,518108,;3.524088,)
【】To study the conditions and methods for the asexual reproduction of hermatypic corals in natural sea area of Shenzhen, and built the garden of asexual reproduction in natural sea area.【】The the garden of fragments breeding were builted in natural sea area of Shenzhen. 5 species coral fragments have transplanted to the garden which included,,,,, and 100 coral fragments every specie were collected.【】Thecoral fragments grew normally in natural sea area during 12 months. The survival rate of 5 species coral fragments was 96%,93%,95%,85%,83%.The results of growth index measurement about 5 species coral fragments showed that thewas the fastest coral in growth (the average crosswise elongation was 46.2 mm). The second one was(the average crosswise elongation was 38.2 mm). The last one of 5 species coral was(the average crosswise elongation was less than 24 mm).【】The results showed that the survival rate and growth situation could be improved for using the garden of fragments breeding in suitable sea area.
hermatypic corals; coral fragments; fragments breeding
S968.9
A
1673-9159(2019)03-0115-06
10.3969/j.issn.1673-9159.2019.03.016
2019-01-10
海港建设和渔业产业发展专项(A201708D06);深圳市科技研发资金(JCYJ20170306095333329);大鹏新区产业发展专项资金(KY20160107)
段晓伟(1974-),男,硕士研究生,助理工程师,主要从事海洋生态保护研究。E-mail: 11384463@qq.com
肖宝华,高级工程师,主要从事海洋生态学,特别是珊瑚生态系统方面研究。E-mail: gdouxxhpaper@126.com
段晓伟,肖宝华,廖宝林,等. 造礁石珊瑚自然海区断枝培育技术研究[J]. 广东海洋大学学报,2019,39(3):115-120.
(责任编辑:刘岭)

