HPLC-加校正因子的主成分自身对照法同时测定琥珀酸索利那新原料药中7种有关物质Δ
郭青,刘莉,周自桂,秦勇1,#(1.中国药科大学中药学院,南京11198;.江苏神龙药业股份有限公司,南京 10046)
琥珀酸索利那新(Solifenacin succinate),由日本安斯泰来制药公司开发,2004年8月首次在欧洲上市,2004年11月获美国FDA许可在美国上市,琥珀酸索利那新能够抑制膀胱平滑肌收缩,且对尿频、尿急、尿失禁有较好的改善作用[1-3],与传统的抗胆碱药物相比,琥珀酸索利那新不良反应少、耐受性好[4-6],在多个国家被列为治疗膀胱过度活动症(OAB)的首选用药[7-8]。随着中国老龄化现象日益明显,OAB在中老年人群中发病率也越来越高,流行病学调查显示,我国OAB的患病率约有6.0%[9]。随着人们对OAB认知的增加,此类治疗药物将具有广阔的市场前景。琥珀酸索利那新在《欧洲药典》(EP)[10]和《美国药典》(USP)[11]中均有收载,但由于合成路线差异,EP中仅对琥珀酸索利那新原料药中的杂质A、C、D、I有所研究,李艳贞等[12]对琥珀酸索利那新原料药中5个杂质进行研究,相关文献[13-14]也仅对琥珀酸索利那新原料药中部分杂质进行研究,未全面监控琥珀酸索利那新原料药合成过程中可能产生的工艺杂质和潜在的降解杂质。为更好控制琥珀酸索利那新原料药质量,保证其用药的安全性和有效性,笔者建立高效液相色谱(HPLC)-加校正因子的主成分自身对照法同时测定琥珀酸索利那新原料药中7种有关物质的含量,为控制琥珀酸索利那新原料药的质量提供参考。琥珀酸索利那新原料药有关物质基本信息见表1。
1 材料
1.1 仪器
1260 HPLC仪,包括二极管阵列紫外检测器、Openlab CDS色谱工作站(美国Agilent公司);ALC-210千分之一分析天平、BT125D十万分之一分析天平均购自德国Sartorius公司;FE20 pH计(瑞士Mettler-toledo公司)。
1.2 药品与试剂
琥珀酸索利那新原料药(批号:171113、180117、180119、180502,纯度:99.93%)、琥珀酸索利那新对照品(批号:171113,纯度:99.93%)、杂质I对照品(批号:170817,纯度:99.60%)、杂质J对照品(批号:171019,纯度:99.80%)、杂质K对照品(批号:180328,纯度:95.30%)均购自江苏神龙药业股份有限公司;杂质A对照品(批号:170402,纯度:99.90%)、杂质L对照品(批号:161001,纯度:96.80%)均购自成都新恒创药业有限公司;杂质C对照品(批号:5-YDL-33-3,纯度:93.68%)、杂质D对照品(批号:5-YDL-40-2,纯度:96.00%)均购自加拿大TRC公司;乙腈为色谱纯,其余试剂均为分析纯,水为纯化水。
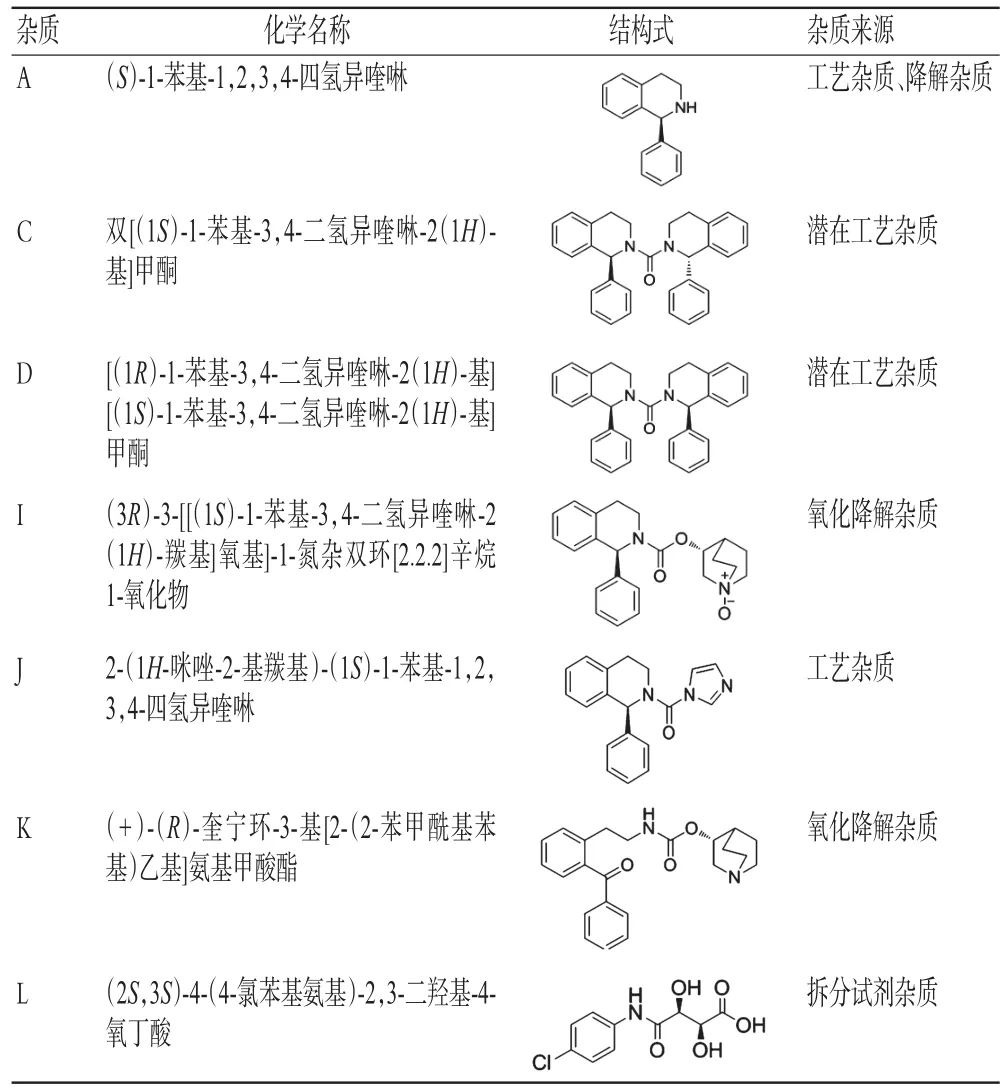
表1 琥珀酸索利那新原料药有关物质基本信息Tab 1 General information of related substance of solifenacin succinate raw material
2 方法与结果
2.1 色谱条件
色谱柱:Thermo Hypersil ODS C18(150 mm×4.6 mm,5 μm);流动相:0.02 mol/L KH2PO4(含 0.2%三乙胺,pH 3.0)(A)-乙腈(B)溶液为流动相,梯度洗脱;流速:1.2 mL/min;检测波长:210 nm;柱温:40 ℃;进样量:20 μL。梯度洗脱程序见表2。
2.2 溶液的制备
2.2.1 琥珀酸索利那新原料药供试品溶液 精密称取琥珀酸索利那新原料药10 mg,置于20 mL量瓶中,加溶剂(A与B以80∶20体积比混合而得,下同)溶解并定容,摇匀,即得。
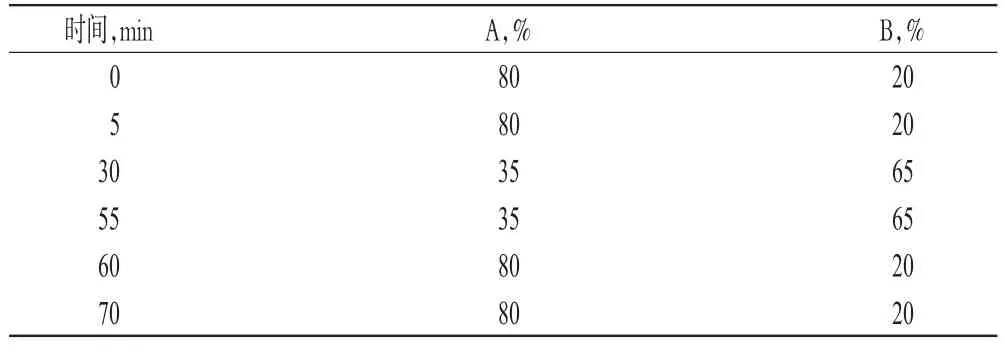
表2 梯度洗脱程序Tab 2 Gradient elution procedures
2.2.2 杂质对照品溶液 分别取杂质A、C、D、I、J、K、L对照品约12.5 mg,杂质L约1.87 mg,精密称定,分别置于25 mL量瓶中,加溶剂溶解并稀释制成杂质A、C、D、I、J、K质量浓度均为0.5 mg/mL,杂质L质量浓度为0.075 mg/mL的杂质对照品溶液。
2.2.3 琥珀酸索利那新对照品溶液 称取琥珀酸索利那新对照品10 mg,置于20 mL量瓶中,加溶剂溶解并稀释至刻度,即得每1 mL中约含0.5 mg的琥珀酸索利那新对照品母液;精密量取1 mL琥珀酸索利那新对照品母液,置于50 mL量瓶中,加溶剂溶解并稀释至刻度,摇匀;再从中精密量取1 mL,置于20 mL量瓶中,加溶剂溶解并稀释至刻度,摇匀,即得琥珀酸索利那新对照品溶液。
2.2.4 系统适用性试验溶液 精密移取“2.2.2”项下杂质对照品溶液各1 mL,置于同一100 mL量瓶中,加溶剂稀释制成杂质A、C、D、I、J、K质量浓度均为5 μg/mL,杂质L质量浓度为0.75 μg/mL的混合对照品贮备液;精密称取琥珀酸索利那新原料药10 mg,置于20 mL量瓶中,精密加入2 mL混合对照品贮备液,加溶剂溶解并定容,摇匀,即得系统适用性试验溶液。
2.3 系统适用性试验
精密量取空白溶液(溶剂)和“2.2”项下琥珀酸索利那新原料药供试品溶液、系统适用性试验溶液各20 μL,按“2.1”项下色谱条件进样测定,记录色谱图。结果,主成分峰与杂质峰之间、各杂质峰之间分离度良好,且分离度均>1.5,理论板数以杂质A峰计>2 000。系统适用性试验HPLC图见图1。
2.4 专属性试验
(1)酸破坏样品溶液。取琥珀酸索利那新原料药(批号:171113,下同)10 mg,置于20 mL量瓶中,加1 mol/L盐酸溶液2 mL,于80℃水浴放置3 h后,放冷,加1 mol/L氢氧化钠溶液2 mL中和,加溶剂溶解,定容,摇匀,即得。
(2)碱破坏样品溶液。取琥珀酸索利那新原料药10 mg,置于20 mL量瓶中,加1 mol/L氢氧化钠溶液2 mL,于80℃水浴放置3 h后,放冷,加1 mol/L盐酸溶液2 mL中和,加溶剂溶解,定容,摇匀,即得。
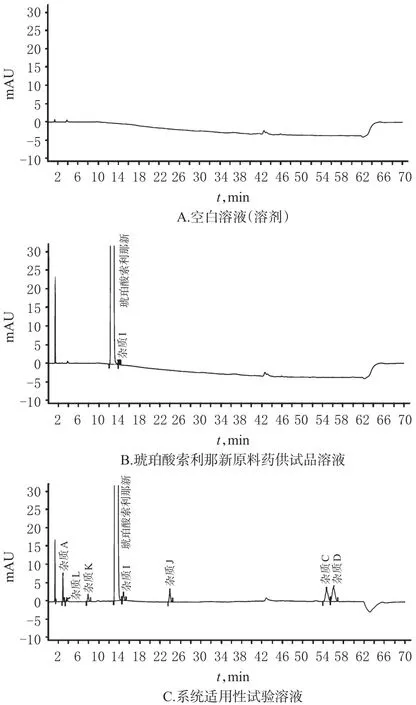
图1 系统适用性试验HPLC图Fig 1 HPLC chromatograms of system suitability test
(3)氧化破坏样品溶液。取琥珀酸索利那新原料药10 mg,置于20 mL量瓶中,加3%过氧化氢溶液2 mL,于80℃水浴放置1 h,放冷,加溶剂溶解,定容,摇匀,即得。
(4)高温破坏样品溶液。取琥珀酸索利那新原料药适量,置于105℃烘箱中放置3 h,取出放冷,取10 mg,置于20 mL量瓶中,加溶剂溶解,定容,摇匀,即得。
(5)光照破坏样品溶液。取琥珀酸索利那新原料药10 mg,置于20 mL量瓶中,加溶剂溶解,置于强光照射试验箱(4 500±500)lx照射24 h后取出,放至室温,定容,摇匀,即得。
(6)未破坏样品溶液。取琥珀酸索利那新原料药10 mg,置于20 mL量瓶中,加溶剂溶解,定容,摇匀,即得。
取上述各样品溶液20 μL,按“2.1”项下色谱条件进样测定,记录色谱图。结果,琥珀酸索利那新原料药在酸、高温、光照条件下均较为稳定,基本无降解产物产生,在碱破坏、氧化破坏条件下有不同程度的降解,主要生成杂质A、I、K。降解产物与主峰以及杂质峰间均能达到基线分离,且分离度均>1.5,说明本法的专属性较强。专属性试验HPLC图见图2。
2.5 线性关系考察
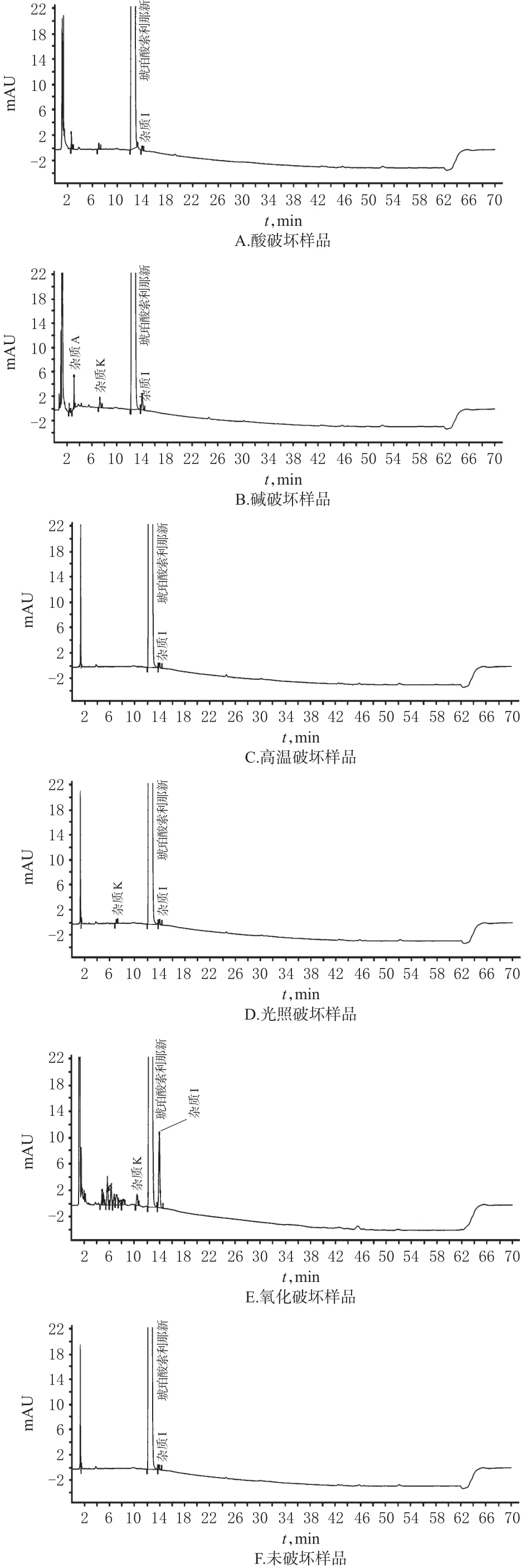
图2 专属性试验高效液相色谱图Fig 2 HPLC chromatograms of specific test
精密量取“2.2.2”项下杂质对照品溶液和“2.2.3”项下琥珀酸索利那新对照品母液适量,分别用溶剂进行稀释,即得杂质A质量浓度为0.148 1、0.246 8、0.394 8、0.493 5、0.592 2、0.740 3 μg/mL,杂质 C 质量浓度为0.142 9、0.238 2、0.381 0、0.476 3、0.571 6、0.714 5 μg/mL,杂质 D 质量浓度为 0.141 1、0.235 2、0.376 3、0.470 4、0.564 5、0.705 6 μg/mL,杂质I质量浓度为0.148 9、0.248 2、0.397 1、0.496 4、0.595 7、0.744 6 μg/mL,杂质J质量浓度为 0.152 0、0.253 3、0.405 3、0.506 6、0.607 9、0.759 9 μg/mL,杂质 K 质量浓度为 0.137 9、0.229 9、0.367 8、0.459 7、0.551 6、0.689 6 μg/mL,杂质 L 质量浓度为0.020 0、0.033 3、0.053 3、0.066 7、0.080 0、0.100 0 μg/mL,琥珀酸索利那新质量浓度为0.148 5、0.247 5、0.395 9、0.494 9、0.593 9、0.742 4 μg/mL的系列溶液。精密量取上述溶液20 μL,按“2.1”项下色谱条件进样测定,记录峰面积,以杂质A、C、D、I、J、K、L和琥珀酸索利那新的质量浓度(x)为横坐标,峰面积(y)为纵坐标进行线性回归,并以方程斜率(K)计算校正因子=K琥珀酸索利那新/K杂质。琥珀酸索利那新和各杂质的回归方程与校正因子见表3。
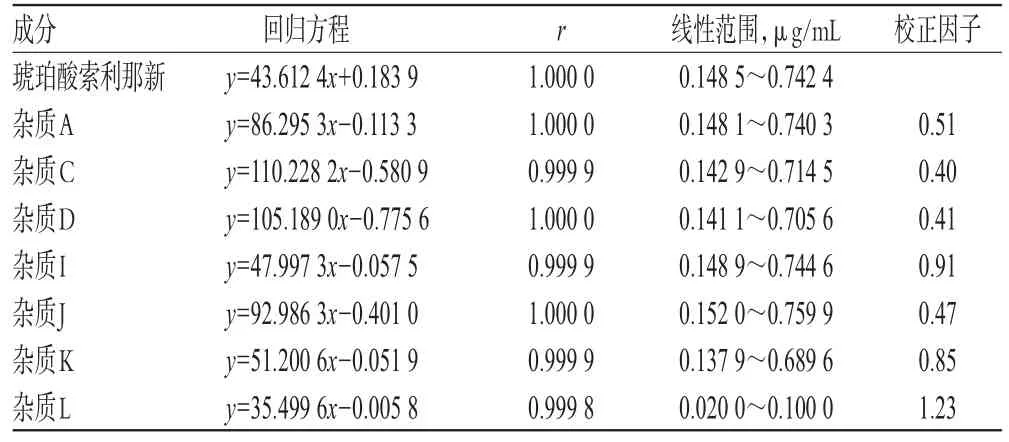
表3 琥珀酸索利那新和各杂质的回归方程与校正因子Tab 3 Regression equation and correction factors of solifenacin succinate and impurities
2.6 定量限与检测限考察
精密量取“2.2.2”项下杂质对照品溶液和“2.2.3”项琥珀酸索利那新对照品母液适量,逐级稀释,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。以信噪比为10∶1计算定量限,以信噪比为3∶1计算检测限。结果,琥珀酸索利那新和杂质A、C、D、I、J、K、L的定量限分别为0.148 5、0.148 1、0.142 9、0.141 1、0.148 9、0.152 0、0.137 9、0.020 0 μg/mL,检测限分别为0.049 5、0.049 3、0.047 6、0.047 0、0.048 1、0.050 7、0.046 0、0.006 7 μg/mL。
2.7 精密度试验
取“2.2.4”项下系统适用性试验溶液适量,按“2.1”项下色谱条件连续进样6次,记录峰面积。结果,琥珀酸索利那新和杂质A、C、D、I、J、K、L峰面积的RSD分别为1.01%、0.61%、0.57%、0.66%、0.75%、0.69%、0.61%、1.06%(n=6),表明仪器精密度良好。
2.8 稳定性试验
取“2.2.4”项下系统适用性试验溶液适量,分别于室温下放置0、5、10、15、20、24 h 后,按“2.1”项下色谱条件进样测定,记录峰面积。结果,琥珀酸索利那新和杂质A、C、D、I、J、K、L峰面积的RSD均<5.0%(n=6),表明系统适用性溶液在室温下放置24 h内稳定性良好。
2.9 重复性试验
按“2.2.4”项下系统适用性试验溶液制备方法制备供试品溶液共6份,按“2.1”项下色谱条件进样测定,记录峰面积。结果,琥珀酸索利那新和杂质A、C、D、I、J、K、L峰面积的RSD分别为0.76%、1.51%、1.12%、0.93%、1.10%、2.32%、2.08%、2.86%(n=6),表明本试验重复性良好。
2.10 加样回收率试验
精密称取琥珀酸索利那新原料药(批号:171113)10 mg,置于20 mL量瓶中,共9份,分别加入“2.2.4”项下溶液1.6、2.0、2.4 mL,再用溶剂稀释至刻度,即得分别相当于杂质限度为80%、100%和120%的供试品溶液。取上述供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积,以加校正因子的主成分自身对照法计算各杂质回收率。结果,杂质A、C、D、I、J、K、L的平均回收率分别为101.09%、97.58%、93.77%、98.56%、99.68%、97.07%、93.54%,RSD分别为0.75%、0.51%、0.47%、0.84%、0.70%、0.75%、1.21%(n=9)。回收率测定结果见表4。
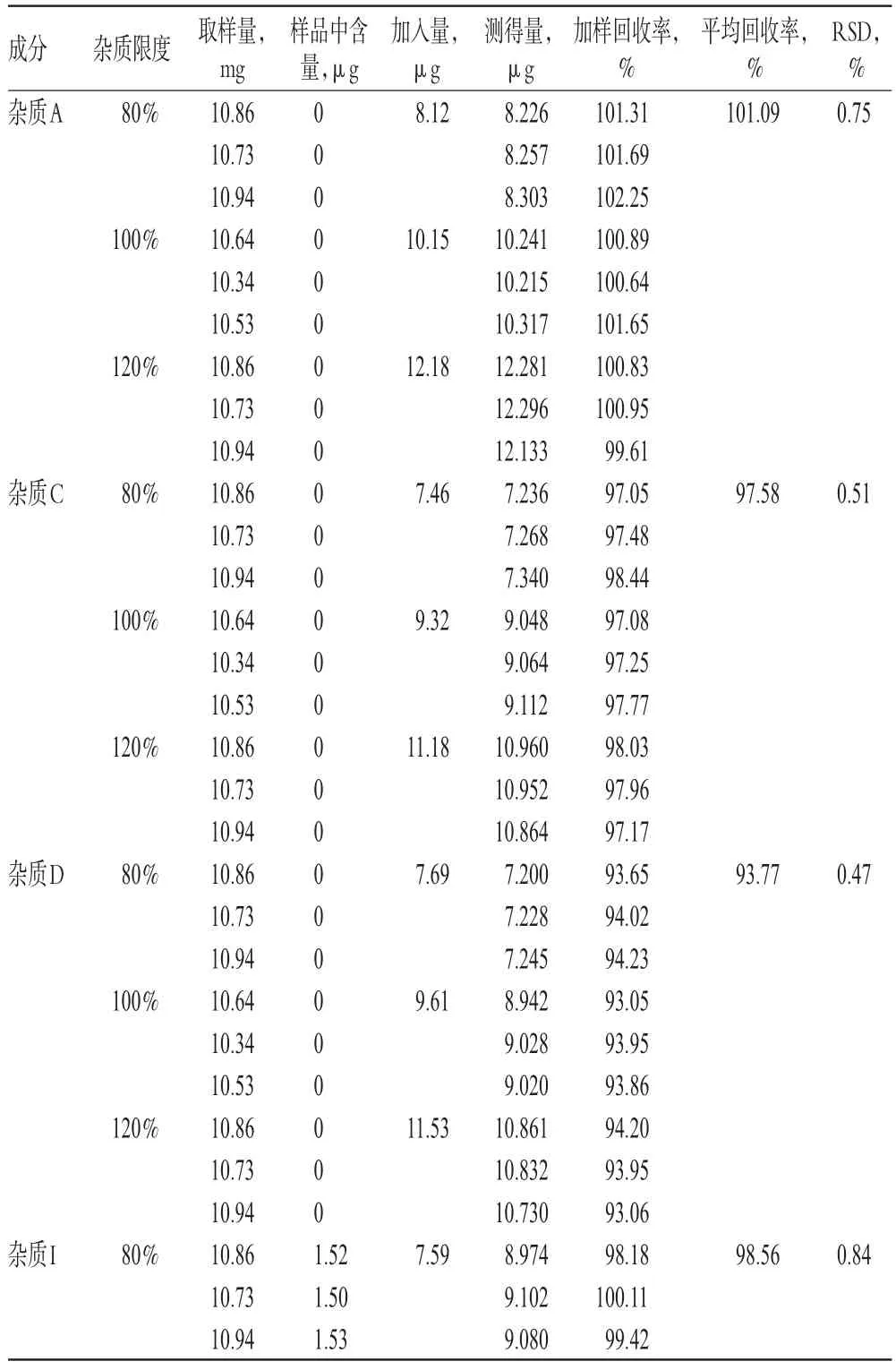
表4 回收率测定结果(n=9)Tab 4Results of recovery tests(n=9)
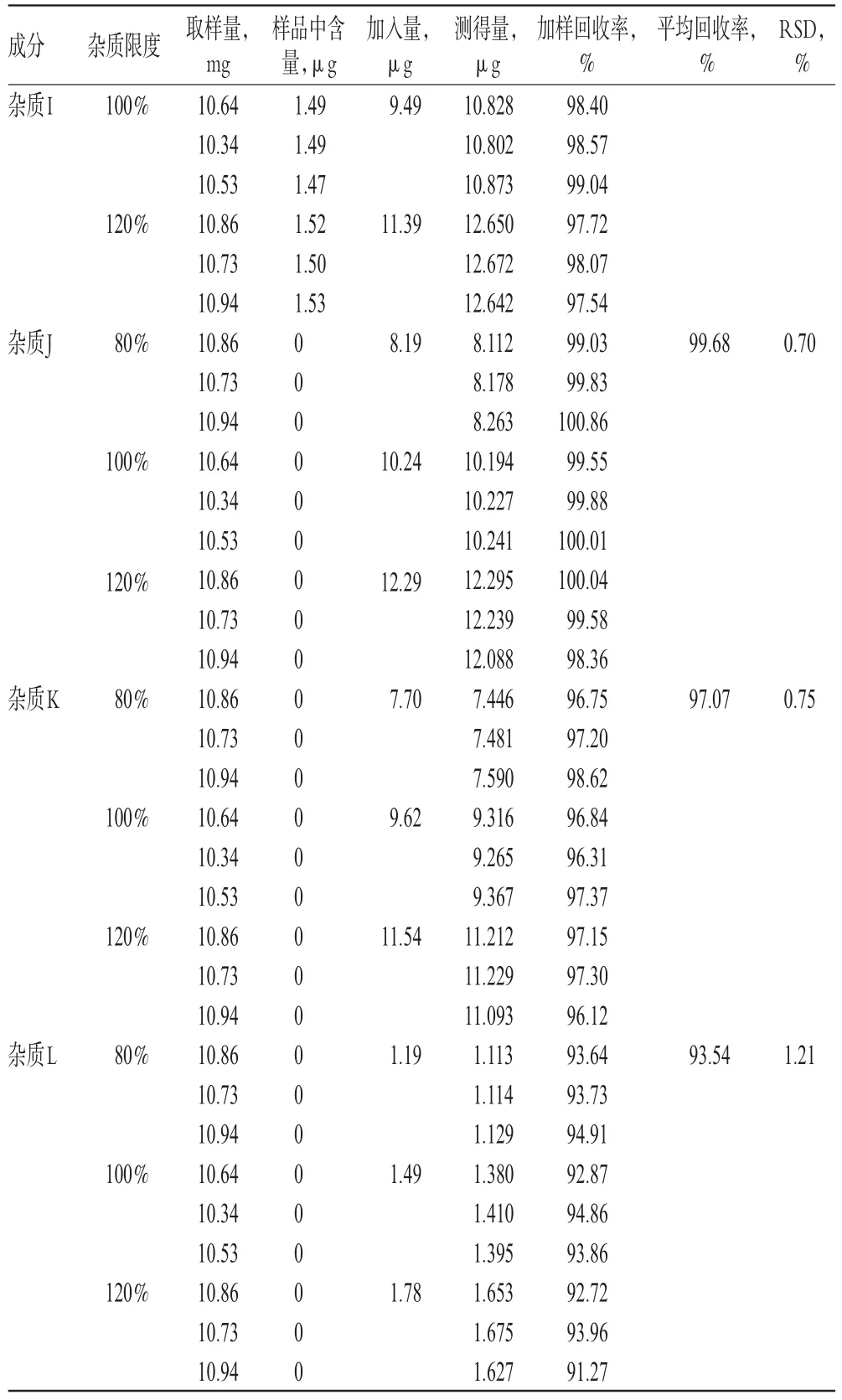
续表4Continued tab 4
2.11 样品中有关物质测定
取琥珀酸索利那新原料药3批,按“2.2.1”项下方法制备溶液,按“2.1”项下色谱条件进样测定,记录峰面积,并按加校正因子的主成分自身对照法计算各杂质的含量。结果,3批琥珀酸索利那新原料药中杂质I含量为0.015%~0.018%,其余杂质未检出。琥珀酸索利那新原料药中有关物质检测结果见表5。
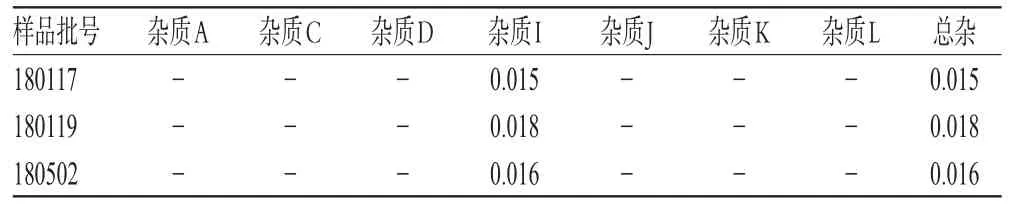
表5 琥珀酸索利那新原料药中有关物质检测结果(%%)Tab 5 Results of related substance determination in solifenacin succinate raw material(%%)
3 讨论
3.1 色谱条件选择
琥珀酸索利那新原料药在储存过程中可能会氧化降解产生杂质K,杂质L是潜在基因毒杂质,限度较低,需要较高的检测灵敏度;杂质J是合成过程中可能产生的工艺杂质,上述杂质在EP、USP中均未进行研究。笔者在前期比较了EP、USP对琥珀酸索利那新原料药中的有关物质的研究,EP中的方法对实验室条件要求苛刻,方法适用性有限,USP中的方法使主峰峰形欠佳;鉴于本研究中的几个杂质极性相差较大,无法采用现有标准的检测方法进行分析,经笔者前期筛选优化,以0.02 mol/L的KH2PO4(含0.2%三乙胺,pH 3.0)-乙腈溶液为流动相进行梯度洗脱时,能有效检出琥珀酸索利那新原料药在合成路径或降解途径中可能产生的杂质,且杂质之间、主成分峰与相邻杂质峰之间均能有效分离,且经验证表明,优化的色谱条件适用于本品有关物质测定。
3.2 波长、柱温、流动相的选择
笔者在前期试验中,分别考察在一定范围内改变检测波长(205~215 nm)、柱温(35~45℃)、初始流动相中乙腈比例(18%~22%)、流动相中三乙胺溶液浓度(0.18%~0.22%)、pH值(2.8~3.2)是否满足系统适用性和灵敏度要求,同时考察在一定范围内色谱条件改变对样品测定结果的影响。研究发现,流动相pH为2.8时,杂质L与相邻溶剂峰之间分离度欠佳,pH为2.9时分离度符合要求,pH为3.0时分离效果最佳;其他各考察条件在一定范围内改变对供试品检测无影响。
3.3 各杂质限度拟定
根据人用药品注册技术要求国际协调会议(ICH)的指导原则[15],结合各国药典规定的各杂质限度,拟定琥珀酸索利那新杂质限度为杂质A、C、D、I、J、K均不得超过0.1%,杂质I不得超过0.015%,总杂不得超过0.3%。
综上所述,本研究建立的HPLC-加校正因子的主成分自身对照法灵敏、准确、可靠,可同时测定琥珀酸索利那新原料药中7种有关物质的含量,可为琥珀酸索利那新原料药的质量控制提供参考。

