基于碘乙酸功能化树枝状聚合物的硫巯化肽段选择性富集新方法
吴 琼,袁辉明,翁叶靖,随志刚,张晓丹,胡晔晨,梁 振,张丽华*,张玉奎
(1.中国科学院分离分析化学重点实验室,中国科学院大连化学物理研究所,辽宁 大连 116023;2.中国科学院大学,北京 100049)
蛋白质的半胱氨酸(Cys)残基是最具活性的氨基酸残基之一,不仅经常参与酶反应,而且还能够形成可逆的氧化翻译后修饰(oxPTM)[1]。蛋白质的硫巯化修饰,将巯基(-SH)转换成硫巯基(-SSH),是一种重要的可逆oxPTM[2,3]。作为气体信号分子H2S信号传导的一种途径,自2009年[3]提出以来,蛋白质的硫巯化修饰就引起了广泛的关注。硫巯化修饰能够调节蛋白质的活性和功能,如组蛋白脱乙酰酶Sirtuin-1(SIRT1)在Cys371发生的硫巯化修饰,增强SIRT1与锌离子的结合,进而促进去乙酰化活性[4];三磷酸腺苷合酶α亚基(ATP5A1)在Cys244发生的硫巯化修饰,能够增强其活性,防止线粒体介导的细胞凋亡[5]。硫巯化修饰的早期研究多数是基于单个蛋白质的鉴定及其后续功能研究[6-8],而组学水平表征硫巯化修饰蛋白质/肽段对其功能的研究具有重要意义,因此利用蛋白质组学的技术手段研究硫巯化修饰必不可少。然而,硫巯化蛋白质组学研究存在很大的挑战:硫巯基与巯基、二硫键相似的化学性质和反应活性使得他们之间难以区分;作为Cys的一种氧化翻译后修饰,硫巯化修饰肽段的丰度很低[9]。因此,发展高选择性的富集方法对于硫巯化蛋白质组学的研究必不可少。
随着蛋白质组学技术的不断进步,基于硫巯化蛋白质组的富集方法取得了一些重要成果。生物素硫醇法(biotin thiol assay,简称BTA)[10]和定量硫巯化位点鉴定法(quantitative persulfide site identification,简称qPerS-SID)[11]分别在2015年和2016年提出。BTA和qPerS-SID两种方法从原理上来说具有一定的相似性:首先,分别利用N-乙基马来酰亚胺和碘乙酰胺的生物素化试剂封闭蛋白质的巯基和硫巯基,使其生物素化;酶解后,采用链霉亲和素的琼脂糖凝珠进行亲和富集生物素化肽段;最后,加入还原试剂进行硫巯化肽段的释放(由-SSH还原成-SH)。此外,BTA方法中引入同位素标记的N-乙基马来酰亚胺可以实现硫巯化肽段的定量。利用BTA和qPerS-SID方法,Gao等[10]和Longen等[11]分别从小鼠胰腺细胞和HEK293细胞中鉴定到超过1 000和783条硫巯化修饰肽段,有效提高了硫巯化肽段的数据集。在这两种方法中,由于肽段洗脱时切除了硫巯化修饰位点,有两种情况可能导致鉴定的假阳性:首先,两个肽段通过“肽间”二硫键相互连接,其中一个肽段包含巯基进而被捕获,这将导致与硫巯化肽段类似的洗脱行为;其次,基于N-乙基马来酰亚胺和碘乙酰胺的烷基化试剂对Cys的另外一种氧化翻译后修饰(亚磺酰化,-SOH)也有微弱的反应活性。因此,BTA方法采取了低浓度的烷基化试剂进行选择性标记硫巯基,巯基肽段则不与之发生反应,从提高反应特异性角度来降低鉴定假阳性。qPerS-SID方法则引入了基于细胞培养稳定同位素标记技术(stable isotope labeling with amino acids in cell culture,SILAC)进行定量分析来降低鉴定假阳性,并且得出第一种情况的假阳性仅占1.32%,可以忽略不计。这两种方法均采用生物素化的烷基化试剂标记硫巯化蛋白质,再进行亲和富集,由此带来的缺点是:内源性生物素化肽段的共洗脱会对后续的亲和富集造成干扰[12],导致富集选择性的降低;先标记再富集的多步实验操作也会造成样品的损失,不利于低丰度样品的鉴定。
为了避免内源性生物素化肽段的干扰和简化实验流程,本文合成了碘乙酸功能化的聚酰胺-胺树枝状聚合物(PAMAM-INS),并结合滤膜辅助的样品预处理技术用于硫巯化肽段的选择性富集,简称为FADE (filter aided dendrimer enrichment)策略。与BTA和qPerS-SID方法相比,本方法一步实现硫巯化肽段的标记与富集,简化了实验流程;不借助生物素与亲和素之间的亲和富集作用,有效避免了内源性生物素化肽段造成的干扰,有效提高了富集选择性。为了降低还原洗脱带来的鉴定假阳性,在FADE策略的基础上引入SILAC定量分析浓度梯度硫氢化钠刺激的人神经母瘤细胞(SHSY5Y)中硫巯化蛋白质组,该策略简称为增强的FADE策略(eFADE)。
1 实验部分
1.1 仪器与试剂
采用Spectrum GX红外光谱仪(铂金埃尔默,美国)对聚合物进行傅里叶红外光谱表征;采用全波长酶标仪Multiskan GO(赛默飞科技,美国)进行分光光度测定;采用Ultraflex Ⅲ TOF/TOF质谱仪(布鲁克,德国)用于标准肽段和BSA酶解产物的分析;采用EASY-nLCTM1200色谱系统与Orbitrap Fusion Lumos质谱仪(赛默飞科技,美国)构建纳升级系统(nano-RPLC-ESI-MS/MS)用于人神经母瘤细胞(SHSY5Y)中硫巯化肽段的富集分析。
截留相对分子质量为10 kDa的滤膜购于赛多利斯(德国);熔融石英毛细管(150 μm i.d.,375 μm o.d.)购自Polymicro Technologies(美国);Venusil XBP C18硅胶填料(粒径5 μm,孔径15 nm)购自博纳艾杰尔(中国);Reprosil-PurC18-AQ填料(粒径1.9 μm,孔径12 nm)购自Dr.Maisch(德国);真空浓缩仪购自赛默飞科技(美国);所有实验用水均经过Milli-Q(美国)水处理系统处理。
聚酰胺-胺树枝状聚合物Generation 6.0(PAMAM,Mr=58 046.11 Da,质量浓度5%)、碘乙酸N-羟基琥珀酰亚胺酯(INS)、牛血清白蛋白(BSA,纯度>96%)、牛胰蛋白酶(trypsin)、盐酸胍(纯度≥99%)、蛋白酶抑制剂cocktail、二硫苏糖醇(DTT,纯度≥99%)、碘乙酰胺(IAA,纯度≥99%)、5,5′-二硫双(2-硝基苯甲酸)(DTNB,纯度≥98%)、三羟甲基氨基甲烷(Tris,纯度≥99.8%)、三(2-羰基乙基)磷盐酸盐(TCEP,纯度≥98%)、甲酸(FA,纯度98%)、硫氢化钠(NaHS)、三氟乙酸(TFA,纯度99%)、氨水(纯度≥99.9%)购自Sigma-Aldrich公司(美国);硫化钠(Na2S,纯度>90%)购于百灵威科技有限公司(中国);标准肽段LP9(序列为LEACTFRRP,纯度98%)购于强耀生物科技有限公司(中国);乙腈(ACN,纯度≥99.9%)、甲醇(纯度≥99.9%)、异丙醇(纯度≥99.9%)购自Merck公司(德国);α-氰基-4-羟基肉桂酸(CHCA)购于Bruker Daltonics公司(德国);BCA蛋白质浓度测定试剂盒购于碧云天生物科技公司(中国);乙二胺四乙酸(EDTA,纯度99%)、氯化钠(纯度≥99.5%)购于科密欧化学试剂有限公司(中国);其他试剂均至少为分析纯。
1.2 PAMAM-INS的合成
称取6 mg INS,加入400 μL甲醇和200 μL,50 mmol/L pH 8.0 PB(磷酸缓冲盐),振荡使其完全溶解。称取32 mg PAMAM溶液,逐滴加入INS溶液中,振荡使其混合均匀,在室温进行振荡反应3 h。反应完毕,将聚合物材料转移到10 kDa滤膜中,离心去除未反应的INS,用400 μL PB溶液清洗3次,最后加入200 μL PB溶液,得到PAMAM-INS,于4 ℃保存。
1.3 PAMAM-INS中碘乙酰基固载量的测定
采用茚三酮与氨基的显色法测定聚合物中碘乙酰基固载前后伯氨基含量的差异,以此来计算碘乙酰基的固载量,具体如下:配制0.10、0.20、0.40、0.60、0.80和1.00 mmol/L的正己胺乙醇溶液,利用正己胺做标准曲线,同时做试剂空白对照。
配制0.35%(质量体积分数,下同)的茚三酮乙醇溶液,取100 μL茚三酮乙醇溶液与400 μL上述正己胺系列溶液于60 ℃以1 000 r/min的速度振荡混匀30 min。反应完毕,取出200 μL紫色反应产物,加到96孔板中,利用全波长酶标仪测定580 nm处的光吸收。以吸光度值为纵坐标、伯氨基浓度(mmol/L)为横坐标,绘制标准曲线。
配制0.05 g/L PAMAM乙醇溶液和0.05 g/L PAMAM-INS乙醇溶液,分别取出400 μL与100 μL 0.35%茚三酮乙醇溶液反应,反应条件同上(于60 ℃以1 000 r/min的速度振荡混匀30 min)。反应完毕,进行吸光度值测定。将得到的吸光度值带入正己胺标准曲线中,算出碘乙酰基固载前后聚合物中伯氨基浓度的差异,即可算出碘乙酰基在聚合物上的固载量。计算公式如下:
(1)
其中,Q为碘乙酰基的固载量(mg/g),C1为PAMAM中伯氨基的浓度(mmol/L),C2为PAMAM-INS中剩余伯氨基的浓度(mmol/L),V为PAMAM-INS的体积(mL),Mr为碘乙酰基的相对分子质量,m为PAMAM-INS的投入量(mg)。
1.4 硫巯化标准肽段的合成
在2 mmol/L标准肽段LP9溶液中,加入20 mmol/L的DTNB溶液,于37 ℃反应30 min后,再加入200 mmol/L的Na2S溶液,于37 ℃反应30 min后进行液相色谱的除盐,冻干。复溶于水,使用完毕通氮气进行保存,防止硫巯化修饰发生氧化。
1.5 标准蛋白BSA的酶解
将1 g/L BSA溶液于95 ℃变性5 min,加入终浓度为10 mmol/L的DTT,于56 ℃还原1 h。随即加入终浓度为25 mmol/L的IAA进行烷基化30 min,加入25 μg trypsin,于37 ℃水浴中酶解10 h。加入甲酸终止反应,进行液相色谱的除盐。
1.6 FADE策略的抗干扰能力评价
将合成的硫巯化标准肽段LP9与BSA的酶解产物按照质量比1∶100混合,随即转移到合成好的PAMAM-INS中,于40 ℃在10 kDa滤膜中反应12 h。反应完毕,分别采用2 mol/L氯化钠溶液、4%氨水溶液、50%异丙醇水溶液(含0.1%TFA)、蒸馏水清洗滤膜各两次。于56 ℃水浴中,加入终浓度为10 mmol/L的TCEP进行硫巯化肽段的释放,离心得到洗脱液。将标准肽段LP9与BSA的酶解产物的混合物(富集前样品)、最后一次的非特异性吸附淋洗液以及富集洗脱液分别进行MALDI-TOF检测。
1.7 SHSY5Y细胞的培养和蛋白质提取
SHSY5Y细胞培养:分别用天然同位素氨基酸(12C6-lysine和12C614N4-argine)和重同位素标记的氨基酸(13C6-lysine和13C615N4-argine)、10% FBS以及1% DMEM培养基置于37 ℃恒温培养箱中,在5% CO2气体浓度条件下进行培养细胞,经过多次传代使细胞标记完全,得到SILAC轻标(12C6-lysine和12C614N4-argine)和重标(13C6-lysine和13C615N4-argine)的SHSY5Y细胞,其中重标细胞平行培养3份。待细胞长到80%~90%的融合度之后,在3份重标细胞中分别加入终浓度为30、60和100 μmol/L的硫氢化钠溶液刺激细胞30 min。收集细胞悬液,反复吹打,以1 551 r/min的速度离心收集细胞,然后用1×PBS(磷酸缓冲盐,pH 7.4)清洗细胞3次。
分别提取4份细胞(1份轻标、3份重标)的蛋白质:将细胞分散在6 mol/L盐酸胍中,按照1%的体积比加入蛋白酶抑制剂cocktail,在冰浴中进行超声破碎。最后以14 725 r/min的速度离心40 min,收集上清,采用BCA法测定蛋白质浓度。
1.8 eFADE策略用于SHSY5Y细胞中硫巯化肽段的选择性富集
将轻标的SHSY5Y蛋白质溶液和3份重标的SHSY5Y蛋白质溶液分别按照各自的蛋白质浓度进行等质量的混合,得到3份轻重标混合的样品(每份均为1 mg蛋白质)。在95 ℃下变性10 min,随即转移到10 kDa滤膜中,离心去除盐酸胍。在每个滤膜中加入100 μL PB溶液,按照酶与蛋白质的质量比为1∶25加入胰蛋白酶,将滤膜置于37 ℃水浴中酶解,酶解溶液进行通氮气保护。16 h后,将滤膜进行离心,得到酶解产物。将3份酶解产物分别转移到等质量的PAMAM-INS中(保存在滤膜中),避光室温混匀12 h,分别进行3份样品的硫巯化修饰肽段的富集。分别采用2 mol/L氯化钠溶液、4%氨水溶液、50%异丙醇水溶液(含0.1%TFA)、蒸馏水清洗滤膜各两次,洗去非特异性结合的肽段。在56 ℃水浴中,每个滤膜加入终浓度为10 mmol/L的TCEP进行硫巯化肽段的释放,离心得到洗脱液。在洗脱液中,加入终浓度为20 mmol/L的IAA进行烷基化,除盐后冻干,进行Orbitrap Fusion Lumos质谱分析。
1.9 MALDI-TOF MS分析
将1 μL待分析物与1 μL CHCA基质(7 g/L溶于含0.1%TFA的60% ACN溶液)依次点于MALDI靶板上。采用固体激光Smart Beam技术(355 nm)及正离子反射模式进行MALDI-TOF MS分析。
1.10 Nano-RPLC-ESI-MS/MS分析及数据处理
采用EASY-nLCTM1200色谱系统与Orbitrap Fusion Lumos质谱仪构建纳升级系统用于SHSY5Y细胞中硫巯化肽段的鉴定。Nano-RPLC的分离条件如下:C18毛细管预柱(3 cm×150 μm,Venusil XBP C18,粒径5 μm,孔径15 nm)和C18毛细管分离柱(15 cm×150 μm,Reprosil-PurC18-AQ,粒径1.9 μm,孔径12 nm);流动相A:0.1%FA;流动相B:80%ACN+0.1%FA;流速:600 nL/min;流动相梯度设置:0~55.0 min,10.0%B~28.0%B;55.0~70.0 min,28.0%B~47.0%B;70.0~72.0 min,47.0%B~95.0%B;72.0~75.0 min,95.0%B。
Orbitrap Fusion Lumos质谱参数如下:质谱采集在数据依赖型(DDA)正离子模式下进行,完成一次全扫描及二级扫描的时间为3 s;喷雾电压为2.1 kV;离子传输毛细管温度为320 ℃;MS的扫描范围为m/z350~1 500,分辨率设为60 000,自动增益控制(AGC)设为4×105,离子最大累积时间设为50 ms;母离子采用高能碰撞碎裂模式(HCD)进行二级碎裂,碎裂能量为34%;MS/MS的分辨率设为15 000,AGC设为5×104,离子最大累积时间设为35 ms;动态排除窗口时间为20 s;选择电荷价态+2~+7的肽段进行碎裂。
将Orbitrap Fusion Lumos质谱仪上产出的raw文件首先用Proteome Discoverer软件(v2.2)中整合的Mascot(v2.4)进行数据库检索。FASTA数据库为UniProtKB human(release 2018_1119)。一级母离子的质量容忍度设置为10 ppm(10×10-6);二级碎片离子的质量容忍度设置为20 mmu。FASTA数据库在搜索前会被搜库软件自动转换成正-反库的形式。检索设置参数包括:甲硫氨酸的氧化(+15.99 Da)和蛋白质的N端乙酰化(+42.01 Da)设为可变修饰;添加SILAC标记赖氨酸(K6,+6.02 Da)和精氨酸(R10,+10.00 Da)及半胱氨酸的烷基化(+57.02 Da)设为固定修饰;添加胰蛋白酶的特异性酶切,并允许最多2个漏切位点。蛋白质鉴定至少包含一个唯一性肽段;输出结果中H/L定义为重标与轻标的比值。检索结果采用Proteome Discoverer软件中的Percolator模块进行过滤:控制肽段的FDR不大于1%,其他设置均为软件默认。
1.11 生物信息学分析
利用在线工具PANTHER(v14.0,http://pantherdb.org/)对硫巯化蛋白质参与的生物学过程、分子功能和通路进行分析。氨基酸序列分析采用pLogo(v1.2.0,https://plogo.uconn.edu/)。
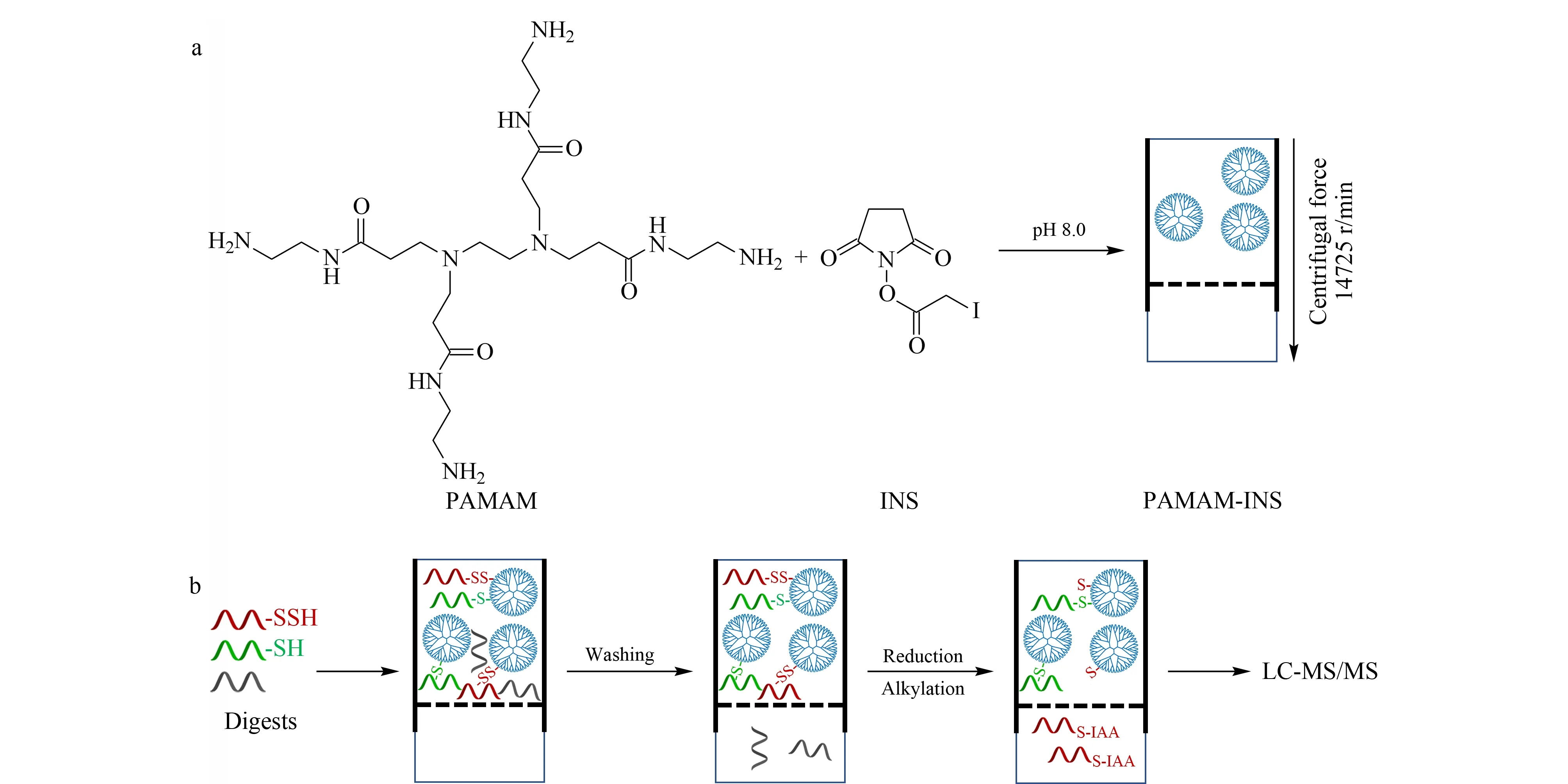
图1 (a)PAMAM-INS的制备及(b)FADE策略用于硫巯化肽段的富集流程Fig.1 Workflow of(a)the preparation of PAMAM-INS(polyamidoamine-iodoacetic acid N-hydroxysuccinimide ester)and (b)the FADE(filter aided dendrimer enrichment)strategy for the enrichment of persulfidated peptidesIAA:iodoacetamide.
2 结果与讨论
2.1 PAMAM-INS的制备及FADE策略的建立
PAMAM是一类具有高度支化三维结构的大分子[13],第六代的PAMAM外层含有256个表面伯氨基(58 046.11 Da),具有很好的生物相容性和亲水性。碘乙酸N-羟基琥珀酰亚胺酯(INS)是一种双异官能团交联剂,一端带有的N-羟基琥珀酰亚胺酯可以偶联到PAMAM表面的伯胺上,另一端的碘乙酰基可以与蛋白质的巯基/硫巯基进行特异性次级键合。基于上述化学反应,通过一步法合成了具有巯基和硫巯基反应活性的PAMAM-INS。如图1a所示,在避光的碱性条件下(pH 8.0),将INS溶液与PAMAM溶液进行均相反应(其中,INS物质的量相较于PAMAM是过量的)后转移至10 kDa滤膜,反应产物PAMAM-INS则被截留在滤膜上,通过离心可去除过量的INS。该制备策略具有如下优点:操作简单(一步即可合成)、液-液的均相反应体系加快传质过程,整个制备过程耗时不到5 h。因此,结合PAMAM-INS聚合物溶液的特性与滤膜辅助的样品预处理,FADE策略可以实现硫巯化肽段的一步标记与富集,简化了实验操作。具体过程如图1b所示,将实际样品的蛋白质酶解产物(不进行还原和烷基化处理)转移至滤膜中与PAMAM-INS聚合物溶液进行孵育,巯基和硫巯基肽段则被PAMAM-INS捕获从而截留在滤膜上,离心洗除非特异吸附之后,加入还原剂进行硫巯化肽段的洗脱(而巯基肽段仍被截留在滤膜上),烷基化后进行质谱鉴定,从而实现硫巯化肽段的选择性富集。
2.2 PAMAM-INS的红外光谱表征
对反应物及其产物进行了红外光谱的表征,如图2所示,在反应物INS中,1 724 cm-1属于酮基C=O的伸缩振动峰,1 044 cm-1属于C-N的伸缩振动峰,545 cm-1应属于C-I的伸缩振动峰。在PAMAM中,3 285 cm-1属于伯胺N-H的伸缩振动峰,2 938 cm-1和2 820 cm-1属于亚甲基的伸缩振动峰,1 633 cm-1属于酰胺键中C=O的伸缩振动峰,1 541 cm-1属于N-H的弯曲振动峰,1 026 cm-1属于C-N的伸缩振动峰。PAMAM-INS与PAMAM的谱峰类似,但是在600~500 cm-1区间内多了533 cm-1的吸收峰,归属于C-I的伸缩振动峰,证明PAMAM-INS的制备成功。
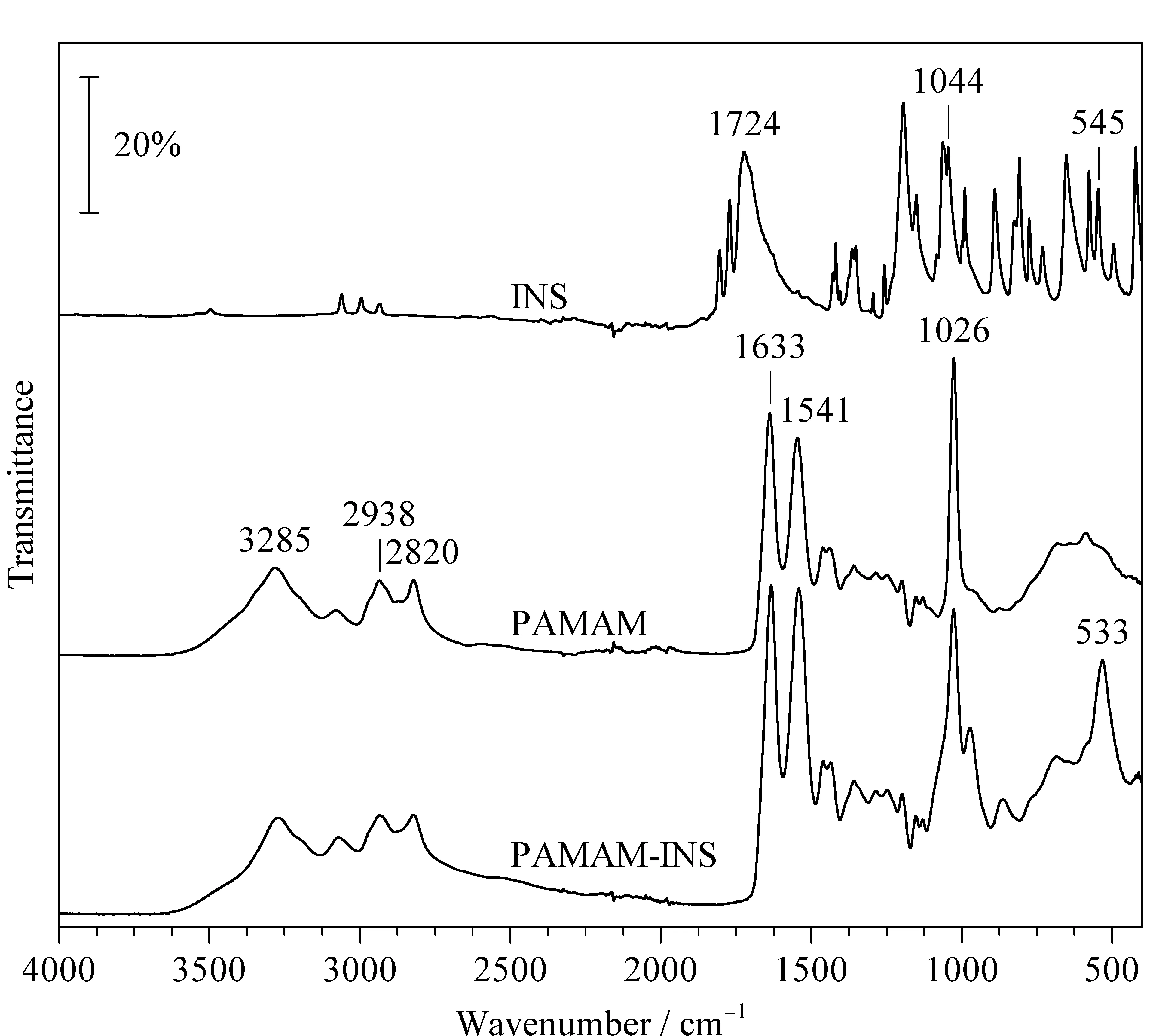
图2 INS、PAMAM及PAMAM-INS的傅里叶红外光谱图Fig.2 FT-IR spectra of INS,PAMAM,and PAMAM-INS
2.3 PAMAM-INS中碘乙酰基固载量的测定
采用茚三酮与氨基显色法测定聚合物中碘乙酰基固载前后氨基含量的差异,从而计算得到碘乙酰基的固载量,其显色原理为伯氨基与茚三酮共热生成NH3和还原性茚三酮,进一步缩合成蓝紫色的茚二酮胺。该化合物颜色的深浅与伯氨基含量成正比,可通过测定580 nm处的光吸收计算碘乙酰基固载前后聚合物中伯氨基含量的差异,通过伯氨基含量的减少计算得到碘乙酰基的固载量(在PAMAM与INS反应中,PAMAM的伯氨基物质的量减少量即为碘乙酰基的键合物质的量)。通过带入正己胺标准曲线中(其线性回归方程为y=0.344 3x-0.001 3,y为吸光度值,x为伯氨基的浓度,单位为mmol/L;相关系数R2=0.99),测得反应前后伯氨基浓度分别为0.92和0.40 mmol/L,即键合的碘乙酰基浓度为0.52 mmol/L,从而计算出碘乙酰基在PAMAM-INS中的固载量为2.20 g/g。此外,树枝状聚合物PAMAM-INS中超过一半的氨基被碘乙酰基取代,高的碘乙酰基键合量有利于提高硫巯化肽段的结合容量。
2.4 FADE策略抗干扰能力的评价
在文献[14]的基础上略加修改合成了硫巯化标准肽段LP9(序列为LEACTFRRP),将合成的硫巯化标准肽段掺到100倍质量干扰的BSA酶解产物中,对FADE策略的抗干扰能力进行考查,结果采用MALDI-TOF检测。如图3a所示,富集前由于BSA肽段的信号抑制,硫巯化标肽无法检测到。富集过程中,采用严苛的条件进行非特异吸附的清洗,并且在最后一次清洗非特异吸附过程中,检测不到任何肽段(见图3b)。
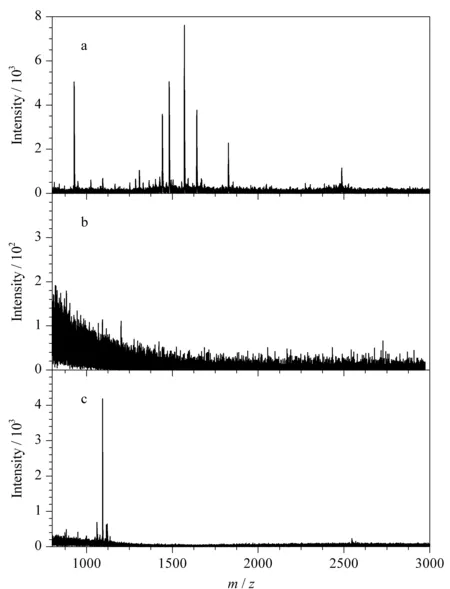
图3 硫巯化标肽和BSA酶解产物质量比为1∶100的混合溶液的MALDI-TOF质谱图Fig.3 MALDI-TOF mass spectra of persulfidatedstandard peptides and BSA digests mixtures at1∶100 (m/m) a.before enrichment;b.the last washing;c.after the enrichment by FADE strategy.
加入还原剂进行洗脱后,可以看到硫巯化标肽切除之后形成的巯基肽段,且其信号得到很大幅度的提高(见图3c)。由此说明FADE策略对硫巯化肽段有很好的富集效果,有望进一步应用到复杂样品中硫巯化肽段的富集。
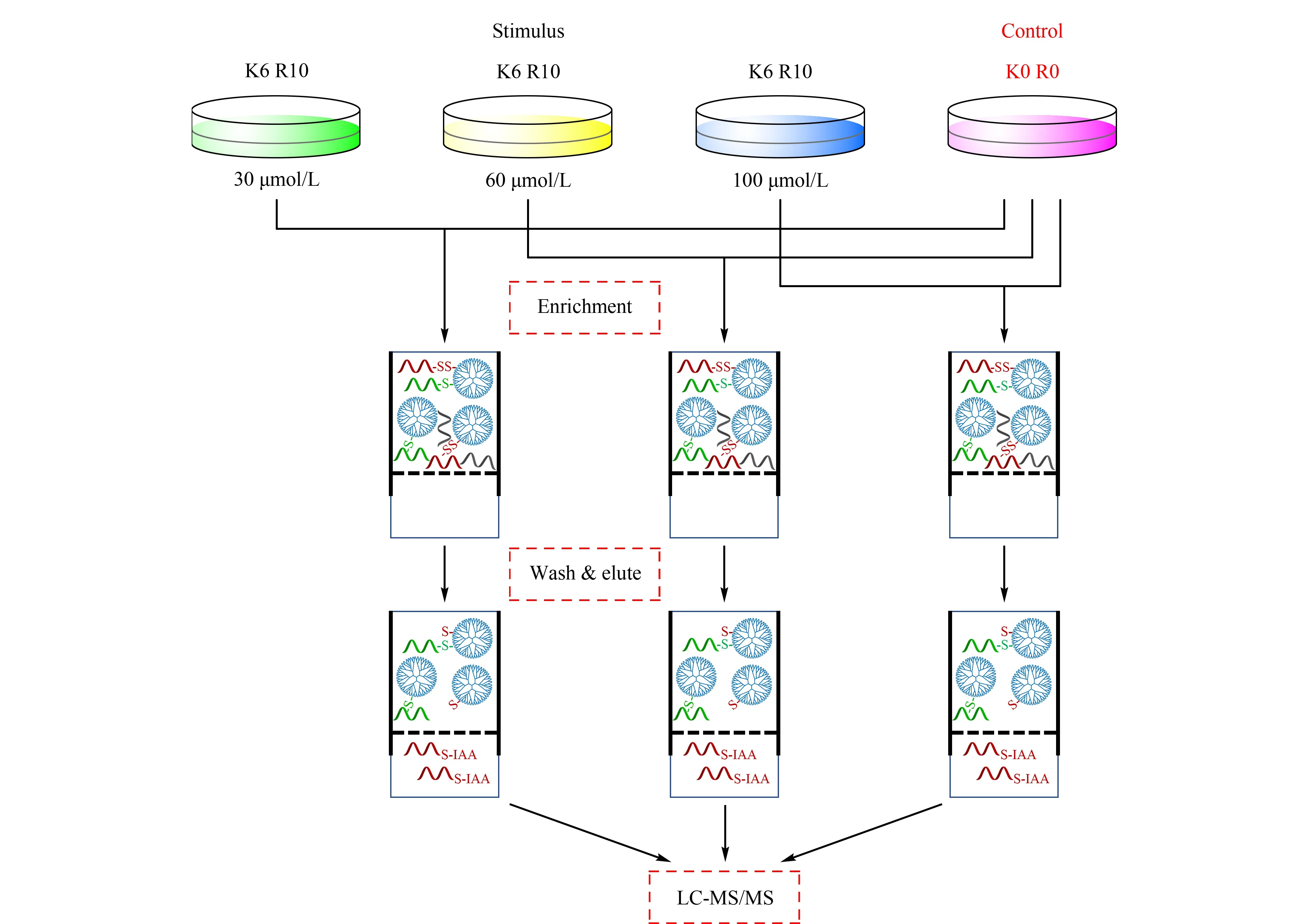
图4 eFADE策略用于SHSY5Y细胞中硫巯化肽段的富集Fig.4 Application of the eFADE(enhanced filter aided dendrimer enrichment)strategy for the enrichmentof persulfidated peptides from SHSY5Y cells K0R0 and K6R10 are referred to as light and heavy cultured cells,respectively.
2.5 eFADE策略用于实际样品中硫巯化肽段的鉴定

图5 SHSY5Y细胞中硫巯化肽段的鉴定结果Fig.5 Identification results of persulfidated peptides from SHSY5Y cells a.the number of identified thiol-containing peptides in the eluant;b.the box plot of the quantification ratios of the thiol-containing peptides in the eluant;c.the quantified thiol-containing peptides exhibiting a positive trend.The heavy to light ratio of cysteine peptides in the eluant was identified as H/L.
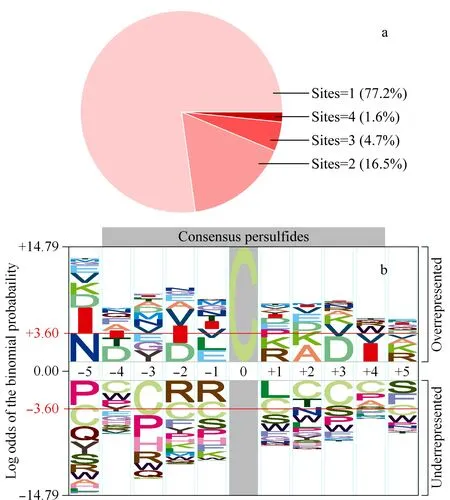
图6 (a)每个蛋白质中硫巯化位点的分布及(b)pLogo分析硫巯化位点的保守氨基酸序列Fig.6 (a)Distribution of the number of persulfidatedsites per protein,and(b)the consensus sequence motifs of persulfidated cysteines visualized by pLogo
在FADE策略中,由于洗脱时切除了硫巯化修饰位点,可能导致鉴定的假阳性,因此建立了eFADE策略。eFADE策略具体思路如图4所示,利用SILAC技术对细胞进行代谢标记,并在重标标记的细胞中加入不同浓度的NaHS(H2S供体)刺激30 min,产生的H2S能诱导细胞内硫巯化修饰水平的增加[15,16]。通过设置浓度梯度刺激细胞,预期使细胞内硫巯化修饰水平发生不同幅度的增加。在eFADE策略中洗脱得到的巯基肽段中都有一个定量比值(重标/轻标),选取3组刺激条件中共同鉴定到且定量比值随着NaHS刺激浓度增加呈上升趋势的巯基肽段作为硫巯化肽段,以此来降低鉴定的假阳性。利用eFADE策略,在30、60和100 μmol/L硫氢化钠刺激的SHSY5Y细胞中,分别鉴定到624、587和821条巯基肽段(见图5a)。该方法对硫巯化肽段的平均富集选择性为77.20%,高于qPerS-SID方法报道的富集选择性(56%)[11],说明该均相富集过程有利于提高富集选择性。如图5b所示,在鉴定到的巯基肽段中,其定量比值的中位数随NaHS浓度增加呈上升趋势,这说明随着NaHS刺激浓度的增加巯基肽段有上调趋势,暗示硫巯化修饰发生上调,与预期相符合,即采用浓度梯度的NaHS刺激细胞能使细胞内硫巯化修饰水平发生不同幅度的增加。因此,按照3组刺激条件中共同鉴定到且定量比值随着NaHS刺激浓度增加呈上升趋势的标准进行筛选,得到163条硫巯化肽段,对应127个蛋白质(见图5c)。其中,发现了一些已被验证过的硫巯化修饰蛋白质,如磷酸甘油酸脱氢酶(PHGDH)、丙酮酸激酶(PKM)、肌动蛋白(ACTB)等[3,10,11]。与文献报道[11]的结果相比,34.70%的硫巯化肽段与qPerS-SID报道的结果相同,表明两种方法具有一定的互补性。在SHSY5Y细胞中,E3泛素连接酶parkin的硫巯化修饰有助于帕金森疾病的治疗[17]。虽然在本试验中没有鉴定到硫巯化的parkin蛋白质,但鉴定到了其他与帕金森疾病相关的硫巯化蛋白质,如类泛素修饰激活酶1(UBA1)、E2泛素连接酶(UBE2R2)、增殖细胞核抗原(PCNA)等,暗示硫巯化修饰在帕金森这种神经退行性疾病中可能扮演重要角色。对鉴定到的蛋白质含有的硫巯化位点进行了统计,如图6a所示,77.20%的蛋白质只含有一个硫巯化修饰位点;超过6%的蛋白质包含3个及以上的硫巯化位点,表明这些蛋白质发生了广泛的硫巯化修饰并且对H2S比较敏感。分析硫巯化修饰位点附近的氨基酸分布情况,有助于预测潜在与硫巯化修饰类型相关的保守序列区间。采用pLogo对硫巯化修饰位点进行motif分析,如图6b所示,修饰位点附近存在较明显的带负电氨基酸(天冬氨酸,D),与文献[11]报道的结果类似,带负电的氨基酸有利于稳定硫巯化位点。
2.6 生物信息学分析
为了进一步研究硫巯化蛋白质的功能,利用在线的生物信息学工具PANTHER对硫巯化蛋白质进行了GO和通路的分析(见图7)。生物学过程的分析结果显示,硫巯化蛋白质参与了生命活动的多个过程,如核糖体蛋白复合物的自组装、蛋白复合物亚基的组织、形成翻译起始三元复合物等,还包括多个与翻译相关的过程(翻译起始、翻译终止、细胞质翻译)。分子功能的分析结果显示,硫巯化蛋白质发挥结构分子活性、翻译起始因子活性以及各种结合功能等。PANTHER通路的分析结果显示,硫巯化蛋白质参与糖酵解、亨廷顿疾病、Slit/Robo介导的轴突导向、整合素信号通路等信号通路中。其中,糖酵解和Slit/Robo介导的轴突导向通路的富集效果最明显,富集倍数分别是30.50和20.34。据文献[10]报道,硫巯化修饰可以调节糖酵解通量,引起细胞能量的重新编程和代谢,本结果也显示硫巯化修饰与糖酵解信号通路密切相关。此外,神经导向因子Slit家族是一类分泌型糖蛋白,可通过结合神经细胞膜上的Robo受体家族发挥生物学功能。Slit/Robo介导的神经轴突导向参与调控发育中的中枢神经轴突定向延伸,促进轴突生长和调控神经纤维束化、定位以及突触的形成[18,19]。由此,猜测硫巯化修饰可能在中枢神经系统扮演重要角色。
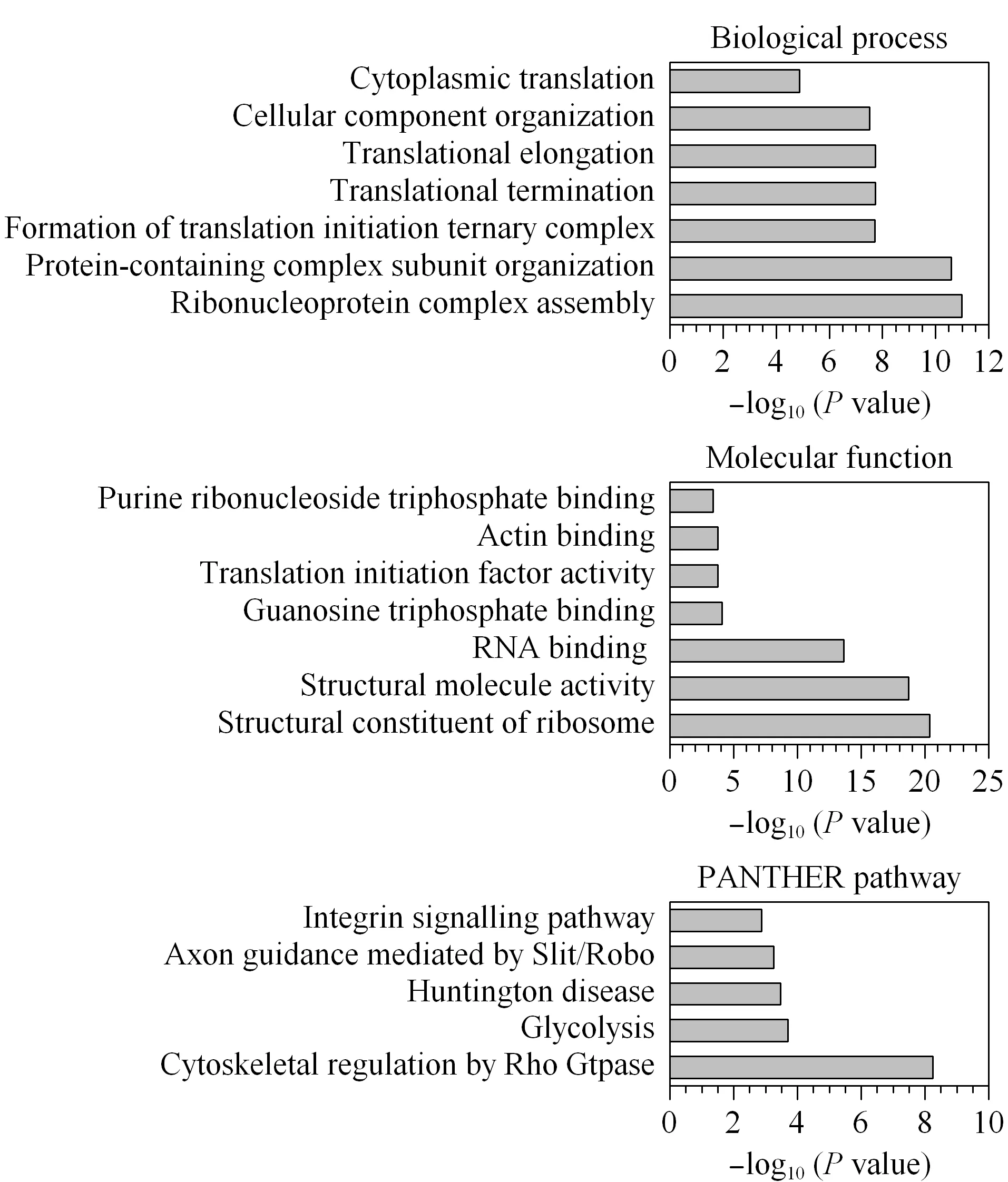
图7 使用PANTHER进行GO富集分析生物学过程、分子功能和通路分析Fig.7 GO term enrichment analysis of biologicalprocesses,molecular function,and pathway using PANTHERGTP:guanosine triphosphate.
3 结论
本文合成了PAMAM-INS用于硫巯化肽段的选择性富集,进一步结合SILAC技术与浓度梯度刺激细胞进行定量分析来降低鉴定的假阳性。与文献[10,11]报道的方法相比,该方法一步实现了硫巯化肽段的标记与富集,简化了实验流程;不借助生物素与亲和素之间的亲和富集,避免了内源性生物素化肽段造成的干扰,有效提高了富集选择性。将eFADE策略应用于SHSY5Y细胞中硫巯化肽段的富集,生物信息学的结果暗示硫巯化修饰可能在中枢神经系统中扮演重要角色。这些结果表明,本文发展的eFADE策略将为规模化分析硫巯化蛋白质组学提供重要的研究工具。

