丹参酮抗小鼠辐射损伤实验研究*
龚 睿,蔡周权,谢 晨,徐丽萍
(四川省科学城医院药剂科,四川 绵阳 621900)
目前,许多天然药物中提取的有效成分均证实其能抑制自由基的产生,增强机体的自身抗氧化能力,发挥抗辐射作用。中药丹参为唇形科丹参Salvia miltiorrhizaBge.的干燥根,主要成分为脂溶性和水溶性化学成分[1]。丹参酮是中药丹参根中的脂溶性成分,包括10多种单体,均具有邻醌或对醌结构,由于此类化合物易被还原为二酚类衍生物,后者又易被氧化为醌,在转变过程中起电子传递作用,在生物体内的代谢产物易参与机体的多种生物化学反应,从而表现出多种药理作用[2]。目前,相关研究更倾向于其抗肿瘤[3]、抗肝纤维化[4]、抗炎[5]等作用。本课题组曾在体外试验中证实丹参酮具有一定的体外抗氧化作用,本研究中拟对丹参酮体内的抗氧化作用进行探讨,为临床开发有效且毒副作用少的抗辐射药物。现报道如下。
1 材料与方法
1.1 动物、试药与仪器
动物:BALB/c小鼠30只,SPF级,雄性,年龄12~16周,体质量为(20±2)g,购自成都达硕实验动物有限公司,动物合格证编号为SCXK<川>015-030。适应性喂养7d,实验期间自由饮水、进食,实验结束后采用断颈法处死。
试药:98%丹参酮ⅡA提取物(西安开来生物工程有限公司,批号为K176845);维生素C(成都麦卡希化工有限公司,批号为2017041301,分析纯);水为蒸馏水;薇婷脱毛膏(利洁时家化<中国>有限公司);谷胱甘肽还原酶(GR)试剂盒、谷胱甘肽(GSH)试剂盒、总抗氧化能力(T-AOC)试剂盒和丙二醛(MDA)试剂盒均由南京建成生物工程研究所提供。
仪器:SH4型紫外线光疗仪(上海希格码高技术有限公司,光谱范围UVB为280~330 nm,辐射强度为13 mW/cm2);紫外线强度检测仪(世骏电子股份有限公司);毛细采血管(扬州市金环医疗器械厂);UV-6100型紫外可见分光光度计(上海元析仪器有限公司);7DZ5-WS型离心机(上海卢湘仪离心机仪器有限公司)。
1.2 方法
分组:将实验小鼠随机分为正常对照组(Ⅰ组,生理盐水)、模型对照组(Ⅱ组)、模型对照组维生素C 5 g/L(Ⅲ组),3 个剂量丹参酮组(2.5,5.0,10.0 g/L,Ⅳ ~Ⅵ组),各5只。实验期间自由进食、饮水。
小鼠模型建立:各组小鼠用脱毛剂将背部脱毛,暴露皮肤面积2 cm×3 cm。用模拟UVB光源照射,UVB辐照强度13 mW/cm2,距离小鼠约20 cm垂直高度处照射,每天照射10 min。实验期间每5 d脱毛1次。
给药方法:Ⅰ组每日给予0.5 mL生理盐水灌胃,不予照射;Ⅱ组每日上午给予0.5 mL生理盐水灌胃,下午给予紫外线照射10 min;Ⅲ组上午给予5 g/L维生素C注射液0.5 mL,下午给予紫外线照射10 min;Ⅳ组上午给予2.5 g/L丹参酮液0.5 mL,下午给予紫外线照射10 min;Ⅴ组下午给予紫外线照射10 min;Ⅵ组下午给予紫外线照射10 min。均连续给药14 d。
1.3 标本采集与指标检测
样本采集:按上述实验方法照射14 d后,取30只10 mL装有1%肝素2 mL的离心管,用毛细血管取眼眶血后装入上述离心管中,将装有血液的离心管在离心机上4 000 r/min离心10 min,取上清液,备用。
小鼠血清GR,GSH,T-AOC,MDA检测:严格按相关试剂盒(南京建成生物工程研究所)操作流程检测小鼠血清中GR活力、T-AOC能力、GSH含量及MDA含量。
1.4 统计学处理
采用SPSS13.0统计学软件分析。计量资料以表示,组间比较行t检验。P<0.05为差异有统计学意义。
2 结果
结果见表1及图1。与Ⅰ组相比,Ⅱ组血清GR活力、T-AOC能力、GSH含量均明显下降,MDA含量明显上升(P<0.05);与Ⅱ组相比,Ⅲ~Ⅵ组血清GR活力、T-AOC能力、GSH含量均明显上升,MDA含量明显下降(P<0.05);Ⅲ组与Ⅳ~Ⅵ组相比,血清GR活力、T-AOC能力、GSH含量、MDA含量差异不大。
表1 各组小鼠抗氧化物质的含量/能力比较(±s)
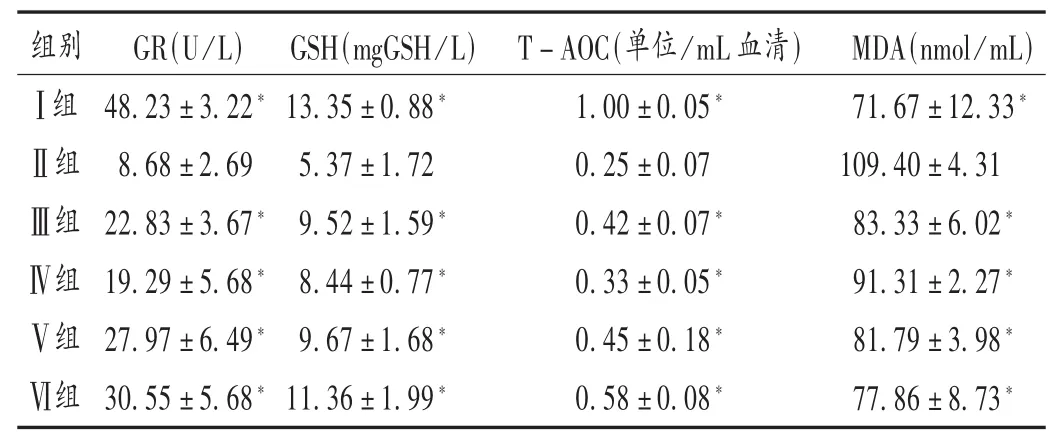
表1 各组小鼠抗氧化物质的含量/能力比较(±s)
注:与Ⅱ组比较,*P <0.05。图 1 同。
?

图1 各组小鼠各抗氧化物的含量/能力
3 讨论
紫外线被皮肤吸收后可通过多种途径诱发光化学反应及级联反应,往往产生活性氧(ROS),主要包括氧离子、过氧化物和处于激发态的氧、羟基化合物等。有些活性氧是自由基,属于体内高活性分子,包括超氧阴离子(O2·-)、羟自由基(·OH)和过氧化氢(H2O2)等[6]。UVB作为太阳光紫外线的一部分,是产生机体氧自由基的主要成分,这些氧自由基可引发不饱和脂肪酸脂质过氧化而使细胞损伤[7]。ROS生成和消除失衡对细胞生理学的某些影响被称为氧化应激[8]。生物机体在面对上述威胁时,通过提升自身的抗氧化防御体系,包括抗氧化酶系和抗氧化因子水平,对氧自由基进行清除及催化、分解有毒、有害物质,以达到防辐射的效果。这种机体防御体系的抗氧化能力的强弱与健康程度密切相关,该防御体系的抗氧化作用主要通过3条途径:清除自由基和活性氧以免引发脂质过氧化;分解过氧化物,阻断过氧化链;除去起催化作用的金属离子。氧自由基不但通过生物膜中多不饱和脂肪酸(PUFA)的过氧化引起细胞损伤,且还能通过脂质过氧化物的分解产物引起细胞损伤,其中毒性最大的就是MDA,其产生的量与氧自由基的量及脂质过氧化的程度呈正相关,故检测含量可反映氧自由基的水平及脂质过氧化的程度。GR是一种黄素酶,广泛存在于各脏器的组织细胞中,在体内可催化氧化型谷胱甘肽(GSSG),还原成还原型谷胱甘肽(GSH),后者可使含巯基(—SH)酶处于还原状态及活性状态,维持红细胞膜的完整性,防止血红蛋白氧化。GSH是由谷氨酸、甘氨酸和半胱氨酸组成的三肽,是组织中主要的非蛋白质巯基化合物,是体内的一种低分子清除剂,可清除O2-及H2O2等,GSH量的多少是衡量机体抗氧化能力大小的重要指标[9]。
有实验研究了丹参酮对不同疾病动物模型的抗氧化作用,丹参酮ⅡA衍生物对大鼠心肌缺血再灌注损伤模型中MDA含量的影响[10-11]。结果表明,丹参酮ⅡA衍生物预处理能显著减少大鼠心肌缺血再灌注损伤引起的心肌炎性浸润氧化损伤,减少MDA的活性。表明丹参酮ⅡA衍生物具有保护心肌缺血再灌注损伤的作用,其作用机制与其显著抑制炎症与氧化损伤有关。李泽等[12]研究发现,丹参酮ⅡA磺酸钠(STS)呈剂量依赖性地减轻AngⅡ诱导的心肌纤维化,提高抗氧化酶及Ⅱ相解毒酶的表达,增强抗氧化应激反应,降低心肌组织脂质过氧化水平。高文强等[13]发现,利用丹参酮Ⅰ(T- Ⅰ)预处理可降低X射线导致的膀胱上皮细胞活力下降,且可减少细胞内的活性氧水平;在体内试验中,T-Ⅰ能显著减轻早期膀胱组织损伤,降低组织内氧化应激水平。本研究结果与前期研究结果一致,在丹参酮预处理中,相对于模型对照组,丹参酮实验组小鼠血清GR活力、T-AOC能力、GSH含量明显上升,MDA含量明显下降(P<0.05),丹参酮的不同浓度组与维生素C组小鼠的血清GR活力、T-AOC能力、GSH含量、MDA含量差异不大。总之,丹参酮能清除氧自由基,减轻紫外线辐射对机体的损伤。

