慢病毒介导shRNA沉默大鼠肝BRL-3A细胞PDZK1对胆管侧膜Bsep表达的影响
杨方方,刘 萍,程 静,彭偲偲,雷 亮,吴 涛,宋红萍,
肝细胞依靠细胞膜上的药物转运体实现摄取和分泌胆汁的功能。在病理状态下,肝细胞药物转运体发生显著改变,参与诱导胆汁淤积性肝病发生[1]。胆管侧膜ABC转运体(ATP-binding cassette transporter,ABC transporter)表达异常、功能下降是胆汁淤积性肝病的重要分子基础[2]。PDZK1(NHERF3)蛋白能够调控多种药物转运体的表达和功能[3]。近年来发现,PDZK1表达抑制或者缺失,可以导致其靶蛋白(转运体)的亚细胞定位异常、表达和功能下降。该研究筛选PDZK1基因的RNA最佳干扰靶点,构建其慢病毒干扰载体LV3/PDZK1 shRNA,体外观测慢病毒介导的shRNA对BRL-3A细胞PDZK1的沉默效应及对胆管侧膜胆盐输出泵(Bsep)表达的影响。
1 材料与方法
1.1 材料BRL-3A细胞株购自ATCC;3个干扰靶点寡核苷酸序列及其对照序列的合成由武汉塞维尔生物提供;质粒抽提试剂盒购自Roche公司;限制性内切酶、DNA内切酶、DNA连接酶和Taq聚合酶购自加拿大MBI Fermentas;中量抽提试剂盒购自杭州爱思进生物技术有限公司;凝胶回收试剂盒购自北京天根生化公司;LV3 (H1/GFP&Puro)慢病毒载体购自上海吉玛公司;Lipofectamine2000购自美国Invitrogen公司;PDZK1、Bsep抗体购自英国Abcam公司;最佳干扰靶点DNA oligo使用Designer 3.0(Genepharma)软件进行设计,合成引物由苏州吉玛基因提供。
1.2 方法
1.2.1PDZK1最佳siRNA靶点的设计与筛选 分别针对3个靶点设计干扰大鼠PDZK1的siRNA序列(914、797、1 075);以5×104个细胞/孔的细胞密度接种BRL-3A细胞在6孔板中,24 h后,分别以3对siRNA转染细胞6 h后换液,48 h后采用RT-PCR和Western blot方法检测PDZK1表达,筛选出最佳的RNA干扰靶点。大鼠PDZK1引物序列 F:5′-CTACGGTTTCTATCTGAGGGCG-3′,R:5′-AGGCAG TTCTTGACTTTGGCAG-3′;Bsep引物序列F:5′-CC CTCATACGGAATCCCAAGA-3′,R:5′-GGCGATGGG CAACTGAGAT-3′;β-actin引物序列F:5′-TGCTATG TTGCCCTAGACTTCG-3′,R:5′-GTTGGCATAGAGGTC TTTACGG-3′。
1.2.2PDZK1shRNA慢病毒载体的构建与鉴定 设计并合成针对最佳siRNA的shRNA靶序列;LV3-shRNA模板中的loop结构选用了TTCAAGAGA以避免形成终止信号;正义链模板的5′端添加了GATCC,与BamH Ⅰ酶切后形成的粘端互补;反义链模板的5′端添加了AATTC,与EcoR Ⅰ酶切后形成的粘端互补。正义链:5′-GATCC-(GN18)-(TTCAAGAGA)-(N18C)-TTTTTTG-3′;反义链:3′-G(CN18)-(AAGTTCTCT)-(N18G)-AAAAAACTTAA-5′;退火,将合成的DNA片段与带有绿色荧光蛋白(GFP)的载体LV3 (H1/GFP&Puro)质粒连接,构建重组慢病毒载体LV3/PDZK1 shRNA,随即转入感受态的大肠杆菌;将转化的大肠杆菌接种到含Apm抗性LB琼脂培养基,培养16 h,挑取阳性克隆抽提质粒,进行酶切筛选,测序进一步鉴定。测序正确的菌株采用高纯度质粒中量抽提试剂盒抽提质粒。
1.2.3PDZK1 shRNA慢病毒包装及滴度测定 测序通过的质粒与pHelper 1.0载体、pHelper 2.0载体共转染进293T慢病毒包装细胞,于37 ℃、5%CO2细胞培养箱内培养48 h后收集293T细胞上清液,离心获得病毒浓缩液,分装后置-70 ℃冰箱中保存。采用倍比稀释法测定重组慢病毒滴度。取对数生长期293T细胞,以2×103个细胞/孔接种至96孔板,分8组,每组设3个复孔,每孔加入含10% FBS的DMEM培养基100 μl,置37 ℃、5%CO2孵箱下培养24 h。准备8个无菌的EP管,每管中加入90 μl的无血清培养基,取待测病毒原液10 μl加入第1个管中,混匀后,取10 μl加入第2个管中,以此操作直至最后一管。选取对应细胞孔,弃掉90 μl培养基,加入90 μl稀释好的病毒溶液,于37 ℃、5% CO2细胞培养箱培养。各组加入病毒原液相当于10、1、10-1、10-2、10-3、10-4μl;24 h后补足完全培养基至200 μl;48~72 h后,观察绿色荧光表达情况。病毒滴度为每孔GFP阳性细胞数/病毒原液量。
1.2.4BRL-3A细胞的LV3/PDZK1 shRNA重组慢病毒感染 转染前1 d,取(2~3)×105个细胞/孔的BRL-3A细胞接种在6孔板上,培养24 h后将原有培养基弃去,加入2 ml的细胞完全培养基;置于5%CO2的培养箱中,于37 ℃培养至细胞汇合达到40%~60%;细胞换液,将病毒液与终浓度5 μg/ml polybrene加入新鲜培养基中,经空病毒感染或未感染的BRL-3A细胞作为对照;8~12 h后观察细胞状态,若细胞状态无明显病变,继续培养,24 h后更换新鲜培养基。BRL-3A细胞选用MOI=20进行病毒转染,病毒用量(μl)=(细胞数×MOI值/病毒原液滴度)×103;24~48 h观察GFP的表达情况并拍照。
1.2.5LV3/PDZK1 shRNA慢病毒对BRL-3A细胞PDZK1和胆管侧膜Bsep基因表达的影响 收集经慢病毒感染48 h的BRL-3A细胞,使用TRIzol试剂提取细胞总RNA,采用RT-PCR法检测PDZK1、Bsep基因的mRNA表达水平,以空病毒感染的BRL-3A细胞的同样检测作为对照,以β-actin基因作为内参。大鼠PDZK1、Bsep特异检测引物见1.2.1。
1.2.6LV3/PDZK1 shRNA慢病毒对BRL-3A细胞PDZK1和胆管侧膜Bsep蛋白表达的影响 采用Western blot法将经慢病毒感染48 h的BRL-3A细胞总蛋白以及膜蛋白分别提取、转移至硝酸纤维膜,再浸于含PDZK1一抗(1 ∶500)与Bsep一抗(1 ∶500)的封闭液中,4 ℃过夜;加入辣根过氧化物酶标记的二抗(1 ∶3 000),室温孵育0.5 h,用TBST在室温下脱色摇床上洗3次,每次5 min;随后与混合好的ECL溶液结合1~2 min,显色拍照,以β-actin作为内参。
2 结果
2.1 PDZK1最佳siRNA靶点的筛选采用RT-PCR法和Western blot方法从3对siRNA中筛选出最佳RNA干扰序列(表1、图1),结果选定Pdzk1-rat-914对应的序列进行病毒包装。
2.2 PDZK1 shRNA慢病毒载体的构建与鉴定重组慢病毒载体LV3/PDZK1 shRNA经限制性酶切酶BamHⅠ与EcoRⅠ酶切,酶切结果表明,被EcoR Ⅰ切开的可能是阳性克隆(图2)。将阳性克隆进行测序鉴定证实,携带PDZK1 shRNA的重组慢病毒载体LV3/PDZK1 shRNA得以成功构建。

表1 siRNA序列信息

图1 BRL-3A细胞转染PDZK1 siRNA进行筛选
2.3 PDZK1 shRNA慢病毒重组体的包装及其滴度测定Lipofectamine2000基因转染试剂介导LV3/PDZK1 shRNA慢病毒质粒DNA转染293T细胞,培养72 h,荧光显微镜下观察,可见GFP强表达(图3)。以倍比稀释方法检测其病毒滴度为: 1×109TU/ml。
2.4 BRL-3A细胞的LV3/PDZK1 shRNA慢病毒感染未经LV3/PDZK1 shRNA慢病毒感染的BRL-3A细胞不表达GFP(图3C),经LV3/PDZK1 shRNA慢病毒感染的BRL-3A细胞,荧光显微镜观察可见明显GFP表达(图3D)。
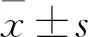
2.5 LV3/PDZK1 shRNA慢病毒对BRL-3A细胞的PDZK1、Bsep基因表达的影响提取未经感染的BRL-3A细胞(blank)、空载病毒感染48 h的BRL-3A细胞(NC)、LV3/PDZK1 shRNA慢病毒感染48 h的BRL-3A细胞(shRNA)总RNA为模板,进行RT-PCR检测,结果显示shRNA组PDZK1、Bsep基因的mRNA相对表达水平为:(0.17±0.02)、(0.43±0.07);NC组PDZK1、Bsep基因的mRNA相对表达水平为:(0.97±0.06),(0.94±0.25);与NC组比较,shRNA组PDZK1、Bsep基因的mRNA相对表达水平显著抑制(P<0.01),见图4。由此提示,重组慢病毒LV3/PDZK1 shRNA能在mRNA水平有效沉默BRL-3A细胞的PDZK1、Bsep基因的表达。
2.6 LV3/PDZK1 shRNA慢病毒对BRL-3A细胞PDZK1及Bsep蛋白表达的影响Western blot检测blank、NC、shRNA这3个组BRL-3A细胞的PDZK1及Bsep蛋白表达情况。结果显示与blank组和NC组比较,shRNA组的PDZK1和Bsep蛋白表达均显著降低(P<0.01),见图5。由此提示,在RNA水平沉默BRL-3A细胞PDZK1基因可有效抑制其PDZK1及Bsep蛋白表达。

图2 PDZK1 shRNA慢病毒载体的构建示意图

图3 LV3/PDZK1 shRNA慢病毒感染的细胞 ×100

图4 BRL-3A细胞中PDZK1及Bsep基因表达
A:PDZK1基因表达情况;B:Bsep基因表达情况,以actin为内参;与shRNA组比较:**P<0.01

图5 BRL-3A细胞中PDZK1及Bsep蛋白表达
A:PDZK1蛋白表达情况;B:Bsep蛋白表达情况;与shRNA组比较:**P<0.01
3 讨论
近年来,PDZK1对药物转运体的调控作用逐渐引起重视。PDZK1具有PDZ结构域,可以特异性识别并结合转运体C末端大约5个氨基酸长度的特定序列模块的肽类(PDZ结合域)。PDZK1大量分布在肝、肾、小肠,与多数转运体的分布一致。机体病理状态通过诱导PDZK1表达改变,继而引起某些转运体表达和功能异常。例如慢性肾病(CKD)大鼠的肾脏上皮细胞和肠道上皮细胞PDZK1表达受到显著抑制,导致转运体(Mrp4和OCTN1)定位紊乱和功能下降。因此,PDZK1已被视为转运体相关疾病的新的治疗靶点[4]。
炎症诱导肝细胞胆管侧膜ABC转运体的表达与功能改变,是造成胆汁生成和排泌受阻的直接原因[5]。α-萘异硫氰酸酯(ANIT)能够诱导肝脏炎性细胞浸润并且明显影响肝脏转运体(Bsep、NTCP),促进胆汁淤积形成[6]。内毒素诱导胆汁淤积大鼠的胆管侧膜Bsep表达下调亦与肝组织炎症程度紧密相关[7]。然而,炎症影响ABC转运体的机制尚不清楚。有报道[8]发现炎症因子能够抑制PDZK1蛋白表达。最新研究[9]显示炎症性肝损伤能够引起PDZK1、胆管侧膜Bsep和Mrp2表达均显著下调。上述研究提示炎症很可能通过PDZK1这一中介对胆管侧膜ABC转运体实现调控。
因此,运用RNA干扰技术,针对大鼠PDZK1基因序列,设计与筛选出PDZK1基因的3个干扰靶点。从3个干扰靶点中筛选到PDZK1基因的最佳干扰靶点。设计并合成针对最佳干扰靶点的shRNA靶序列,连入LV3载体,成功构建了LV3/PDZK1 shRNA慢病毒载体,实现了该慢病毒载体对大鼠BRL-3A肝细胞的有效感染。RT-PCR与Western blot检测证实,LV3/PDZK1 shRNA慢病毒载体能够介导PDZK1 shRNA有效沉默BRL-3A细胞的PDZK1表达,同时下调胆管侧膜Bsep的表达,提示PDZK1 shRNA可能通过沉默BRL-3A细胞的PDZK1,使BRL-3A细胞胆管侧膜Bsep表达减少。而PDZK1下调引起Bsep表达降低的机制可能与Bsep定位紊乱和发生降解有关。文献[10]报道,转运体(Oap1a1)需要PDZK1协同招募驱动蛋白kinesin-1,才能正确地运输至肝细胞膜;敲除PDZK1可导致Oap1a1堆积在细胞内并大量降解。另一项研究[11]发现,人肾上皮HEK293细胞的PDZK1过表达能够明显上调转运体(MRP4)表达水平,可能与PDZK1减少MRP4降解有关。综上所述,PDZK1可能扮演着一个在细胞内协助运输转运体分子至细胞顶侧膜,并且使其稳定表达的伴侣蛋白的角色。

