Caspase-1及其相关炎症因子在二乙基亚硝胺诱导大鼠肝癌形成过程中的变化及意义
杨 琪,卓少元
肝癌是目前临床常见难治的恶性肿瘤,其国内发病率与死亡率分别位居恶性肿瘤第四位和第二位[1]。肝癌发病机制非常复杂,但促进肿瘤的炎症是目前公认的肿瘤十大特征之一[2],慢性肝脏炎症在肝癌的发生发展及转移过程中具有至关重要的推动作用[3-4]。Caspase-1是第一个在哺乳动物中被发现的半胱氨酸-天冬氨酸特异性蛋白酶(cysteine containing aspartate specific protease, Caspase),其在多种炎症反应中具有核心调控作用[5]。该研究采用腹腔注射二乙基亚硝胺(diethylnitrosamine,DEN)的方式来诱导大鼠肝炎-肝硬化-肝癌模型,旨在探讨Caspase-1及其相关炎症因子白细胞介素 1β (interleukin-1β, IL-1β)、IL-18、核因子-κB (nuclear factor κB, NF-κB)在DEN诱导大鼠肝癌形成过程中的变化及意义。
1 材料与方法
1.1 实验动物雄性SD大鼠 42 只,SPF级,体质量(140±20)g,购于广西医科大学实验动物中心,生产许可证号SCXK桂2014-0002,使用许可证号SYXK桂2014-0003。
1.2 实验试剂DEN购自美国Sigma公司,货号N0756-10ML;谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(glutamic-oxalacetic transaminase, AST)测定试剂盒购自长春汇力生物技术有限公司,货号分别为C002-a、C001-a;α-L-岩藻糖苷酶(α-L-fucosidase, AFU)和γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)测定试剂盒购于南京建成生物工程研究所,货号分别为E008、C017;大鼠Caspase-1活性测定试剂盒购于北京索莱宝科技有限公司,货号BC3810;大鼠IL-1β、IL-18和NF-κB酶联免疫吸附测定试剂盒均购自武汉伊莱瑞特生物科技股份有限公司,货号分别为E-EL-R0012c、E-EL-R2426c、E-EL-R0674c。
1.3 主要仪器Chemray全自动生化分析仪购自美国Rayto公司;Epoch Biotek全波长酶标仪购自美国Biotek公司;DMI3000B研究型倒置显微镜购自德国Leica公司;ST 16R高速离心机购自美国Thermo Fisher Sorvall Scientific公司。
1.4 方法
1.4.1动物造模 实验大鼠共42只,适应性饲养1周后(温度为21~23 ℃,湿度50%),随机分为正常对照组(6只)和模型组(36只),其中模型组按照70 mg/kg体质量给予腹腔注射DEN,每周1次,连续注射10周。
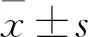
1.4.2标本采集及处理 造模第 0 周随机抽取正常组动物3只,及造模第6、13、20周最后1天随机抽取模型组动物3只,分别用3%戊巴比妥腹腔注射麻醉,腹主动脉取血,常规制备血清并分装后于-80 ℃ 保存备用。之后迅速取其完整肝脏、脾脏和胸腺组织标本,计算肝、脾和胸腺指数:脏器指数(%)=脏器湿重(g)/体质量(g)×100%。
1.4.3肝脏组织形态学观察 在各组大鼠肝脏同一部位取组织一块,4%多聚甲醛固定后,石蜡包埋,切片脱蜡,HE染色,脱水封片,光镜下观察。
1.4.4血清指标检测 采用可见分光光度法检测各组大鼠血清中ALT、AST、GGT和AFU的含量;采用ELISA法检测血清炎症因子IL-1β、IL-18和NF-κB水平。以上步骤均严格按照相关试剂盒说明书操作。
1.4.5肝脏(或肝癌)组织Caspase-1活性检测 组织加裂解液匀浆后离心取上清液,用Bradford法测定蛋白浓度,使蛋白浓度达到1~3 mg/ml。按照Caspase-1活性测定试剂盒说明书操作,于405 nm波长检测光密度(optical density,OD)值,计算Caspase-1活性,Caspase-1活性百分比=实验组OD值/对照组OD值×100%。
2 结果
2.1 一般情况比较模型组大鼠在造模前期,进食进水量和正常组相差不大,从造模第5周开始进食进水量都明显下降,精神萎靡活动量减少,且开始暴躁;第9周开始有大鼠死亡,至造模结束共有7只大鼠死亡,解剖发现腹腔积水且胃肠道透明,其余大鼠在第20周均已致癌。正常组(第0周)大鼠肝脏形态正常,颜色鲜红,质地柔软,表面光滑无任何异常,见图1A;造模第6周大鼠肝脏与第0周比较,除颜色稍深之外,无明显的异常表现,见图1B;造模第13周大鼠肝脏表面逐渐粗糙,出现数量不等、大小不一的灰白色近圆形病灶,直径大多1 mm以下,呈弥散分布,见图1C;造模20周时,大鼠肝脏表面非常粗糙,出现多个大小不一的灰白色结节,部分大鼠腹腔有黄色腹水,肝脏与周围器官黏连严重,可见出血和坏死,见图1D。在造模过程中,大鼠体质量呈逐渐上升趋势。与正常组(第0周)大鼠比较,造模第6周大鼠肝脏、脾脏和胸腺指数均下降;随着造模进程,肝脏指数和脾脏指数逐渐增加;而胸腺指数逐渐下降,与正常组比较差异有统计学意义(P<0.01),表明DEN对脏器具有一定的毒性,大鼠免疫功能被抑制。见表1。

图1 DEN诱导癌过程中大鼠肝脏形态变化

时间点体质量(g)肝脏指数脾脏指数胸腺指数第0周163±16296.69±9.2532.39±4.9120.12±10.37第6周338±27271.07±8.6417.66±2.6810.15±6.23第13周420±39388.26±12.1227.12±4.096.67±4.76第20周428±44552.65±17.41**43.53±6.613.06±2.18**
与第0周比较:**P<0.01
2.2 肝脏组织病理学比较正常组(第0周)大鼠肝细胞完整,在肝小叶中央静脉周围呈放射状排列。造模第6周大鼠肝细胞肿胀,表现为弥漫性肝细胞水肿,部分肝细胞呈嗜酸性变;肝小叶结构尚完整,小叶内可见灶性坏死伴炎性细胞浸润。造模第13周大鼠肝细胞水肿进一步加重,可见不同程度的小泡性脂肪变性;出现嗜酸性或透明细胞增生灶,可见典型假小叶形成。造模第20周大鼠肝细胞可见不同程度的脂肪变性,肝癌细胞成团块状,部分有出血和坏死,并伴有肝细胞增生灶和结节。见图2。
2.3 大鼠血清生化指标含量变化血清ALT、AST、GGT、AFU的含量均随着造模进程逐渐升高。与正常组(第0周)比较,血清ALT、AST和GGT含量在造模第13周差异有统计学意义(P<0.01),第20周表现则更加明显;血清AFU含量在造模第20周差异有统计学意义(P<0.01)。见表2。提示大鼠肝功能在造模过程中逐渐恶化。
2.4 大鼠血清IL-1β、IL-18和NF-κB含量变化血清IL-1β、IL-18和NF-κB含量均随着造模进程逐渐升高。与正常组(第 0 周)比较,造模第 6 周大鼠血清IL-1β含量升高,差异有统计学意义(P<0.05),NF-κB含量升高,但差异无统计学意义(P>0.05);造模第13周大鼠血清IL-1β、NF-κB含量明显升高(P<0.01);造模第20周鼠血清IL-1β、IL-18和NF-κB含量最高(P<0.01)。见表3。
2.5 大鼠肝脏(或肝癌)组织中Caspase-1活性变化大鼠肝脏组织中Caspase-1活性随着造模进程逐渐升高。与正常组(第0周)比较,造模第6周大鼠肝组织中Caspase-1活性升高(P<0.05),造模第13周差异有统计学意义(P<0.01),至造模第20周活性达到最高(P<0.01)。造模第 20 周时,与大鼠肝脏(含肝癌)组织比较,癌旁正常肝组织中Caspase-1活性几乎没有差别;但肝癌组织内Caspase-1活性却显著降低,甚至低于造模第6周的肝组织。见表4。

表2 造模不同时期大鼠血清生化指标含量变化
与第0周比较:*P<0.05,**P<0.01

表3 大鼠血清中IL-1β、IL-18和NF-κB含量变化
与第0周比较:*P<0.05,**P<0.01

图2 造模不同时期大鼠肝脏组织病理学比较

表4 大鼠肝脏组织中Caspase-1活性变化
与第0周比较:*P<0.05,**P<0.01
3 讨论
人类原发性肝癌的发生是一个多种诱因、多阶段的过程,要经历肝炎-肝硬化-肝癌的过程。而现代研究证实,DEN是一种具有遗传毒性的化学物质,具有肝毒性,可致基因突变、畸形,还可诱导肺、肝、血液系统多种肿瘤的形成,应用DEN制作肝癌前病变模型具有阶段性特征。汤靓[6]的研究表明DEN诱导大鼠肝癌模型有明显的三个病程:炎症期(1~8周)、硬化期(9~15周)及肝癌期(16~20周),与人类原发性肝癌的发展过程及病理形态学变化等均非常相似。通过一般观察、肝脏组织病理学比较,以及血清生化指标分析等结果,证实本实验成功复制了该肝癌模型。
本研究分别选取了第0周(正常)、第 6 周(炎症期)、第13周(硬化期)和第20周(肝癌期)进行相关炎症因子研究。结果显示,血清IL-1β、IL-18、NF-κB含量均随着造模进程逐渐升高,且在造模第20周(肝癌期)达到最高,提示这些炎症因子在DEN诱导大鼠肝癌形成过程中可能发挥着非常重要的作用,可作为反映DEN诱导肝癌发生发展过程肝细胞损伤程度的标志因子。
IL-1β和IL-18在细胞内主要由Caspase-1切割白细胞介素1β前体(precursor of interleukin-1β,pro-IL-1β)和pro-IL-18产生;当危险信号来临时,pro-Caspase-1通过核苷酸结合寡聚化结构域核苷酸结合寡聚化结构域样受体蛋白1(nucleotide binging and oligomerization domain-like receptors 1,NLRP1)、NLRP3和黑色素瘤缺乏因子等多种炎性小体感受器蛋白,及衔接分子凋亡相关斑点样蛋白ASC(apoptosis-associated speck-like protein containing a CARD)的作用被激活,成为pro-IL-1β和pro-IL-18成熟的工具酶[5]。NF-κB是炎症致癌过程中主要的调节因子,研究[7]表明NF-κB在原发性肝细胞癌组织中表达增强,且与癌组织的分化程度、有无淋巴结转移、患者甲胎蛋白水平等呈正相关。除此之外,pro-Caspase-1可以利用其半胱天冬酶募集结构域直接与受体相互作用蛋白2(receptor-interacting protein 2,RIP2)相互作用,诱导RIP2依赖的NF-κB激活;与pro-IL-1β、pro-IL-18成熟不同,NF-κB的激活不需要依赖Caspase-1酶的裂解活性[8],而且活化后的IL-1还可利用其受体IL-1R1激活NF-κB[9]。这表明IL-1β、IL-18和NF-κB均可作为Caspase-1的效应分子在炎症反应中发挥重要作用。本研究也证实大鼠肝脏组织中Caspase-1活性随着造模进程逐渐升高,其表达趋势与血清IL-1β、IL-18、NF-κB含量一致。
值得注意的是,造模第20周肝癌形成后,Caspase-1活性在大鼠肝脏(含肝癌)组织和癌旁正常肝组织中几乎没有差别,但在肝癌组织内却显著降低,甚至低于造模第 6 周的肝组织,提示造模第20周大鼠肝脏(含肝癌)组织中Caspase-1活性主要源于癌旁正常肝组织。这一结果与Wei et al[10]对临床肝炎、肝硬化、肝癌患者的研究类似:Caspase-1及其相关炎性小体组分在正常肝组织表达水平相对较低,肝损伤(如肝炎、肝硬化)时表达量明显上调;与癌旁正常肝组织相比,其在肝癌实质细胞中的表达明显下调。其原因可能在于:在肝癌发生发展过程中,一方面,以Caspase-1为核心的炎性小体在细胞内激活,通过诱导细胞死亡以消除有癌变倾向的细胞;另一方面,炎性小体效应分子IL-1β、IL-18等的裂解与释放可能在肿瘤微环境中引发炎症循环,导致无菌性炎症和癌症发生[5,11]。
刘钱[12]的研究也表明当肝脏存在炎症时,肝实质细胞内Caspase-1的表达会增强;但在相同条件下,Caspase-1在肝癌细胞内的上调水平要明显高于正常肝细胞。Caspase-1作为一种重要的炎症相关分子,可以通过多种方式参与肿瘤炎症微环境调控,其在肿瘤中的作用正如Zitvogel et al[11]所述:“在恶性肿瘤细胞与其微环境相互作用过程中,Caspase-1的激活扮演着双面角色:积极诱导肿瘤细胞程序性死亡和抗肿瘤的免疫监视,但同时也通过刺激自分泌或旁分泌,促进致癌性炎症及肿瘤的生长与转移”。

