环状RNA hsa_circ_0010985对胃癌细胞增殖与凋亡的影响
高 敏,刘文博,赵奇红,王 华,顾康生
胃癌(gastric cancer,GC)的发病率、死亡率在我国高居第二位[1]。GC患者早期缺乏特异性症状,往往明确诊断时已处于进展期,其5年生存率不足30%[2]。所以,GC的早期诊断尤为重要,目前临床常用于GC辅助诊疗的肿瘤标志物[癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原CA199(carbohydrate antigen 19-9,CA19-9)]等特异性、敏感性不强[3],因此,迫切需要寻找新的肿瘤标志物,用于GC的早期诊断及预后评估。近年来,随着对非编码RNA的研究深入,微小RNA(microRNA,miRNA)、长链非编码RNA(long noncoding RNA, lncRNA)、环状RNA(circular RNA,circRNA)在GC中的作用逐渐被揭晓[4-5]。其中,circRNA以其普遍性、稳定性、高度保守性以及组织特异性等优势[6],有望成为理想的肿瘤早期诊断的分子标志物。课题组前期通过circRNA芯片测序发现hsa_circ_0010985在GC耐药患者血浆中高表达,提示其可能参与GC的化疗耐药,而其对GC细胞的生物学功能及其临床意义尚不清楚(待发表)。该研究主要探讨hsa_circ_0010985在GC细胞和组织中的表达以及对GC细胞增殖和凋亡的影响和临床意义。
1 材料与方法
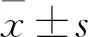
1.1 组织标本收集2017年3月~2017年7月安徽医科大学第一附属医院胃肠外科共43例GC组织标本及距肿瘤边缘>5 cm处癌旁正常组织标本,离体后立即液氮灌运输并长期保存至-196 ℃液氮中备用。
1.2 主要试剂人GC细胞系、人正常胃黏膜细胞均为安徽医科大学公共卫生学院营养与食品卫生学系实验室保存;细胞培养基RPMI-1640及胎牛血清购自美国Gibco公司;RNA提取试剂TRIzol、Lipofectamine 2000转染试剂盒购自美国Invitrogen公司;逆转录试剂盒购自大连TaKaRa公司;SYBR Green荧光定量PCR试剂盒购自北京全式金生物技术有限公司;细胞计数方法(cell counting kit-8,CCK-8)试剂盒购自合肥白鲨生物科技有限公司;AnnexinV-FITC凋亡检测试剂盒购自美国BD公司;siRNA设计与合成由上海吉玛制药技术公司完成;引物设计及合成由上海生物工程有限公司完成。
1.3 细胞培养正常胃黏膜细胞株GES-1和GC中分化细胞株SGC7901和AGS以及低分化细胞株BGC823均使用含10%胎牛血清的RPMI-1640培养液,在含5%CO2、37 ℃的培养箱中培养,每天观察细胞生长状态,常规2~3 d更换培养基,当细胞汇合度达70%~80%时进行实验。
1.4 实时荧光定量PCR(quantificational real-time polymerase chain reaction, qRT-PCR)用TRIzol提取细胞和组织中的总RNA,用逆转录试剂盒将总RNA逆转录成cDNA,然后通过SYBR Green荧光定量PCR试剂盒进行PCR扩增,GAPDH作为内参基因,引物序列为:hsa_circ_0010985 F:5′-CT GATGGGCACCTCTGTTGG-3′,R: 5′-GCTCATAGTCT GCCAATGGAAC-3′;GAPDH F:5′-AATGAAGGGGT CATTGATGG-3′,R:5′-AAGGTGAAGGTCGGAGTCA A-3′;反应条件为:95 ℃、5 s,55 ℃、30 s,72 ℃、20 s,共40个循环。
1.5 细胞转染取对数生长期的细胞,经清洗、消化、重悬后,在转染前1 d接种于6孔板内,接种密度约为60%~70%,在培养箱中培养24 h后进行转染。第2天,将10 μl siRNA溶于250 μl Opti-mem减血清培养基,轻轻混匀后,室温孵育5 min,将8 μl lipofectamine 2000TM溶于另一250 μl Opti-mem减血清培养基中,轻轻混匀后,室温孵育5 min,然后将两管溶液混合后,室温静置20 min后将其加入6孔板的相应孔中,补足培养基至2 ml,6~8 h后根据细胞状态决定是否换液。
1.6 CCK-8实验检测GC细胞增殖将实验分为阴性对照(negative control,si-NC )组、siRNA-hsa_circ_0010985-1(si-circ0010985-1)和siRNA-hsa_circ_0010985-2(si-circ0010985-2)组,将对数生长期细胞按照实验分组分别接种于96孔板,每孔约为1 000个细胞,每组设置6个复孔,24 h后进行转染,转染后0、1、2、3 d分别加入10 μl CCK8继续培养2 h后检测450 nm处各孔的吸光度(optical density,OD)值。
1.7 流式细胞仪检测GC细胞凋亡率将细胞均匀接种于6孔板,转染48 h后用不含EDTA的胰酶消化,离心后收集细胞,用预冷PBS洗涤细胞2次后,加入400 μl 1×Annexin V结合液悬浮细胞,浓度约为1×106个/ml,将其移至流式管中,加入5 μl Annexin V-FITC染色液,轻轻混匀后于4 ℃避光条件孵育15 min后,再加入10 μl PI染色液轻轻混匀后4 ℃避光条件孵育5 min,立即用流式细胞仪检测。
2 结果
2.1 hsa_circ_0010985在GC细胞及组织中的表达qRT-PCR检测结果显示,不同细胞组间hsa_circ_0010985表达水平差异有统计学意义(F=33.372,P=0.000),hsa_circ_0010985在GC细胞中显著高表达,差异有统计学意义(P<0.05)。见图1。癌旁正常组织及GC组织比较,hsa_circ_0010985在GC组织中高表达,差异有统计学意义(t=2.487,P<0.05)。见图2。

图1 hsa_circ_0010985在不同GC细胞中的表达

图2 hsa_circ_0010985在GC组织及癌旁正常组织中的表达
2.2 GC组织中hsa_circ_0010985的表达与GC患者临床病理参数的关系GC组织中hsa_circ_0010985的表达与淋巴结转移之间差异有统计学意义(P<0.05),而与患者性别、年龄、肿瘤直径、TNM分期、CEA、CA199、肿瘤位置之间差异无统计学意义(P>0.05)。见表1。
2.3 GC组织中hsa_circ_0010985的表达与GC诊断的相关性分析受试者工作特征曲线(receiver operating characteristic curve,ROC)曲线下面积(area under curve,AUC)为0.631(95%CI:0.513~0.748,P<0.05),特异度和灵敏度分别为0.814和0.419。见图3。

表1 GC组织中hsa_circ_0010985的表达与GC患者临床病理参数的关系

图3 hsa_circ_0010985 ROC曲线及AUC
2.4 siRNA转染效率的检测鉴于hsa_circ_0010985在低分化细胞株BGC-823中显著高表达,故选择该细胞株进行小干扰RNA(small interfering RNA,siRNA)转染以敲低hsa_circ_0010985表达,研究其对GC细胞增殖与凋亡的影响。siRNA转染BGC823细胞48 h后,经过qRT-PCR检测,不同组之间差异有统计学意义(F=24.627,P=0.000),其中与si-NC组比较,siRNA组可显著降低细胞内hsa_circ_0010985表达,差异有统计学意义(P<0.01)。见图4。

图4 qRT-PCR检测hsa_circ_0010985在BGC823细胞中转染后的差异表达
2.5 CCK8检测敲低hsa_circ_0010985后对GC细胞增殖的影响CCK-8实验分别检测si-NC、si-circ0010985-1和si-circ0010985-2组在不同时间点的细胞增殖情况,实验结果显示:与si-NC组比较,si-circ0010985-1和siRNA-circ0010985-2组细胞增殖能力显著降低,差异有统计学意义(P<0.05)。见图5。

图5 CCK-8检测敲低BGC823细胞中hsa_circ_0010985的表达后对GC细胞增殖的影响
2.6 流式细胞仪检测敲低hsa_circ_0010985对GC细胞凋亡的影响流式细胞仪分别检测si-NC、si-circ0010985-1和si-circ0010985-2组的细胞凋亡情况。结果显示,不同组之间差异有统计学意义(F=13.594,P=0.006),与si-NC组比较,si-circ0010985-1和si-circ0010985-2组的细胞凋亡率明显增高,差异有统计学意义(P<0.01)。见图6。

图6 流式细胞仪检测敲低hsa_circ_0010985表达后对GC细胞凋亡的影响
3 讨论
近年来,circRNA不断地受到科学界的关注,因而越来越多的circRNA被发现,其生物学功能也被逐渐认识[7-8]。circRNA是前体RNA(pre-mRNA)在形成mRNA过程中,通过反向剪接,并以共价键首尾连接形成,由于其特殊的闭合环状结构,使得其不易被核酸外切酶降解,因而相较于miRNA和lncRNA更加稳定,说明其有望成为疾病诊断及预后的生物标志物[9]。通常,circRNA在机体内的表达水平较低,但是随着研究的不断地深入,发现circRNA可以在特定的细胞或组织中异常表达,可以与miRNA结合影响转录后调节,或是调节转录,影响剪切等[10]。在肿瘤领域中,对于circRNA的研究主要集中在肿瘤诊断与预后评估,以及其与miRNA结合发挥分子海绵的作用机制等方面。Zhang et al[11]研究发现circRNA La相关蛋白4 (circular RNA La-associated protein 4, circLARP4)在GC组织中表达下调,并且通过海绵miR-424和上调大肿瘤抑制激酶1抑制GC细胞增殖和侵袭,表明circLARP4可能作为肿瘤抑制因子抑制肿瘤发生发展。此外,Chen et al[12]研究表明hsa_circ_0000190在GC组织和血浆中下调,其表达水平与肿瘤大小、淋巴转移、远处转移、TNM分期以及CA199水平显著相关,并通过ROC曲线分析表明hsa_circ_0000190可能是一种用于GC诊断的新型非侵入性生物标志物。亦有研究[13]报道,与正常组织及细胞相比,circ-0067934在肝癌组织和细胞系中高表达,敲低circ-0067934显著抑制肝癌细胞的增殖、迁移和侵袭,并诱导其凋亡;在机制研究方面,发现circ-0067934通过调节miR-1324/卷曲蛋白-5(frizzled-5, FZD5)基因激活细胞外因子/b-连环蛋白(b-catenin)通路,从而促进肝癌的发生发展,所以circ-0067934/miR-1324/FZD5/b-catenin信号轴有希望成为肝癌的治疗干预靶点。由此可见,circRNA在恶性肿瘤中异常表达,参与肿瘤细胞的增殖与凋亡等生物学过程,并与肿瘤的发生发展、预后以及疾病诊断密切相关。目前为止,本课题所研究的hsa_circ_0010985的生物学功能及临床意义在国内外报导尚未被研究阐明,因而具有极大的探索意义。
hsa_circ_0010985是mRNA前体在形成SH3结构域结合富含谷氨酸蛋白基因的剪接过程中,由1号染色体的3号外显子通过反向剪接形成的长度为465个核苷酸的环状RNA分子。在本课题中,前期通过circRNA芯片发现其在GC化疗耐药患者血浆中高表达,可能参与其GC耐药的发生发展,但是是否参与GC的发生发展以及是否具有临床意义尚不清楚。本研究通过qRT-PCR检测了1株胃黏膜正常细胞和3株GC细胞,以及43例GC患者的癌组织及癌旁正常组织中has_circ_0010985的相对表达水平,表明has_circ_0010985在GC细胞和组织中均高表达,通过进一步分析显示hsa_circ_0010985与淋巴结转移具有一定的相关性,而与患者的性别、年龄、肿瘤直径、TNM分期、CEA、CA199、肿瘤位置之间无相关性。接下来,通过siRNA干扰hsa_circ_0010985在GC细胞中的表达后通过CCK8及流式细胞仪分析其生物学功能,结果表明下调hsa_circ_0010985的表达可抑制GC细胞的增殖并诱导其凋亡。
总之,实验结果表明hsa_circ_0010985可能充当促癌基因发挥作用,并且具有一定的临床意义,将来有望成为GC诊断的分子标志物。但是,hsa_circ_0010985究竟通过何种机制与途径发挥促癌作用,还有待进一步研究及阐明其作用机制。

