miR-101和RanBP9在隐睾睾丸组织中的表达及其意义
程 鹏,黄振宇,窦贤明,毛 军,徐雨辰,张贤生
隐睾是指在生长发育过程中,一侧或者双侧睾丸未能下降到阴囊内,又称为睾丸下降不全,是男性生殖系统中一种常见的先天性疾病。隐睾症在足月新生儿中的发病率约为2%~4%,但在早产儿中可达到30%;但是,大约有80%的隐睾患儿在出生后的第一年内睾丸会下降到阴囊内,从而使得隐睾症的发病率约为1%[1]。隐睾可以破坏正常的精子发生,导致男性不育,是成年男性非梗阻性无精症的一种常见病因,但是其发病机制尚不明确。
近年来,越来越多的文献报道microRNAs(miRNAs)参与精子发生。miR-101是一种脊椎动物中进化上保守的miRNA,已被鉴定为前列腺癌中的肿瘤抑制因子[2]。RanBP9是一种脚手架蛋白,研究[3-4]显示RanBP9敲除的小鼠精子发生过程严重受损。前期研究[5]表明miR-101在小鼠海马神经元中靶向结合RanBP9并调控其表达,但是miR-101和RanBP9在隐睾中的作用尚未见报道。该研究通过构建隐睾小鼠模型,研究miR-101和RanBP9在隐睾中的表达变化情况及其作用机制。
1 材料与方法
1.1 实验动物、细胞及主要试剂ICR雄性小鼠购自安徽医科大学实验动物中心,SPF级,6周龄,共60只。饲养于室温24 ℃、湿度50%、通风良好环境中。小鼠精母细胞系GC-2细胞由中国科学技术大学生命科学院馈赠;该实验所用的小鼠miR-101模拟物(miR-101 mimic)、miR-101抑制剂(miR-101 inhibitor)及对照组购自广州锐博生物科技有限公司;兔抗RanBP9抗体、山羊抗兔GAPDH抗体购自abcam公司;蛋白定量试剂盒购自上海碧云天生物技术有限公司;免疫荧光二抗:山羊抗兔荧光二抗抗体购自武汉伊莱瑞特生物科技股份有限公司;4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1小鼠隐睾造模 将60只ICR小鼠随机分为单侧隐睾组和假手术组,每组各30只。30只隐睾组小鼠麻醉后,将左侧睾丸牵拉至腹腔内,切断引带,缝合脂肪垫于腹膜上,造左侧隐睾组(Cry组);右侧睾丸仍位于阴囊内,作为自身对照组(SC组)。另外30只假手术组小鼠麻醉后做相同腹侧切口,牵拉左侧睾丸,但睾丸仍处于阴囊内,左侧睾丸作为对照组(Con组)。分别于术后3、7、14、21、28 d行颈椎离断处死。
1.2.2细胞培养与转染 GC-2细胞用含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基在37 ℃、5% CO2饱和湿度的培养箱中培养;当细胞长满时,用胰酶消化,将细胞接种于6孔板中培养24 h,进行RNA转染实验,具体操作步骤严格按照Lipofectamine 2000转染说明书进行。转染48 h后收集miR-101 mimic组(记为miR-101)、miR-101 inhibitor组(记为ImiR-101)及其各自对照组(NC:miR-101 mimic组的对照组;INC:miR-101 inhibitor组的对照组)细胞提取RNA,进行荧光定量PCR检测miR-101的表达量;收集各组细胞提取蛋白后进行Western blot实验,检测RanBP9的表达量。
1.2.3Western blot实验 将各时间段收集的小鼠睾丸组织和转染后的细胞用RIPA裂解液处理30 min,之后4 ℃、12 000 r/min离心10 min,收集上清液,BCA法进行蛋白定量,10% SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白分离后,转移到PVDF膜,室温下5%脱脂牛奶封闭2 h,TBST洗膜3次,每次10 min,加抗RanBP9抗体(1 ∶1 000),抗GAPDH抗体(1 ∶2 000),4 ℃孵育过夜。TBST洗膜3次,每次10 min,加二抗(1 ∶5 000),室温孵育1 h,TBST洗膜3次,每次10 min,加ECL显影液显影。
1.2.4荧光定量PCR实验 收集转染后的细胞和各时间段的小鼠睾丸组织,按TRIzol试剂说明书提取各组总RNA,逆转录成cDNA,再进行荧光定量PCR检测。引物序列如下:miR-101 F:5′-CACGCATACAGTACTGTG-3′,R:5′-CCAGTGCAGGGTCCGAGGTA-3′;RanBP9 F: 5′-AATGTGGCAAGAACACAGCA-3′,R:5′-TGGGTCAAGCTGATTTCCAA-3′;18S RNA F:5′-CGCTACTACCGATTGGATGG-3′,R: 5′-AGTTCGACCGTCTTCTCAGC-3′。以18S mRNA表达水平作为内参,采用2-ΔΔCt比较分析各组间miR-101和RanBP9的表达差异。
1.2.5HE染色 睾丸组织经过10%福尔马林固定24 h后,经梯度酒精脱水和二甲苯透明后制作蜡块。4 μm连续切片,切片经二甲苯、酒精脱蜡水化,苏木精染色,流水冲洗,盐酸酒精分化,流水冲洗,氨水返蓝,流水冲洗。切片放入伊红染液中染色。脱水封片,置于显微镜下观察。
1.2.6免疫荧光染色 4 μm的石蜡切片,60 ℃烘片2 h,经二甲苯、酒精脱蜡水化;切片置于柠檬酸盐缓冲液(pH 6.0)中抗原修复,微波炉加热20 min,自然冷却到室温;PBS洗3次,每次5 min;5%BSA封闭30 min;加一抗(1 ∶100)4 ℃过夜;复温30 min后PBS洗3次,每次5 min;加相应二抗(1 ∶100)室温孵育1 h(避光);PBS洗3次,每次5 min;DAPI避光孵育5~10 min,PBS洗3次,每次1 min;封片,置于荧光显微镜下观察并拍照。
2 结果
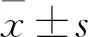
2.1 小鼠睾丸形态学变化术后3、7、14、21、28 d小鼠体质量的改变无统计学意义,表明手术对小鼠的生长无明显影响(表1)。术后3 d Cry组小鼠睾丸较SC组和Con组睾丸稍增大,可能是因为术后水肿。在术后14 d时Cry组睾丸体积明显减小(图1A)。通过对小鼠睾丸体质量比(睾丸重量/体质量×100%)进行分析,如图1B显示,在术后第7天,Cry组较SC组和Con组明显减小,差异有统计学意义(F=8.764,P<0.01)。通过对睾丸组织进行HE染色,术后3 d Cry组与SC组及Con组进行比较后发现睾丸形态结构基本正常,生精细胞数目及形态无明显改变,术后7 d开始Cry组睾丸组织生精细胞数目开始减少,同时睾丸结构也出现了损坏,至术后28 d时睾丸结构完全破坏,显微镜下睾丸组织出现空泡,各级生精细胞缺失且不易辨认,无法形成完整的精子细胞;相反,SC组和Con组睾丸组织可见各级生精细胞,睾丸组织形态完好(图1C)。

表1 各个时间段Cry组和Con组小鼠体质量比较
2.2 miR-101影响RanBP9在睾丸中的表达向GC-2细胞转染miR-101 mimic和inhibitor 48 h后,qRT-PCR结果显示miR-101表达量在mimic组显著增加,而在miR-101 inhibitor组表达量显著较少, 差异有统计学意义(P<0.05),见图2A、2B。通过Western blot实验检测RanBP9的表达量,结果显示转染miR-101 mimic后RanBP9的表达是减少的,相反,转染miR-101 inhibitor后RanBP9的表达是增加的(图2C、2D)。以上结果表明在生精细胞系中miR-101可以下调RanBP9的表达。
2.3 miR-101和RanBP9在隐睾中的表达情况qRT-PCR结果显示与SC组和Con组相比,隐睾组中miR-101的表达量在术后7 d开始升高,而RanBP9的表达量在术后14 d出现明显下降,差异有统计学意义(P<0.05),见图3A、B。隐睾组睾丸中miR-101表达量随着隐睾手术后时间的推移发生改变,从第3天起开始增加,在第14天时表达量最高,在第21天和第28天时稍有所下降,差异有统计学意义(P<0.05)。而RanBP9的表达量在术后第7天出现减少(P<0.05),之后RanBP9的表达量随着时间的增加而持续下降,差异有统计学意义(P<0.05),见图4A、B。Western blot和免疫荧光实验结果表明:Cry组RanBP9的表达量随着手术时间的延长逐渐降低,至第14天后几乎无RanBP9的表达,在SC组和Con组中RanBP9的表达量丰富且无明显改变,见图4C、D。
3 讨论
目前全世界范围内大约有15%的育龄夫妇不能生育,其中男性因素占50%[6]。隐睾作为一种常见的男性生殖系统先天性疾病,可导致精子发生障碍,进而影响男性生育能力。近些年来,越来越多的研究[7]表明miRNAs参与精子发生的过程。Duan et al[1]研究表明miR-210通过靶向结合NR1D2调控精子发生,且证实了miR-210与隐睾的关系,其可作为一种生物学标志物,可用于对隐睾的预测作用。Huang et al[8]的研究表明miR-34c通过靶向结合Nanos2调控精子发生,且miR-34c/Nanos2的异常表达破坏了SSCs自我更新和分化之间的平衡,最终破坏了隐睾睾丸的精子发生。目前关于miRNAs在隐睾中的研究较少。

图1 隐睾小鼠术后睾丸形态学分析
A:术后不同天数睾丸肉眼观大体改变;B:术后不同时间段睾丸体质量比;C:术后不同时间段睾丸HE染色 Bar:100 μm;与SC组比较:**P<0.01,***P<0.001;与Con组比较:##P<0.01,###P<0.001

图2 miR-101转染后RanBP9的表达量变化
A:转染miR-101mimic后miR-101的表达量;B:转染miR-101 inhibitor后miR-101的表达量;C:转染miR-101 mimic后RanBP9的表达情况;D:转染miR-101 inhibitor后RanBP9的表达情况;与NC组比较:***P<0.001;与INC组比较:###P<0.001

图3 miR-101和RanBP9在隐睾组、SC组和Con组中的表达情况
A:miR-101在各组睾丸中的表达情况;B:RanBP9在各组睾丸中的表达情况;与SC组比较:*P<0.05,**P<0.01;与Con组比较:#P<0.05,##P<0.01
miRNAs是一类小的非编码RNA分子(通常长度为19~23个核苷酸),通过靶向mRNA的3'非翻译区(3'-UTR)调控转录和翻译效率。研究[9-11]表明,miRNA参与许多生物过程,包括细胞增殖、细胞凋亡和精子发生。miR-101作为一种脊椎动物进化上保守的miRNA,在别的系统中的作用已有很多报道,其表达水平与某些肿瘤的恶性程度、细胞增殖的抑制、集落形成和淋巴结转移有关[12]。但miRNA在男性生殖系统中的作用尚不是十分清楚。本实验通过构建小鼠隐睾模型,通过qRT-PCR检测发现,相较于SC组、Con组、Cry组中miR-101的表达量是升高的,且miR-101随着时间推移而逐渐增加,这表明miR-101的表达与隐睾是有相关性的。
RanBP9是一种普遍表达的脚手架蛋白,主要分布于细胞核和细胞质,其可与多种蛋白发生相互作用而在多种生物过程中起重要作用,如细胞黏附、细胞增殖、细胞凋亡、迁移和信号转导等[13]。在生殖细胞中,RanBP9通过与DDX4、种系特异性RNA解旋酶和GASZ(在精母细胞中广泛表达的生殖细胞蛋白)相互作用而发挥细胞功能,并且对于转座子抑制是必不可少的[14-15]。研究[3-4]表明RanBP9在精子发生中发挥重要作用,敲除了RanBP9的小鼠出现了严重的生精障碍。但RanBP9与隐睾的关系目前尚未见报道。本研究中,通过qRT-PCR、Western blot和免疫荧光实验证实RanBP9在隐睾中表达量是下降的,其减少可能是隐睾小鼠精子发生障碍的原因之一。

图4 miR-101和RanBP9在隐睾不同时间段表达情况
A:术后不同时间miR-101的表达情况;B:术后不同时间RanBP9的表达情况;C:术后不同时间RanBP9蛋白的表达情况;D:术后不同时间免疫荧光染色检测RanBP9表达情况 Bar=40 μm;与术后3 d比较:*P<0.05,**P<0.01,***P<0.001
尽管有研究[5]表明在海马组织中miR-101可以靶向结合RanBP9并调控其表达,但在生殖系统中,特别是男性睾丸中这种调控关系是否存在尚不能确定,因此进行了小鼠精母细胞系(GC-2)细胞转染实验,相较于对照组,转染miR-101 mimic后GC-2细胞中RanBP9表达量是下降的;相反,转染miR-101 inhibitor后GC-2细胞中RanBP9的表达量是增加的。结果证实了miR-101和RanBP9在睾丸中也具有调控关系。在隐睾组织进行qRT-PCR分析显示,隐睾中miR-101表达量是增加的,而RanBP9的表达量是减少的,且它们的增加和减少的发生是同步的。这表明在体内miR-101和RanBP9的调控关系也是存在的。
综上所述,该研究通过外科手术构建小鼠隐睾模型及一系列相关实验证实了miR-101在体内体外都参与调控RanBP9的表达,并首次证实了miR-101与隐睾症的关系。但是该研究仍尚浅,miR-101和RanBP9在隐睾所致精子发生障碍中的具体机制目前仍不明确。及早的诊断与治疗对于隐睾患者来说是非常重要的。该研究表明miR-101通过调控RanBP9的表达在隐睾所致男性不育中发挥着重要的作用,miR-101可以作为隐睾症的一种生物学标志物。

