CD8+CD28-调节性T细胞及血小板特异性自身抗体在免疫性血小板减少症中的表达
张小侠,张美玲,杨明珍
免疫性血小板减少症(immune thrombocytopenia,ITP) 是以血小板(platelet, PLT)减少、巨核细胞增加且成熟障碍、皮肤黏膜出血为特征的自身免疫性疾病[1-2]。既往研究[3]表明ITP主要发病机制是PLT特异性自身抗体介导的PLT破坏,常见类型是抗血小板膜糖蛋白(glycoprotein,GP)IIb/IIIa和抗GPIb抗体。深入研究[4-5]发现调节性T细胞(regulatory T cell, Treg)及其相关细胞因子表达异常也参与ITP发病机制。研究[6]表明清除小鼠体内CD8+CD28-Treg会加剧PLT降低,输注富含CD8+CD28-Treg的CD8+T细胞可升高PLT,延缓小鼠ITP疾病进展。但人ITP中CD8+CD28-Treg的表达变化和作用机制尚不清楚。激素是ITP治疗一线用药,效果显著,但副作用大且部分患者无效。重组人血小板生成素(recombinant human thrombopoietin, rhTPO)为ITP治疗的二线用药,疗效已有研究[7]证实,但停药后,PLT易回落,不能维持疗效。该实验检测患者治疗前后CD8+CD28-Treg及细胞因子的表达,分析CD8+CD28-Treg及细胞因子在ITP发病及临床治疗中的意义,检测治疗前PLT自身抗体的表达,分析抗体种类与临床用药疗效的关系。
1 材料与方法
1.1 病例资料选取2017年2月~2018年11月安徽医科大学第一附属医院门诊和住院治疗的初诊ITP患者73例。其中男27例,女46例,年龄16~82岁,中位年龄47岁,超过40岁者25例,PLT计数≤10×109/L者41例,均符合ITP诊断标准。患者临床资料见表1。正常对照组30例,均为同时期健康体检者,男12例,女18例,年龄22~68岁,中位年龄38岁。
1.2 疗效判定标准参考文献[8]:① 完全反应:治疗后PLT≥100×109/L,无出血症状。② 有效:治疗后 PLT>30×109/L,比基础PLT计数增加至少2倍、无出血症状。③ 无效:治疗后PLT≤30×109/L,PLT计数增加不到基础值的2倍或有出血症状。

表1 ITP患者临床资料[n(%)]
1.3 主要试剂与器材别藻蓝蛋白抗体(APC)标记的小鼠抗人CD28单克隆抗体(mAb) 、异硫氰酸荧光素(FITC)标记的小鼠抗人CD8 mAb、藻红蛋白-德州红-X(ECD)标记的小鼠抗人CD3 mAb、溶血剂、破膜剂、流式细胞仪均购自美国BD公司。Coul-terlh750型血细胞自动计数仪购自美国Beckman公司。转化生长因子(transforming growth factor, TGF)-β1、白介素(interleukin, IL)-10和干扰素(interferon, IFN)-γ ELISA试剂盒购于武汉ABclonal公司。ITP抗血小板抗体检测试剂盒购自常州福隆生物有限公司。
1.4 主要实验方法
1.4.1CD8+CD28-Treg检测 采集ITP患者治疗前、治疗后及健康对照者外周肝素抗凝血6 ml。2 ml 2 500 r/min离心10 min,收集无溶血血清标本,-80 ℃冰箱冻存,用于细胞因子检测。50 μl抗凝血中加入抗人CD3-ECD、CD8-FITC、CD28-APC单克隆抗体各5 μl,避光孵育15 min,再加入红细胞裂解液500 μl,振荡后混匀,避光孵育10 min。1 500 r/min离心5 min,弃上清液,加入1 ml PBS后以1 500 r/min离心5 min,弃上清液,用800 μl PBS重悬浮后上流式细胞仪检测。
1.4.2血小板特异性自身抗体检测及血小板制备 采集标本1 400 r/min离心5 min,分离富血小板血浆(platelet rich plasma, PRP),取PRP,再5 400 r/min离心2 min,弃上清液,下层沉淀为PLT,PLT用800 μl血小板洗涤液洗涤3次,-20 ℃保存(时间:2周);向PLT中加入110 μl裂解液震荡混匀后室温摇床裂解30 min,5 400 r/min离心20 min;取上清液100 μl到另一EP管,加入已经包被5种不同单抗的微球混合液50 μl,震荡混匀,室温避光孵育1 h;加入600 μl微球洗涤液,3 800 r/min离心20 min,轻轻吸取上清液,底部约留100 μl残留液;再加入FITC标记的羊抗人IgG多克隆抗体10 μl,震荡混匀。室温避光孵育30 min;加入600 μl微球洗涤液,3 800 r/min离心20 min,轻轻吸取上清液,底部约留100 μl残留液,加入500 μl微球洗涤液,上机检测;在使用前,按照本实验方法用3份正常人PLT作为阴性对照实验,以确定本实验室的临界值。
1.4.3检测细胞因子TGF-β1、IFN-γ和IL-10含量 采用ELISA法检测,按有关试剂盒说明书进行操作。
1.4.4治疗方法 激素组患者应用糖皮质激素治疗,给予地塞米松40 mg/d,连用4 d,或甲泼尼龙1~2 mg/(kg·d),至PLT达到(80~100)×109/L后改为泼尼松1 mg/(kg·d)口服。rhTPO组患者皮下注射rhTPO注射液,剂量300 U/(kg·d),疗程14 d。若未达14 d,当PLT≥100×109/L,停止给药。
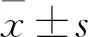
2 结果
2.1 对照组及ITP患者治疗前后CD8+CD28-Treg及细胞因子的表达结果
2.1.1对照组与患者治疗前CD8+CD28-Treg及细胞因子的表达结果比较 ITP患者治疗前CD8+CD28-Treg低于正常对照组,细胞因子IL-10、TGF-β1的表达低于正常对照组,IFN-γ的表达高于正常对照组,两组比较差异有统计学意义(P<0.05),见表2。

表2 对照组及ITP患者治疗前CD8+CD28- Treg及细胞因子的表达
与对照组比较:*P<0.05
2.1.2有效组治疗前后CD8+CD28-Treg及细胞因子的表达结果比较 激素及rhTPO治疗后CD8+CD28-Treg的表达均较治疗前上升,细胞因子IL-10、TGF-β1的表达均较治疗前增加,IFN-γ的表达均较治疗前下降,治疗前和治疗后比较差异均有统计学意义(P<0.05),见表3。CD8+CD28-Treg的流式表达图例见图1。
2.1.3无效组治疗前后CD8+CD28-Treg及细胞因子的表达结果比较 激素及rhTPO治疗后CD8+CD28-Treg、IFN-γ、IL-10、TGF-β1的表达和治疗前相比均未出现明显变化,治疗前和治疗后比较差异均无统计学意义(P>0.05)。见表4。
2.2 ITP患者治疗前CD8+CD28-Treg的表达对疗效预测的意义根据有效组和无效组患者治疗前所测CD8+CD28-Treg的值,绘制ROC曲线,分析CD8+CD28-Treg对临床用药疗效的预测作用。激素组治疗前CD8+CD28-Treg的临界值为14.35,曲线下面积(area under curve, AUC)为0.74(P<0.05),95%CI:0.575~0.904。此时预测激素疗效的敏感性和特异性为66.7%和73.3%,27例治疗有效者中,CD8+CD28-Treg小于14.35的有18例(66.7%),15例无效者中大于14.35的有11例(73.3%),见图2。rhTPO组治疗前CD8+CD28-Treg的临界值为15.45,AUC为0.75(P<0.05), 95%CI:0.560~-0.940。此时预测rhTPO疗效的敏感性和特异性为63.6%和88.9%。22例治疗有效者中,CD8+CD28-Treg大于15.45的有14例(63.6%),9例治疗无效者中小于15.45的有8例(88.9%),见图3。上述结果提示CD8+CD28-Treg有可能作为患者疗效预测的指标之一。
2.3 血小板特异性抗体的表达结果激素组抗GPⅡb/Ⅲa抗体阳性患者17例,有效10例,无效7例。GPⅡb/Ⅲa抗体阴性患者25例,有效17例,无效8例。两组比较差异无统计学意义( χ2=0.371,P>0.05)。抗GPIb抗体阳性患者18例,有效8例,无效10例,抗GPIb抗体阴性患者24例,有效19例,无效5例,差异有统计学意义 (χ2=5.401,P<0.05)。 rhTPO组抗GPⅡb/Ⅲa抗体阳性患者11例,有效7例,无效4例,抗GPⅡb/Ⅲa抗体阴性患者20例,有效15例,无效5例,两组比较差异无统计学意义(P>0.05)。抗GPIb抗体阳性患者13例,有效7例,无效6例,抗GPIb抗体阴性患者18例,有效15例,无效3例,差异无统计学意义(P>0.05)。见表5、6和图4。

表3 激素及rhTPO有效组治疗前后CD8+CD28- Treg及细胞因子的表达
与激素治疗前比较:*P<0.05;与rhTPO治疗前比较:#P<0.05

图1 CD8+CD28-Treg流式细胞表达图

组别nCD8+CD28- Treg(%)TGF-β1(pg/ml)IL-10(pg/ml)IFN-γ(pg/ml)激素组治疗前1516.62±4.041 004.88±201.9514.04±2.2397.07±15.68激素组治疗后1516.78±4.911 103.98±276.7713.03±2.0190.11 ±16.72rhTPO组治疗前913.20±3.411 015.95±252.8511.93±2.5995.26±14.27rhTPO组治疗后917.37±4.621 113.49±161.2313.64±2.5792.59±15.27

图2 激素组治疗前CD8+CD28- Treg的变化在ROC曲线中的表现

表5 激素组血小板特异性抗体表达类型和疗效的关系(n)
与B组比较:*P<0.05

图3 rhTPO组治疗前CD8+CD28- Treg的变化在ROC曲线中的表现

表6 rhTPO组血小板特异性抗体表达类型和疗效的关系(n)
3 讨论
ITP是出血性疾病中最为常见的一种,约占出血性疾病的30%。ITP发病机制文献报道众多,涉及多个方面,其可能与多种病理因素引起的体液免疫和细胞免疫异常有关。课题组前期研究[9]表明ITP患者外周血中存在CD8+T细胞亚群及树突状细胞亚群的改变。且在部分糖皮质激素无效的患者中比例较对照组下降,提示CD8+T细胞中除具有免疫杀伤作用外,应还具有类似Treg的功能,CD8+CD28-Treg是CD8+T细胞的重要组成部分,通过细胞检测发现CD8+CD28-Treg的受体多样性降低,端粒变短,抗原诱导增殖的能力减弱,分化能力降低,细胞毒性减弱或消失[10]。目前认为CD8+CD28-Treg主要通过细胞与细胞之间直接接触或者分泌相关细胞因子如IL-10、TGF-β1、IFN-γ等发挥其免疫调节功能[11]。有研究[12]报道该类细胞在炎症、肿瘤、自身免疫病等发病过程中起到了重要的作用。

图4 流式微球检测结果图
本研究显示ITP患者治疗前CD8+CD28-Treg及细胞因子IL-10、TGF-β1的表达低于正常对照组,IFN-γ的表达高于正常对照组,说明在ITP患者中存在CD8+CD28-Treg及相关细胞因子的表达异常。激素和rhTPO治疗后有效患者CD8+CD28-Tregs、IL-10、TGF-β1的表达明显增加,INF-γ的表达降低。治疗后无效患者改变不大,说明激素和rhTPO可能通过调节CD8+CD28-Treg及细胞因子在ITP患者体内的表达发挥疗效。通过绘制治疗前CD8+CD28-Treg与疗效的ROC曲线分析得知,通过检测治疗前 CD8+CD28-Treg的比例可以预测激素及rhTPO的疗效,为临床治疗提供参考作用。
有研究[13]显示,约60% ITP患者外周血中能检测出血小板特异性自身抗体,其中最重要的组成部分是抗GPⅡb/GPⅢa抗体和抗GPIb抗体。两种抗体也可同时存在于部分患者。本实验显示,抗GPIb抗体阳性患者使用激素治疗的疗效不佳。而抗GPⅡb/Ⅲa抗体是否阳性,激素治疗效果差异不大,分析原因可能是两种抗体导致PLT减少的机制不同。GPⅡb/GPⅢa属于整合素家族,具有联接PLT与纤维蛋白原的功能,与PLT特异性GPⅡb/GPⅢa抗体结合后形成抗原-抗体复合物,通过Fc受体单核巨噬细胞系统识别抗原-抗体复合物破坏血小板。GPIb属于富含亮氨酸家族蛋白,可结合血管假性血友病因子介导血小板黏附,与抗体结合之后会通过非Fc受体依赖途径引起血小板破坏[13-14]。建议对抗GPIb阳性患者避免应用激素等以网状内皮系统的Fc受体为主要作用靶点的治疗方法。
综上所述,ITP患者存在CD8+CD28-Treg及其相关细胞因子的表达异常,激素和rhTPO可能通过调节CD8+CD28-Treg及其相关细胞因子的表达来发挥疗效。CD8+CD28-Treg有可能作为激素及rhTPO的疗效预测指标之一,同时对抗GPIb抗体阳性的ITP患者采取非激素治疗,可能取得更好的治疗效果。后续可以纳入以丙球、利妥昔单抗等用药作为治疗方案的ITP患者作为实验组,进一步探究CD8+CD28-Treg及PLT特异性抗体在其临床治疗中的意义,为临床的个体化治疗提供参考依据。

