CD16+单核细胞对冠心病患者OPCABG术后预后的预测价值
朱 瑞,张成鑫,王会平,李 鑫,沈志明,孙 飞,储诚豪,葛圣林
冠状动脉粥样硬化性心脏病(coronary heart disease, CHD)近年来在外科治疗策略上获得了极大的进展,寻找能够独立预测CHD患者术后预后的预测因子对术前危险分层评估具有重要意义[1]。单核细胞在CHD的发生和进展过程中扮演关键角色,血液中单核细胞黏附于活化的血管内皮细胞,经内皮间隙浸润至内膜下分化为巨噬细胞,巨噬细胞吞噬内膜下脂质形成泡沫细胞和脂质斑块,激活先天性和适应性免疫反应[2],继而表达一系列炎症因子与基质金属蛋白酶,导致粥样斑块的不稳定性和血管再狭窄[3]。研究表明CHD进展伴随着外周血经典单核细胞向CD16+单核细胞亚群的转变[4],而中间型单核细胞(CD14++CD16+)增多与CHD患者主要不良心血管事件(major adverse cardiovascular events,MACE)密切相关[5]。该研究旨在分析CD16+单核细胞对接受非体外循环冠状动脉旁路移植术(off-pump coronary artery bypass grafting,OPCABG)CHD患者术后预后的预测价值,为术前评估预后危险分层提供参考依据。
1 材料与方法
1.1 病例资料选取安徽医科大学第一附属医院心脏大血管外科接受OPCABG的CHD患者168例,术中因个体原因转为体外循环下冠状动脉旁路移植术(CABG)7例,2年随访期间5例失访,因非心源性死亡1例。最终符合本研究并完成随访过程155例,男125例,女30例,年龄47~75(62.87±5.57)岁。诊断标准及手术指征依据《2011版ACCF/AHA关于外科冠状动脉旁路移植治疗指南》。排除标准:① 术前存在感染或炎症疾病病史;② 自身免疫疾病病史;③ 血液疾病或恶性肿瘤病史;④ 既往血运重建史或其他手术后;⑤ 既往服用过激素;⑥ 合并瓣膜病、原发性心肌病、严重心力衰竭或脑血管疾病;⑦ 肝肾功能不全;⑧ 术中转为CABG;⑨ 因非心源性死亡;⑩ 无法提供知情同意。本研究获安徽医科大学第一附属医院伦理委员会批准,符合《赫尔辛基宣言》,纳入此研究患者均已签署知情同意书。
1.2 临床资料登记登记患者基本临床资料及术前常规化验指标,包括年龄、性别、体质量指数(body mass index, BMI)、高血压、糖尿病、脑血管病史、吸烟史、家族史、既往服用药物史、左心房前后径(left atrial diameter, LAD)、左心室舒张末内径(left ventricular end diastolic diameter, LVEDD)、左心室射血分数(left ventricular ejection fraction, LVEF)、血常规、肝肾功能、血脂四项、血糖、C-反应蛋白(C-reaction protein, CRP)等。
1.3 单核细胞亚群流式细胞术检测术前采集患者外周静脉血3 ml于肝素抗凝管,3 h内行流式细胞术检测。取两支流式管加入血样本100 μl,一管加入抗体CD14-FITC、CD16-PE和CD45-PC5各10 μl,另一管为对照管,加入对应同型对照抗体10 μl,震荡摇匀后室温下避光15 min;每管再分别加入溶血剂900 μl,震荡摇匀后37 ℃水浴箱避光10 min;采用Beckman CytomicsTMFC-500系列流式细胞仪检测。检测前进行光流路质量调控和荧光补偿,控制各项指标在质量允许值范围内。每份标本检测获取细胞10 000个以上,检测数据以Listmode文件形式保存,采用CXP 流式分析软件进行数据分析。通过白细胞共同分化抗原CD45、单核细胞标志性脂多糖 (lipopolysaccharide, LPS)受体CD14、FcγⅢ受体CD16对单核细胞群进行分析[6],根据前向角(FSC)、侧向角(SSC)及CD45表达强度确定单核细胞群,再采取同型对照确定CD14与CD16表达强度的界值,将单核细胞分为经典型(CD14++CD16-)、CD16+单核细胞2种单核细胞子集。根据本研究CHD患者CD16+单核细胞占比的三分位数进行分组,低CD16+单核细胞组51例(≤32.05%)、中CD16+单核细胞组53例(32.05%~40.1%)和高CD16+单核细胞组51例(>40.1%)。
1.4 随访患者术后随访2年,以发生MACE作为此项研究随访观察的终点,计算并登记发生MACE距手术当天的时间。MACE定义:心源性死亡、再发心绞痛或心肌梗死、心力衰竭、非出血性卒中、随访期间需再次进行冠状动脉血运重建[非预期经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)或CABG]。
2 结果
2.1 患者基线特征比较入选CHD患者155例中男125例(80.6%),女3例(19.4%),年龄47~75(62.87±5.57)岁。术后发生MACE的患者24例,其中心源性死亡10例,再发心肌梗死4例,心力衰竭7例,非出血性卒中2例,需再次行手术进行血运重建1例。MACE组年龄较大(P<0.001),糖尿病史较多(P<0.05),术前LVEF较低(P<0.001),而CRP值及CD16+单核细胞占比较高(P<0.001),术后呼吸机辅助时间与ICU停留时间均较长(P<0.001)。见表1。
2.2 CD16+单核细胞三分位组比较流式检测外周血CD16+单核细胞占比,W2象限为CD16+单核细胞,见图1。高CD16+单核细胞组患者术前CRP(P<0.001)、术后ICU停留时间(P<0.05)及MACE发生率(P<0.001)均高于中、低CD16+单核细胞组,见表2。Kaplan-Meier生存分析显示高CD16+单核细胞组术后MACE发生率(33.3%)明显高于中(9.4%)、低CD16+单核细胞组(4.0%),差异有统计学意义(Log Rank=21.960,P<0.001),见图2。
2.3 CD16+单核细胞对MACE的预测价值通过单因素Cox比例风险模型对影响CHD患者术后预后的因素进行分析,结果表明年龄、CRP、LVEF、呼吸机辅助时间、ICU停留时间和CD16+单核细胞占比与术后MACE发生相关(P<0.05)。经多因素Cox比例风险模型对性别、BMI、吸烟史、高血压史、糖尿病史、家族史、CRP等传统心血管疾病危险因素进行校正,分析结果显示CD16+单核细胞是CHD患者OPCABG术后发生MACE的独立危险因素(HR=1.071,95%CI:1.040~1.104,P<0.001)。见表3。
2.4 ROC曲线评估通过ROC曲线评估,CD16+单核细胞预测术后MACE的曲线下面积为0.786 (95%CI:0.687~0.884,P<0.001),最佳截断值41.9%,灵敏度70.8%,特异度78.6%,证明术前CD16+单核细胞占比具有较好预测CHD患者OPCABG术后MACE的价值。CD16+单核细胞预测术后MACE的ROC曲线下面积仅次于ICU停留时间(AUC=0.899,95%CI:0.841~0.958,P<0.001),高于呼吸机辅助时间(AUC=0.753,95%CI:0.640~0.865,P<0.001)等指标。见图3。
3 讨论
CHD是由于冠状动脉发生动脉粥样硬化(ather-osclerosis,AS)导致冠脉狭窄或阻塞,引起心肌缺血、低氧或坏死的一种缺血性心脏病。AS本质上是一种慢性炎症,多种免疫细胞参与了动脉粥样斑块的形成。人类经典型单核细胞(CD14++CD16-)占循环单核细胞池的85%,其余由中间型(CD14++CD16+)和非经典型(CD14+CD16++)组成[7]。AS初期血液中经典型单核细胞数量增加,黏附于活化的血管内皮细胞,浸润至血管内膜下分化为巨噬细胞[8],随着AS的进展,经典型单核细胞向CD16+单核细胞亚群进行转变[4],最新一项研究也证实单核细胞在机体稳定期向炎症期发展过程中经历了从经典型(CD16-)到中间型(CD16+)和非经典型(CD16++)的顺序演变[9]。Kashiwagi et al[10]研究认为CD16+单核细胞高计数表达与稳定心绞痛患者AS斑块的脆弱性密切相关。CD16+单核细胞在心室重塑过程中也扮演了重要角色,Czepluch et al[11]发现CD16+单核细胞在CHD患者发生心肌梗死时大量转移至梗死部位,参与心肌修复与心室重塑。
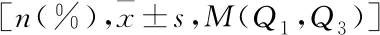
表1 MACE组与非MACE组患者基线特征比较
ACEI:血管紧张素转化酶抑制剂;ARB:血管紧张素Ⅱ受体阻滞剂;NSAIDs:非甾体类消炎药;CCB:钙离子拮抗剂;β-blocker:β受体阻滞剂;Statins:他汀类药物;TC:总胆固醇;TG: 甘油三酯;LDL-C: 低密度脂蛋白胆固醇;HDL-C: 高密度脂蛋白胆固醇;BUN:血尿素氮
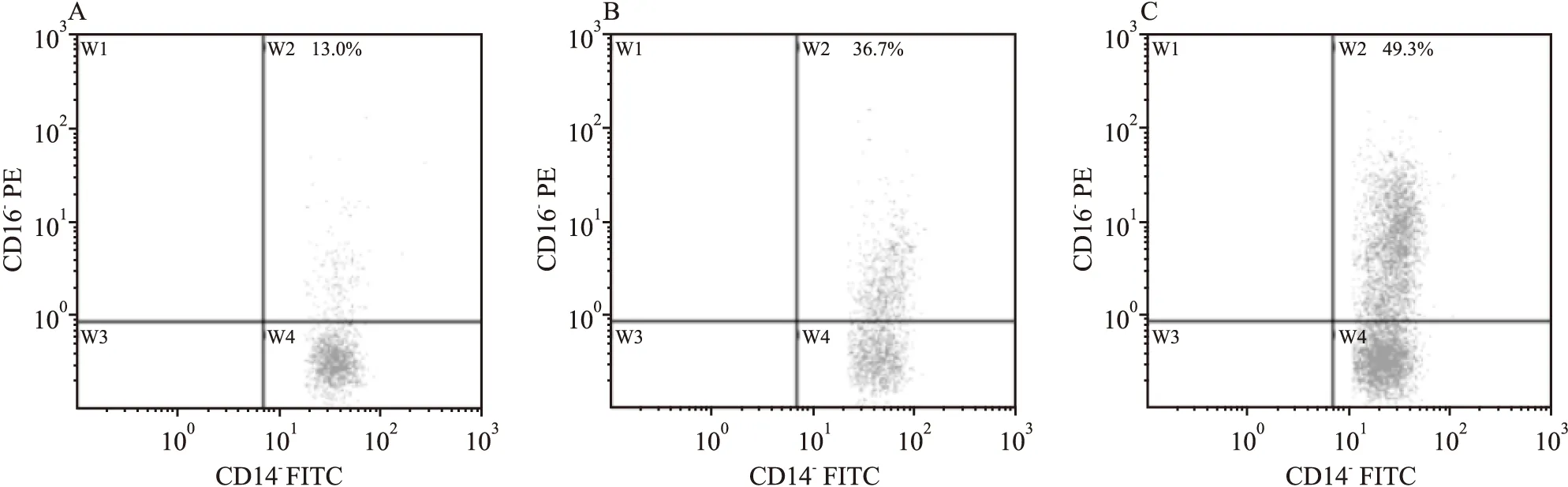
图1 流式细胞术检测外周血CD16+单核细胞
A:低CD16+单核细胞组(≤32.05%);B:中CD16+单核细胞组(32.05%~40.10%);C:高CD16+单核细胞组(>40.10%)

表2 CD16+单核细胞三分位组临床资料比较[M(Q1,Q3)]

图2 CD16+单核细胞三分位组Kaplan-Meier生存分析
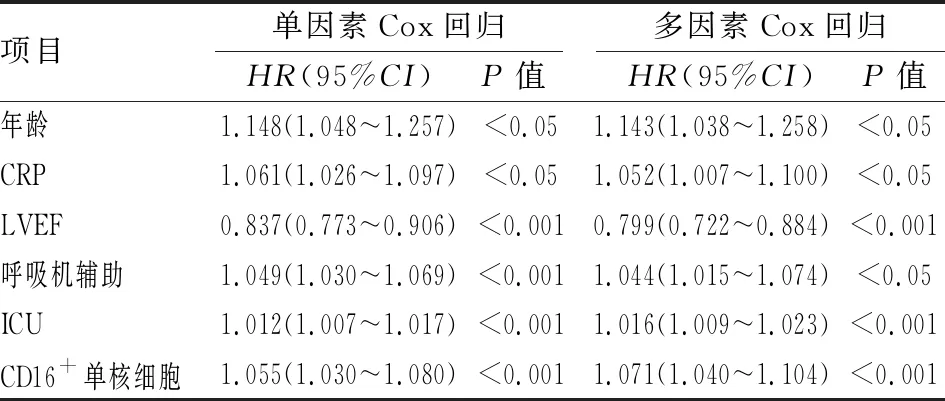
项目单因素Cox回归HR(95%CI)P值多因素Cox回归HR(95%CI)P值年龄1.148(1.048~1.257)<0.051.143(1.038~1.258)<0.05CRP1.061(1.026~1.097)<0.051.052(1.007~1.100)<0.05LVEF0.837(0.773~0.906)<0.0010.799(0.722~0.884)<0.001呼吸机辅助1.049(1.030~1.069)<0.0011.044(1.015~1.074)<0.05ICU1.012(1.007~1.017)<0.0011.016(1.009~1.023)<0.001CD16+单核细胞1.055(1.030~1.080)<0.0011.071(1.040~1.104)<0.001
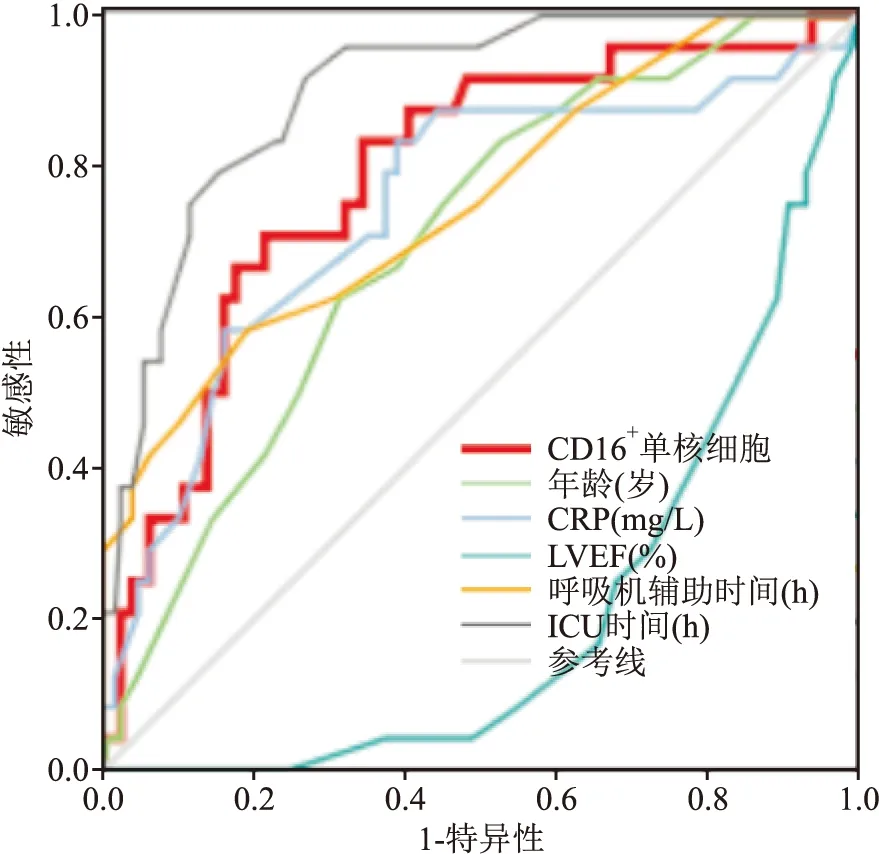
图3 CD16+单核细胞等指标预测术后MACE的ROC曲线
心血管疾病危险因素与先天性免疫系统激活引起的免疫学变化有关。单核细胞在CHD患者中表现出明显的异质性,外周血单核细胞水平升高是CHD的独立危险因子[12],更有研究[13]显示MACE患者的单核细胞基线特征改变与CHD患者相似,都表现出中间型单核细胞水平较高,经典和非经典单核细胞向中间型单核细胞转移。Shantsila[14]指出单核细胞本质上分为CD14+CD16-与CD14+CD16+两种具有明显不同作用的细胞子集,CD14+CD16-单核细胞促进蛋白水解和炎症进展,而CD14+CD16+单核细胞具有拮抗炎症和免疫调节作用。CD16+单核细胞作为独立的一类单核细胞子集,已被研究[10]证实可用于评估CHD患者冠状动脉粥样硬化斑块的脆弱性。
研究[15]显示在急性心肌梗死发生时中间型单核细胞(CD14+CD16+)的表达急剧升高,其表达水平与左心室心功能损伤程度及梗死面积具有一致性,同时在急性心肌梗死患者的梗死灶核心区发现了大量单核细胞聚集。在梗死区周围聚集的单核细胞促进白细胞介素-6、肿瘤坏死因子等炎症细胞因子释放,在血管内皮细胞损伤、心肌细胞凋亡、心力衰竭及心室重塑等病理生理过程中具有重要作用[12]。CHD患者术前CD16+单核细胞水平增加,拮抗心肌急性缺血所致的炎症反应,有利于心室重塑,这种过度动员的CD16+单核细胞水平反映了CHD患者术前的心肌炎症状态,这可能是此类患者术后易发生MACE的原因。
本研究通过分析CHD患者CD16+单核细胞亚群占比、传统心血管疾病危险因素、在院临床指标等与术后发生MACE的关系,表明CD16+单核细胞是CHD患者OPCABG术后MACE的独立预测因子,对于CHD患者术前评估预后危险分层具有重要意义。

