中华猕猴桃根中TUA体外抗炎作用研究*
邱吉汉,程齐来,郭小华,金 奇,郑精国
(1.赣州市立医院 赣南医学院附属市立医院 药剂科;2.赣南医学院药学院,江西 赣州 341000)
炎症反应是临床常见的病理过程,是指动物机体针对促炎因子、致炎因素、外界对机体的刺激发生的以防御反应为主的应答反应,以局部组织的变质、渗出和增生变化为主要表现[1]。无论中医临床还是西医临床上均有“十病九炎”的说法,主要的原因是很多疾病的病变基础就是炎症。目前西医临床治疗炎症的药物主要为肾上腺皮质激素类和非甾体类抗炎药等。虽然这两种药物在临床应用过程中发挥了一些积极作用,但同时也表现出不良反应较多等弊端。中医临床中所涉及的疮疡、痈肿、疔毒等病证与西医临床所述的炎症病理过程相似,一般应用有清热解毒、活血化淤等功效的中药进行防治[2]。已有研究结果表明,一些中草药特别是从中提取分离得到的一些化学单体(天然产物)具有良好的抗炎效果,同时具备不良反应较少的优点[3]。中华猕猴桃根A.chinensisRadix,又名藤梨根,是我国江西赣南地区应用较为广泛的清热解毒中草药,在民间一直有其可冶“无名肿毒”之说。中华猕猴桃根中含有多种药理活性成分,前期研究表明乌苏烷型三萜类粗提物表现出较强的体外抗炎作用。TUA (2β, 3β, 23-trihydroxy-urs-12-en-28 -oic acid)是从赣南地区资源分布较丰富的中华猕猴桃根ActinidiachinensisRadix中提取、分离并鉴定得到的一个乌苏烷型五环三萜类主要活性成份之一。目前未见有TUA抗炎作用相关报道。本研究利用脂多糖(1ipopoly- saccharide,LPS)诱导RAW 264.7细胞建立炎症模型,通过测定TUA对细胞因子的影响,观察体外抗炎效果,并初步阐明其抗炎作用机理,以期为临床应用提供依据。
1 材料与方法
1.1药品与试剂TUA 由本课题组前期从中华猕猴桃ActinidiachinensisRadix (Actinidiaceae) 根中提取分离得到。使用溶剂提取法与多种柱层析法对该药材根部进行分离,利用现代理化分析和波谱检测技术(UV,MS,IR,NMR等)对所得到的一系列化合物进行结构鉴定,最终得到了乌苏烷型三萜化合物TUA,采用Agilent1100 HPLC,DAD检测器,面积归一法测定其纯度,结果含量>96.7%。在本次实验中, TUA 用二甲亚砜(DMSO)溶解。溶剂DMSO的最终浓度≤0.1%;实验过程中使用的药品一般贮存在-4 ℃冰箱中≤4天。
LPS(批号173M5115V)、MTT,Sigma公司产品;DMEM(高糖)、DMSO,Bio-Rad公司;胎牛血清(FBS),ThermoFisher Scientific公司产品。Griess法NO检测试剂盒,Bio-Rad公司产品; IL-10、TNF-α、IL-6、IL-1β非即用型ELISA检测试剂盒,Promega公司产品;所用其他化学试剂均为国产分析纯。
1.2主要仪器倒置光学显微镜(CKX41,OLYMPUS);细胞恒温培养箱(HERACELL150i,Thermo scientific);台式高速冷冻离心机(H1650R,上海卢湘仪);酶标仪(SPECTRA max Plus 384,Molecular Devices公司)。
1.3细胞系及实验动物RAW 264.7小鼠巨噬细胞瘤细胞,购自赣州阳明生物科技有限公司。
1.4实验方法
1.4.1 TUA对RAW264.7细胞的毒性作用将正处于对数生长期的小鼠巨噬瘤细胞接种在96孔培养板上,细胞浓度大约是4.8×105个/mL,每孔添加细胞混悬液100 μL,使用含100 mL·L-1FBS的DMEM 高糖培养基作为培养液,周边保湿孔中添加200 μL 磷酸缓冲盐溶液,37 ℃、5%CO2(V/V, 体积分数)条件下培养12 h,直到肿瘤细胞贴壁同时恢复到静息状态。将上述所用培养液吸弃,后面实验采用的培养液均为不含100 mL·L-1FBS的DMEM 高糖液体培养基。后续实验过程中在DMEM(高糖)培养液中加入不同成分作为不同实验组,100 μL/组,具体实验分组如下: ①对照组(CK):加入DMEM(高糖)培养液; ②LPS组:在DMEM(高糖)培养液中增添浓度是50 μg·mL-1的LPS母液,使LPS实验浓度是1 μg·mL-1; ③TUA组:在DMEM(高糖)培养液中加入浓度为1 000 μg·mL-1的TUA母液,过0.22 μm滤膜,TUA组实验浓度各自是80、60、40、20、10、5 μg·mL-1,每组6个复孔,继续培养24 h。
以上各实验组都添加20 μL、浓度是5 mg·mL-1MTT,继续培养2 h。培养结束后,吸弃全部液体,保留贴壁肿瘤细胞,各实验组都添加100 μL DMSO,摇床上振荡10 min,使细胞内结晶充分溶解,在酶标仪上λ=520 nm处测定各孔OD值。
1.4.2 TUA对RAW264.7细胞分泌细胞因子的影响
1.4.2.1 TUA对RAW264.7细胞分泌NO的影响取正处在对数生长期的小鼠巨噬瘤细胞接种在6孔培养板上,细胞密度大概是4.8×105个/mL,每孔添加细胞混悬液2 mL,使用含100 mL·L-1FBS的DMEM 高糖培养基作为培养液,周边保湿孔中添加200 μL 磷酸缓冲盐溶液,37 ℃、5%CO2(V/V, 体积分数)条件下培养12 h,直到肿瘤细胞贴壁同时恢复到静息状态。将上述所用培养液吸弃,后面实验采用不含胎牛血清的DMEM(高糖)培养液。在DMEM(高糖)培养液中加入不同成分作为不同实验组,2 μL/组,具体实验分组如下: ①LPS组与对照组(CK):只添加DMEM(高糖)培养液; ②TUA给药组:在DMEM(高糖)培养液中加入浓度为1 000 μg·mL-1的TUA母液,过0.22 μm滤膜,TUA组实验浓度各自是20、10、5 μg·mL-1,每组3个复孔,培养6 h。
预处理后吸弃全部培养液,对照组添加DMEM(高糖)培养液;LPS组和TUA组均添加含LPS(终浓度为1 μg·mL-1)的DMEM(高糖)培养液,培养24 h。在此培养过程中,分别在6、12、18、24 h时,收集细胞培养上清液,采用Griess试剂盒检测各组样品中NO含量。
1.4.2.2 TUA对RAW264.7细胞分泌的TNF-α影响细胞处理同1.4.2.1。分别在细胞培养达6、12、18、24 h时,收集细胞培养上清液,使用非即用型ELISA检测试剂盒检测各组样品中TNF-α含量。
1.4.2.3 TUA对RAW264.7细胞分泌的IL-6、IL-1β、IL-10影响细胞处理同1.4.2.1。分别在细胞培养达24 h时,收集细胞培养上清液,使用非即用型ELISA检测试剂盒测定各组样品中IL-6、IL-1β、IL-10含量。
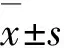
2 结 果
2.1 TUA对RAW264.7细胞活性的影响实验结果表明,当TUA浓度不高于20 μg·mL-1时,在24 h内对RAW 264.7细胞基本上无毒性作用,所测OD值与对照组(CK)、LPS组比较差异均无统计学意义(P>0.05),当TUA浓度在60~100 μg·mL-1时,与对照组(CK)、LPS组差异均有统计学意义(P<0.05)(图1)。其余试验中所用TUA剂量均在安全范围内(≤20 μg·mL-1)选取。
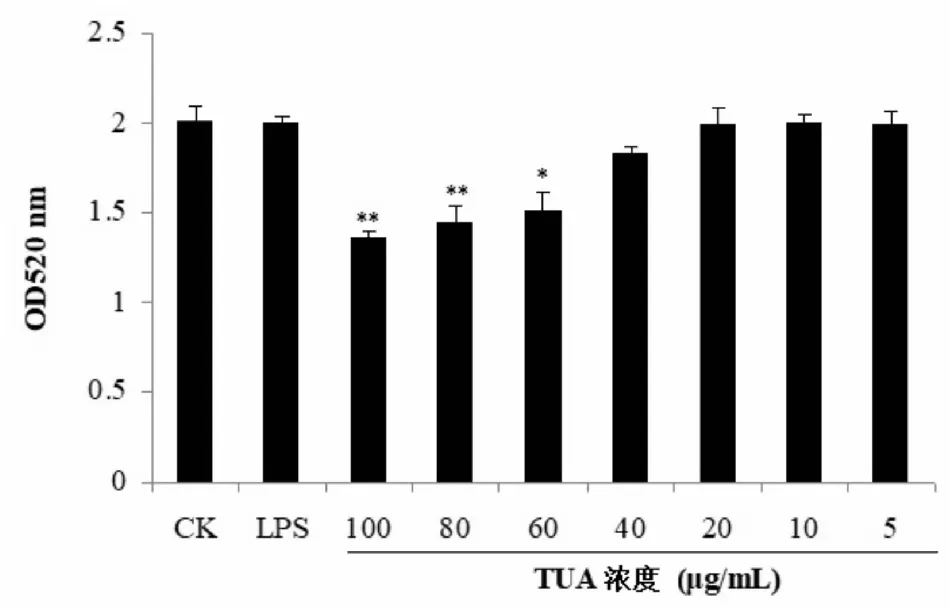
与对照组CK比,*P<0.05,**P<0.01。
2.2 TUA对RAW264.7细胞分泌NO、TNF-α的影响表1所示,LPS组细胞通过致炎药物干预12 h后,NO表达相比对照组升高(P<0.01),并且NO表达在8~24 h内与干预时间呈正相关。TUA组细胞采用不同浓度的TUA干预4 h,再经LPS致炎12、16、24 h,各剂量TUA组的NO表达均显著低于LPS组(P<0.01),同时各时间-剂量点的NO表达均显著高于对照组(P<0.01)。组间比较,LPS刺激8 h时,各组的NO表达差异均无统计学意义(P>0.05)。
表1 TUA对RAW 264.7细胞分泌NO的影响
注:与对照组CK比较,**P<0.01; 与LPS组比较, ##P<0.01。
如表2所示,LPS组细胞通过致炎药物干预8 h后,TNF-α表达高于对照组(P<0.01),并且TNF-α表达在8~24 h内与干预时间呈正相关。TUA组细胞采用不同浓度的TUA干预4 h,再经LPS致炎12、16、24 h,各剂量组的TNF-α表达均显著低于LPS组(P<0.01),同时各时间-剂量点的TNF-α表达均显著高于对照组(P<0.01)。从表2中还可以看出,TNF-α的表达在24 h内呈剂量依赖性,即在用药安全范围内,TUA的药物浓度愈高,其抑制TNF-α表达的效果愈强。
表2 TUA对RAW 264.7细胞分泌TNF-α的影响
注:与对照组CK比较,**P<0.01; 与LPS组比较, ##P<0.01。
2.3 TUA对RAW264.7细胞分泌IL-1β、IL-6、IL-10的影响由图2、图3、图4结果可知,LPS组细胞在致炎药物干预24 h后,IL-1β、IL-6、IL-10的表达均显著高于对照组(P<0.01)。TUA组细胞采用不同浓度的TUA干预4 h,再经LPS致炎24 h,TUA各剂量组的IL-1β、IL-6、IL-10表达均显著低于LPS组(P<0.01),且呈剂量依赖性,即在用药安全范围内,药物浓度越高,IL-1β、IL-6、IL-10表达越低;但与对照组相比,TUA各剂量组的IL-1β、IL-6、IL-10表达依然显著升高(P<0.01)。
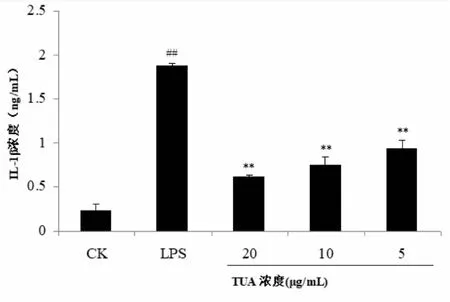
与对照组CK比较,**P<0.01; 与LPS组比较, ## P<0.01。
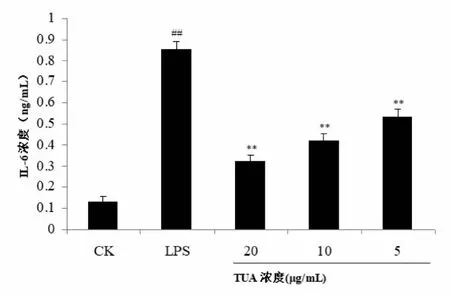
与对照组CK比较,**P<0.01; 与LPS组比较, ## P<0.01。

与对照组CK比较,**P<0.01; 与LPS组比较, ##P<0.01。
图4 TUA对RAW264.7细胞分泌IL-10的影响
3 讨 论
炎症的定义为具有血液循环的活体组织由损伤因子诱发的机体防御性反应,俗称“发炎”。炎症产生的关键环节是局部的血管反应,特征性地表现为炎症部位的毛细血管充血扩张,组织通透性增加,继而发生炎症部位的水肿和炎性细胞的渗出[4]。RAW 264.7细胞是体内巨噬细胞系的一种,其在机体的免疫系统激活过程中发挥了重要作用。LPS是刺激机体发生免疫炎症反应的一种很重要的激动剂,LPS能够促使机体多种细胞尤其是巨噬细胞生成和表达大量的免疫致炎活性分子,并促使炎症反应的发生[5]。NO是一种重要的炎症介导因子,可在LPS的刺激下由巨噬细胞释放,NO在炎症产生的各个阶段都发挥了非常重要的干预影响作用[6]。高浓度的NO可以刺激和促使致炎因子TNF-α和IL-1β的表达,TNF-α和IL-1β在炎症反应初始阶段的表达就会显著增高,二者在炎症反应过程中发挥了对细胞因子级联反应的促进作用[7]。TNF-α可刺激IL-6、IL-10等大量致炎细胞因子的表达,并且各因子之间可以通过相互作用形成正反馈,最终导致炎症反应的继续加重[8]。
本研究通过LPS诱导RAW 264.7细胞作为体外炎症模型来研究TUA的抗炎作用。实验中LPS的药物剂量参照Park C M等[9]的文献数据,并经MTT试验验证,浓度为1 μg·mL-1的LPS在24 h内对RAW 264.7细胞不产生药理毒性作用,并确定了TUA的安全体外干预浓度为≤20 μg·mL-1。实验结果显示,不同浓度的TUA均可极显著地抑制LPS诱导RAW 264.7细胞后NO、TNF-α、IL-1β、IL-6及IL-10表达(P<0.01),且呈剂量依赖性。因此,本研究通过初步的体外抗炎试验证明,从猕猴桃根中分离得到的乌苏烷化合物TUA具有较好的体外抗炎效果,但有关TUA更广泛的抗炎效应及作用机制有待进一步深入研究。

