RIP1缺失或突变减弱MLL-AF9白血病细胞致病能力
徐兆丰 蒋钰玉 靳羽嘉 李静


摘 要: 通过克隆形成能力实验以及体内移植实验,发现当敲除小鼠MLL-AF9细胞中的受体结合蛋白1(RIP1)基因后,相对于WT MLL-AF9细胞,其克隆形成能力明显减弱,移植后小鼠生存时间延长了3倍以上.在组织切片观察中,WT MLL-AF9细胞移植小鼠出现明显白血病发病特征,而RIP1-/-MLL-AF9细胞移植小鼠的切片显示正常.当将RIP1中的激酶活性位点突变后,相对于WT MLL-AF9细胞,在移植实验中小鼠生存时间明显延长.对病发小鼠的脾脏细胞流式分析结果表明:激酶活性位点突变后致病能力明显减弱,提示RIP1基因的缺失会导致MLL-AF9致病能力减弱.
关键词: 受体结合蛋白1(RIP1); MLL-AF9; 克隆形成; 生存时间; 激酶活性
中图分类号: R 733.71 文献标志码: A 文章编号: 1000-5137(2019)05-0495-08
Abstract: In this article,by using the clonality assay and transplantation experiments in vivo,we found that the MLL-AF9 cells knocked out receptor-interating protein 1(RIP1) gene showed more weaken clonality,comparing with WT MLL-AF9 cells,and the survival experiments show the survival time of RIP1-/-(MLL-AF9) mice is extended more 3 times than WT MLL-AF9 mice after transplantation.The morphology of leukemia is observed in WT MLL-AF9 cells transplanted mices tissue sections,while the sections of RIP1-/-MLL-AF9 cells are normal.When we mutate the kinase active sites in RIP1,the survival time of these mice is longer than the mice transplanted with WT MLL-AF9 cells.In the flow cytometry analysis of spleen cells of diseased mice,we found the mutations in the kinase active sites showed a significant decrease of pathogenicity.It is suggested that the deletion of the RIP1 gene leads to a decrease in the pathogenic ability of MLL-AF9 cells.
Key words: Receptor-Interacting Protein 1 (RIP1); MLL-AF9; clonality; survival time; kinase activity
0 引 言
急性髓系白血病(AML)是一種侵袭性造血系统恶性肿瘤,其发病率与年龄相关,且老年患者占有较高的比例.在老年AML患者中,其病情不仅更加复杂,而且治疗效果差[1].现阶段针对AML的治疗方案仍以联合化疗为主.该方案虽能使大部分患者病情达到完全缓解,但也极易出现愈后复发的情况,因此寻找一条更加有效的白血病治疗途径是当前血液病研究领域的一项重要任务.AML治疗的难点在于静息下的白血病干细胞(LSCs)对于化疗药物具有耐药性且能够逃逸免疫系统的监察[2-3].同时在细胞数量极少的情况下,LSCs具有自我更新和重建白血病的能力[4],因此治疗的重点应是有效清除患者体内的LSCs.
BINDER等[5]通过对LSCs的研究发现:由肿瘤坏死因子α(TNF-α)介导的程序性坏死在AML细胞中被激活但并不发生坏死.受体结合蛋白1(RIP1) 在细胞凋亡程序性坏死、细胞存活中具有重要的调控作用,是该通路中的关键因子[6-8].在肺癌研究中,RIP1基因的表达与正常细胞相比明显增高,并且增高程度与癌症的恶性程度正相关[9].研究结果也表明:RIP1能调节NF-κB信号传导[10-11],而NF-κB信号传导在癌症的发生发展中发挥着作用[12-15].在AML细胞中抑制NF-κB信号通路的激活能够促进细胞的死亡[16].而抑制RIP1基因的表达在神经损伤等疾病治疗中已有过运用[17-18],尚未发现有明显的副作用.
本文作者通过克隆形成能力实验以及细胞体内移植实验探究了RIP1基因缺失或突变对MLL-AF9细胞致病能力的影响.结果显示,当MLL-AF9细胞中RIP1基因缺失后与WT MLL-AF9细胞相比,白血病干细胞集落数明显减少,移植后小鼠生存时间明显延长,在脾脏等组织切片中出现白血病浸润的情况更少.因此可以得出结论:RIP1基因缺失或突变会减弱MLL-AF9细胞致病能力.
1 材料与方法
1.1 实验材料
细胞株及培养基:RIP1-/-MLL-AF9细胞、WT MLL-AF9细胞、Phoenix-Eco包装细胞,以及K45A,K377R,RIP1质粒由洛约拉大学医学中心提供;血清使用澳大利亚Gibco公司的胎牛血清;Roswell Park Memorial Institute-1640(RMPI-1640)培养基和磷酸盐缓冲液(PBS)购自于Hyclone公司;细胞因子SCF,IL-6,IL-3购自PeproTech公司;不同型号细胞培养皿购自Corning公司;8周龄清洁级C57雄性小鼠购自上海斯莱克实验动物有限责任公司;脾脏组织切片委托苏州西山中科实验动物有限公司制备.
1.2 实验试剂
台盼蓝染液购自Sigma公司;红细胞(RBC)裂解液购自eBioscience公司;甲基纤维素培养基购自STEMCELL Technologies公司;4%(质量分数)多聚甲醛溶液购自北京赛驰生物科技有限公司.
其他试剂、化学试剂均使用实验室常用试剂.
1.3 实验方法
1.3.1 细胞复苏及培养
细胞的冻存与复苏遵循“慢冻速溶”的原则.细胞的完全培养基配方为:胎牛血清(FBS) 100 μL·mL-1,SCF 100 ng·mL-1,IL-6 50 ng·mL-1,IL-3 20 ng·mL-1,以RMPI-1640为体系中的溶剂.悬浮细胞培养体系体积为3 mL,每隔24 h传代,控制传代时细胞浓度为1.0×106~1.5×106 mL-1.
1.3.2 克隆形成能力实验
将细胞接种于甲基纤维素培养基中,细胞浓度为1000 mL-1,每组细胞设置3个平行样,在37 ℃,5%(体积分数)CO2恒温培养箱中培养5 d 后,于显微镜下计数细胞数量大于等于50的集落数,并记录.
1.3.3 体内实验
将8周龄C57小鼠半致死辐照后进行尾静脉注射,每只小鼠注射2×104个白血病干细胞和2×105个支持细胞,支持细胞取自正常的8周龄C57小鼠.在辐照前2 d及辐照后2周内给小鼠喂食含抗生素的饮用水,防止因辐照后免疫系统缺陷造成小鼠感染病菌死亡,对实验结果造成影响.细胞移植后观察小鼠生存状态,记录小鼠存活时间.
1.3.4 组织切片
待小鼠发病死亡后立即进行解剖,取出其肝脏、脾脏组织于4%(体积分数)多聚甲醛溶液中固定,将固定的组织委托苏州中山生物有限公司制备组织切片.
1.3.5 逆病毒转染细胞
铺板:在直径为6 cm培养皿中接种3×106个Phoenix-ECO细胞,加入4 mL含10% (体积分数)FBS的Dulbeccos Modified Eagle Medium (DMEM)培养基于37 ℃恒溫培养箱培养21 h后,将原培养液吸除,加入4 mL含13%(体积分数)FBS的DMEM培养基培养,条件同上.
转染:待细胞培养3 h后,于5 mL离心管中配置1 mL含500 μL 2×HEPES-buffered Saline(HBS),61 μL物质的量浓度为2 mol·L-1的Ca2+溶液,21 μg质粒,及无菌水的混合液,加入到培养体系中,并加入2 μL 物质的量浓度为25 μmol·L-1的氯喹混合均匀,置于37 ℃恒温培养箱内培养.
换液:培养12 h 后吸去培养液,并用PBS漂洗一遍,加入2 mL含10% FBS的DMEM培养基于37 ℃恒温培养箱培养12 h 后换入新鲜的2 mL含10% FBS的DMEM培养基,然后将细胞置于32 ℃恒温培养箱中培养.
收集病毒:待培养24 h 后收集培养上清于4 ℃ 保存,再加入相同的培养基继续于 32 ℃恒温培养箱中培养,24 h 后再次收集上清,将2次上清集中,并用孔径(直径)为0.45 μm的针头过滤器过滤.
转染:在1 mL 病毒上清中加入2×106个RIP1-/-MLL-AF9细胞,再加入6 μg polybrene助染,在32 ℃下,2500 r·min-1离心4 h后收集细胞培养.
纯化:培养几代后利用流式细胞分选仪分选出有绿色荧光蛋白(GFP+)信号的细胞继续培养,细胞阳性率在98%以上,即可用于实验.
2 结果与分析
2.1 体外克隆形成实验
首先需要确认RIP1基因敲除后,在体外条件下,是否对白血病细胞的克隆形成能力有影响.通过克隆形成实验得到的结果如图1所示.由图1可知:敲除RIP1基因后,RIP1-/-MLL-AF9白血病干细胞的集落数量与WT MLL-AF9白血病干细胞集落数量相比明显减少.
2.2 RIP1缺失细胞的小鼠体内移植实验生存曲线
对移植了WT MLL-AF9白血病细胞和RIP1-/-MLL-AF9白血病细胞的小鼠进行观察并绘制生存曲线(图2).由图2可知:WT MLL-AF9 组小鼠在移植3周后开始出现行动迟缓、精神萎靡的情况;在移植后29~35 d内全部死亡.死后解剖小鼠,发现WT MLL-AF9组小鼠脾脏肿大,呈现出较为典型的白血病发病症状;而RIP1-/-MLL-AF9组全部小鼠生存时间达110 d以上,且移植后其生存状态良好,处死发现脾脏大小正常,未发生白血病.根据以上结果可以得出结论:MLL-AF9细胞中RIP1的敲除对小鼠的生存有明显的帮助.
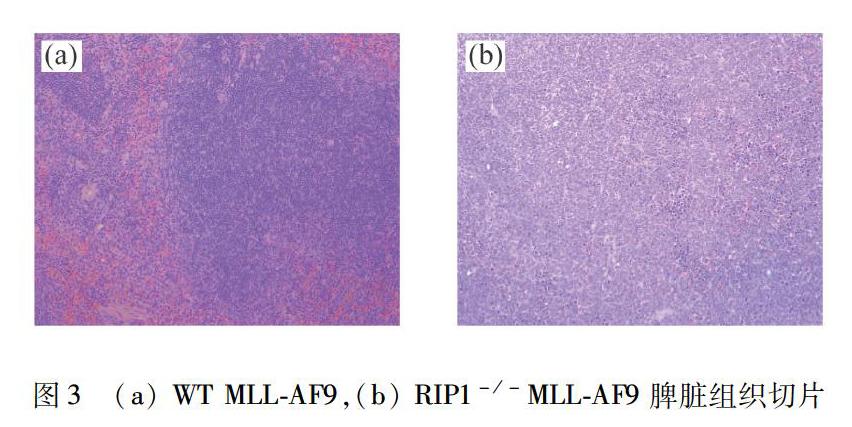
2.3 RIP1缺失的小鼠脾脏组织切片
在体内移植实验的基础之上,将死亡小鼠的脾脏用4%(质量分数)多聚甲醛溶液浸泡固定,做组织切片,切片结果如图3所示.由图3可知:RIP1-/-MLL-AF9组小鼠脾脏的白髓红髓结构完整,未见到白血病病发特征;WT MLL-AF9组脾脏的红髓白髓分解不清,见弥漫性白血病细胞.以上结果证实WT MLL-AF9组小鼠死于白血病,而RIP1-/-MLL-AF9组并没有发生白血病.
2.4 逆病毒转染结果
为了观察突变RIP1对MLL-AF9造成的影响以及再次证实RIP1的作用,将RIP1的2种突变体质粒K45A(激酶活性位点突变)、K377R(泛素化活性位点突变),以及RIP1质粒通过逆病毒转染的方法转入RIP1-/-MLL-AF9细胞中.由于载体质粒为Migr1,带GFP+报告基因,在一段时间的培养后可通过流式分析判断质粒转染效率.如图4所示,K45A突变体质粒和RIP1质粒转入细胞后能够稳定表达,而K377R突变体质粒在转入细胞后,随着一段时间的培养发现带GFP+信号的细胞比例在逐渐下降,表示该质粒转入细胞后不能稳定表达.
2.5 RIP1突变细胞的小鼠体内移植实验生存曲线
图5为MLL-AF9白血病干细胞移植C57小鼠实验生存曲线.由图5可知:WT MLL-AF9组小鼠在移植3周后出现精神萎靡、行动迟缓等特征,在移植后35 d内全部死亡.在小鼠濒死时解剖小鼠,发现WT MLL-AF9组小鼠脾脏肿大,表现出较为典型的白血病病发特征.而RIP1-/-MLL-AF9组小鼠移植后生存状态正常,且生存达3个月以上,处死时观察脾脏,大小正常.值得注意的是,RIP1WTMLL-AF9组较正常的WT MLL-AF9组的发病时间有一定的延迟,可能是由于质粒在细胞中的表达量低于RIP1基因本身在细胞中的表达量.将RIP1K45AMLL-AF9组的结果与RIP1WTMLL-AF9组的结果对比,发现RIP1K45AMLL-AF9组小鼠开始死亡的时间较晚,生存时间较久,说明RIP1激酶活性突变后对小鼠的生存有一定程度上的帮助.
2.6 RIP1突变细胞的小鼠脾脏肝脏组织切片
将死亡小鼠的肝脏和脾脏组织浸泡在4%(质量分数)多聚甲醛溶液中,做组织切片,切片结果如图6所示.由圖6可知:WT组、RIP1K45AMLL-AF9组以及RIP1WTMLL-AF9组的脾脏白髓红髓分界不清,可见白血病细胞弥漫性浸润;肝脏主要以中央静脉及汇管区血管周围为主,被大量白血病细胞浸润,肝窦内见散在白血病细胞;RIP1-/-MLL-AF9组的脾脏白髓红髓结构清晰完整;肝脏正常,肝细胞大小正常,肝索肝窦结构清晰.以上结果证实,除RIP1-/-MLL-AF9组外,其他组小鼠均死于白血病.
2.7 细胞阳性比例
在对RIP1-/-MLL-AF9组脾脏细胞进行流式分析时发现了一个有意义的现象:RIP1K45AMLL-AF9组的小鼠死亡后脾脏中GFP+细胞的比例约为90%,而RIP1WTMLL-AF9组小鼠的脾脏中GFP+细胞的比例在35%左右,结果如图7所示.根据统计学分析,这两者间差异显著,结合图6的生存曲线,表明RIP1K45AMLL-AF9白血病干细胞与RIP1WTMLL-AF9白血病干细胞相比,致病能力较弱,所以需要较多细胞浸润到小鼠脾脏、肝脏中才会导致小鼠死亡.
3 结 论
本研究通过克隆形成能力实验、体内移植实验、组织切片和流式细胞分析等实验,探究了RIP1基因在MLL-AF9细胞中发挥的作用.体内实验结果表明:当RIP1-/-MLL-AF9细胞移植到小鼠体内后,相对于移植了WT MLL-AF9细胞的小鼠,其生存时间延长了3倍以上.从最终小鼠脾脏、肝脏的形态及组织切片上观察到:RIP1基因的缺失阻碍了MLL-AF9细胞浸润到其他器官中.因此可以得出结论:当RIP1基因缺失后,MLL-AF9细胞的致病能力得到抑制.通过逆转录病毒转染得到了带有GFP+报告基因的RIP1K45AMLL-AF9白血病干细胞、RIP1K377RMLL-AF9和RIP1WTMLL-AF9白血病干细胞,但转染过程中发现RIP1K377R质粒转入RIP1-/- MLL-AF9细胞后不能稳定表达,这提示特异性的抑制RIP1的泛素化作用可能会对MLL-AF9白血病干细胞的生长、增殖产生影响.体内移植实验显示:RIP1K45AMLL-AF9组较之于RIP1WTMLL-AF9组发病晚、存活久.对于小鼠脾脏的GFP+细胞比例分析显示:RIP1K45AMLL-AF9组小鼠死亡时脾脏细胞GFP+的比例较高.以上结果表明RIP1的激酶作用缺失会减弱MLL-AF9白血病干细胞的致病能力,提示在治疗急性髓系白血病时,可以利用细胞信号通路的抑制剂特异性来抑制RIP1基因功能,进行辅助治疗.
参考文献:
[1] COLLINGE E,LORON S,LARCHER M V,et al.Elderly patients (age 70 years or older) with secondary acute myeloid leukemia or acute myeloid leukemia developed concurrently to another malignant disease [J].Clin Lymphoma Myeloma Leuk,2018,18(5):S2152265018300326.
[2] KAUFMANN K B,GARCIA-PRAT L,LIU Q.A stemness screen reveals C3orf54/INKA1 as a promoter of human leukemia stem cell latency [J].Blood,2019,133(20):2198-2211.
[3] JI E J,EOM J I,JEUNG H K,et al.Targeting AMPK-ULK1-mediated autophagy for combating BET inhibitor resistance in acute myeloid leukemia stem cells [J].Autophagy,2017,13(4):761-762.
[4] MORIKAWA T,TAKUBO K.Hypoxia regulates the hematopoietic stem cell niche [J].Pflugers Archiv,2016,468(1):13-22.
[5] BINDER S,LUCIANO M,HOREJS-HOECK J.The cytokine network in acute myeloid leukemia (AML):a focus on pro- and anti-inflammatory mediators [J].Cytokine & Growth Factor Reviews,2018,43:8-15.
[6] FESTJENS N,VANDEN-BERGHE T,CORNELIS S,et al.RIP1,a kinase on the crossroads of a cells decision to live or die [J].Cell Death & Differentiation,2007,14:400-410.
[7] MEYLAN E,TSCHOPP J.The RIP kinases:crucial integrators of cellular stress [J].Trends in Biochemical Sciences,2005,30(3):151-159.
[8] DAS A,MCDONALD D G,DIXON-MAH Y N,et al.RIP1 and RIP3 complex regulates radiation-induced programmed necrosis in glioblastoma [J].Tumour Biology,2016,37(6):7525-7534.
[9] WANG Q,CHEN W,XU X,et al.RIP1 potentiates BPDE-induced transformation in human bronchial epithelial cells through catalase-mediated suppression of excessive reactive oxygen species [J].Carcinogenesis,2013,34(9):2119-2128.
[10] QUACH H T,TANIGAKI R,YOKOIGAWA J,et al.Allantopyrone A interferes with multiple components of the TNF receptor 1 complex and blocks RIP1 modifications in the TNF-α-induced signaling pathway [J].The Journal of Antibioticsvolume,2017,70:929-936.
[11] KWON K M,OH S E,KIM Y E,et al.Cooperative inhibition of RIP1-mediated NF-[kappa]B signaling by cytomegalovirus-encoded deubiquitinase and inactive homolog of cellular ribonucleotide reductase large subunit [J].PLoS Pathogens,2017,13(6):e1006423.
[12] DOLCET X,LLOBET D,PALLARES J,et al.NF-KB in development and progression of human cancer [J].Virchows Archiv,2005,446(5):475-482.
[13] LI Q,YU Y Y,ZHU Z G,et al.Effect of NF-KB constitutive activation an proliferation and apoptosis of gastric cancer cell lines [J].European Surgical Research,2005,37(2):105-110.
[14] XIANG J,WOOD L D,MONICA L,et al.Somatic mutations in the Notch,NF-KB,PIK3CA,and Hedgehog pathways in human breast cancers [J].Genes Chromosomes Cancer,2012,51(5):480-489.
[15] WANG T,WANG X G,XU J H,et al.Overexpression of the human ZNF300 gene enhances growth and metastasis of cancer cells through activating NF-kB pathway [J].Journal of Cellular and Molecular medicine,2012,16(5):1134-1145.
[16] SAVVA C G,TOTOKOTSOPOULOS S,NICOLAOU K C,et al.Selective activation of TNFR1 and NF-kappaB inhibition by a novel biyouyanagin analogue promotes apoptosis in acute leukemia cells [J].BMC Cancer,2016,16:279.
[17] CHEN Y,ZHANG L,YU H,et al.Necrostatin-1 improves long-term functional recovery through protecting oligodendrocyte precursor cells after transient focal cerebral ischemia in mice [J].Neuroscience,2017,371:229-241.
[18] KANOU T,OHSUMI A,KIM H,et al.Inhibition of regulated necrosis attenuates receptor-interacting protein kinase 1-mediated ischemia-reperfusion injury after lung transplantation [J].The Journal of Heart and Lung Transplantation,2018,37(10):1261-1270.
(責任编辑:顾浩然)

