降解白酒酒糟中纤维素的细菌的分离鉴定
何颂捷,左勇,张鑫,孙时光,秦世蓉,杨建飞,徐佳,黄雪芹
1(四川轻化工大学 生物工程学院,四川 宜宾,644000)2(四川师范大学 生命科学学院,四川 成都,610101)
四川省是白酒生产大省,2018年产值近2 000亿元,超过四川GDP的5%,在生产白酒的同时,每年产生的酒糟近2 100万t[1]。由于酒糟量大而集中,如不及时处理,会腐败变质,不仅浪费资源,还会污染环境[2-3]。
在酒糟生物质中,主要是纤维素和木质素,此外还含有丰富的氮、磷、钾、蛋白质、微量元素和有机质等[4]。目前,酒糟的用途主要是两个方面,一是用作饲料,再就是用作燃料[5]。近年有研究发现,将酒糟作为有机肥的原料,生产的生物有机肥中含氮量、含磷量、有机质含量分别可达3%、1%、70%[2]。酒糟尤其是浓香型白酒丢糟中含有大量的粗纤维,由于腐熟发酵时间长,腐熟度不够,容易造成制备的有机肥在施用后出现二次发酵,使作物出现烧根的现象。基于应用酒糟制备有机肥存在上述问题,在利用酒糟制备有机肥的过程中,需通过添加纤维素酶制剂,提高腐熟发酵时纤维素酶活力,以便能更高效、快速地降解酒糟中的纤维素[6],释放出酒糟中的各种营养物质[7-8]。其目的不但有利于腐熟发酵,提高酒糟中有机质的利用率和酒糟生物有机肥的营养价值[9],而且在降低纤维素含量、增加蛋白质含量的同时,还能增加土壤微生物种群数量和酶活,有利于改善土壤微生物结构,提高微生物多样性[10]。
本研究以窖泥和酒醅为研究对象,通过不同培养条件,富集培养样品中的微生物,在CMC-Na和酒糟浸出液培养基上分离纯化[11],采用DNS法对筛选出的菌株进行纤维素酶活测定,筛选出高性能降解酒糟的菌株,为酒糟高效、安全腐熟发酵提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 样品
酒醅和窖泥由宜宾某白酒企业提供。
1.1.2 培养基
富集培养基、CMC-Na筛选培养基、选择培养基(将酒糟干燥后磨成粉末状,作为唯一碳源添加到培养基,其余成分和筛选培养基相同)、发酵培养基等[12]由实验室提供。
1.2 高效分解酒糟菌种的分离纯化
富集培养:分别称取酒醅和窖泥5 g,加入45 mL无菌生理盐水,分别在28、37 ℃,150 r/min条件下培养1 h,取10 mL富集液加入到90 mL液体富集培养基中,分别在28、37 ℃,150 r/min下,富集培养24 h。将富集培养液梯度稀释,吸取合适稀释浓度的菌液于筛选培养基上,涂布均匀,分别在28、37 ℃恒温培养48~72 h。从筛选培养基上挑选具有明显菌落差异的单菌落接种到选择培养基上,分别在28、37 ℃下进行划线培养,得到纯的单菌落。
1.3 高效分解酒糟菌种筛选
将纯化得到的单菌落转接到酒糟培养基,分别在28、37 ℃下培养48 h。挑选长势好的单菌落点接到选择培养基,分别在28、37 ℃下恒温培养48 h。
1.4 刚果红筛选
1.4.1 染色刚果红溶液
将100 mg刚果红溶解于100 mL水中,配制为1 g/L的染色刚果红溶液;将100 mg NaCl溶于100 mL水中为1 g/L NaCl溶液,作为脱色液。选取生长旺盛、菌落形态差异明显的单菌落,倒入适量刚果红溶液染色8~10 min,倒去刚果红溶液,加入NaCl溶液脱色12~15 min,选取D/d值大的进行下一步实验。
1.4.2 刚果红培养基复筛
将染色水解圈大的菌株接种到50 mL发酵培养基中,分别在28、37 ℃,150 r/min下培养24 h。CMC-Na刚果红双层培养基(上层刚果红培养基[1],琼脂:15 g/L、下层CMC-Na筛选培养基,琼脂:7.5 g/L),在上层培养基上均匀打3个孔,每个孔加入60 μL菌液,分别在28和37 ℃下培养48 h,观察并记录水解圈和菌圈比值(D/d)。
1.5 纤维素酶活测定
用DNS法测定CMC酶活[12],分别在28、37 ℃,150 r/min条件下发酵培养48 h,吸取2 mL菌液,12 000 r/min离心5 min,取上清液,即为粗酶液。取0.5 mL粗酶液,加入1.5 mL 1% CMC缓冲液,50 ℃水浴30 min,加入3 mL DNS溶液,沸水浴10 min,迅速冷却后定容至10 mL。对照组加0.5 mL灭活的酶液代替粗酶液,其他条件不变,540 nm波长下测定OD值。(CMC酶活单位定义:将每分钟由羧甲基纤维素钠水解成1.0 μg葡萄糖所需的酶量定义为一个酶活力单位U,即IU/mL)。
1.6 滤纸崩解实验[13]
取10 mL发酵培养后的菌液于三角瓶中,每个三角瓶放入2条1 cm×5 cm的滤纸条,分别在28、37 ℃,150 r/min下培养,与空白组对照,观察滤纸崩解情况。
1.7 菌株酒糟降解
取50 g烘干恒重的酒糟,按5%的接种量加入活化好的菌液,置于室温下,每3 d测量剩余酒糟的干重,计算酒糟的降解率。
1.8 菌株鉴定
1.8.1 形态学鉴定
观察菌落形态特征,进行革兰氏染色[14],在400倍光学显微镜下观察微生物形态。
1.8.2 生理生化鉴定
参考《伯杰氏细菌鉴定手册》对筛选出的菌株进行V-P实验、糖发酵实验、甲基红实验、过氧化氢酶产生和产吲哚实验等细菌学特性实验。
1.8.3 分子鉴定
用细菌基因组DNA提取试剂盒,提取菌株DNA[15],进行16S rDNA测序,获得的测序结果用NCBI Blast数据库对比分析相似度。
1.9 不同发酵条件对酶活的影响
分别以不同物质为唯一碳源和氮源[16],在不同碳源实验中,将筛选培养基中的羧甲基纤维素钠用不同碳源代替其余成分不变;在不同氮源实验中,筛选培养基中的(NO4)2SO4用不同氮源代替其余成分不变。控制不同培养温度和不同初始pH培养48 h、培养不同时间,采用DNS法测定CMC酶活。
2 结果与分析
2.1 降解纤维素菌株的分离筛选
由于细菌和嗜温菌的最适温度在28、37 ℃左右,在酒糟发酵腐熟过程中,中温阶段温度控制为25~40 ℃,分解纤维素的微生物群落最活跃[17]。本实验分别在28、37 ℃条件下,从酒醅和窖泥中分离、筛选、纯化得到9株产纤维素酶菌株,其菌落形态特征如表1所示。

表1 菌株菌落形态特征Table 1 Morphological characteristics of strains
注:N、P为以窖泥和酒醅为样品在28℃筛出的菌株,N′、P′是在37℃筛出的菌株。下同。
初筛第2天培养基上开始形成单菌落,生长2 d后能观察到明显的单菌落,说明菌株能产纤维素酶分解利用羧甲基纤维素钠。观察菌落的形态特征,菌株P4、P7、P9、P10和P11的单菌落形态特征基本相同。菌落表面粗糙、不规则、有褶皱,边缘与中央颜色为污白色,有臭味;菌株N4、N′1和P′16的菌落形态大体相同,表面光滑、湿润、黏稠、不透明,为微黄色,有较淡的臭味;菌株N′14和N′15的菌落呈乳白色,表面光滑、黏稠、无臭味。初步判断9株菌为细菌。
2.2 刚果红水解圈
由于刚果红可以与纤维素形成红色复合物,当纤维素被纤维素酶分解后刚果红—纤维素复合物无法形成,培养基中会形成以菌落为中心的水解圈。以形成的水解圈大小初步筛选菌株分解纤维素的能力。将初筛得到的菌株进行刚果红染色,并用刚果红培养基复筛,初筛得到的9株菌都能产生水解圈,水解圈直径与菌落直径比(D/d)如表2所示。

表2 刚果红水解圈Table 2 Congo red hydrolysis cycle
由表2可知,菌株P7和P′16形成水解圈明显大于其他菌株,D/d值分别达到了23和20,说明菌株P7和P′16降解纤维素能力较强,能将培养基中纤维素分解成糖,刚果红不能与之成色;菌株P5虽然水解圈直径有17 mm,但自身菌落直也径较大,其D/d值只有8.5,不能直接说明P5菌株有较强的降解纤维素能力。
2.3 CMC酶活
按照IUPCA推荐的国际标准方法,用DNS法测定纤维素酶活。查阅葡萄糖标准曲线计算含糖量(图1),根据酶活计算公式H=D·V1·C/T·V2计算菌株纤维素酶活[19],纤维素酶活以U即IU/mL表示,采用DNS法测定菌株的CMC酶活测定,其结果见图2。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
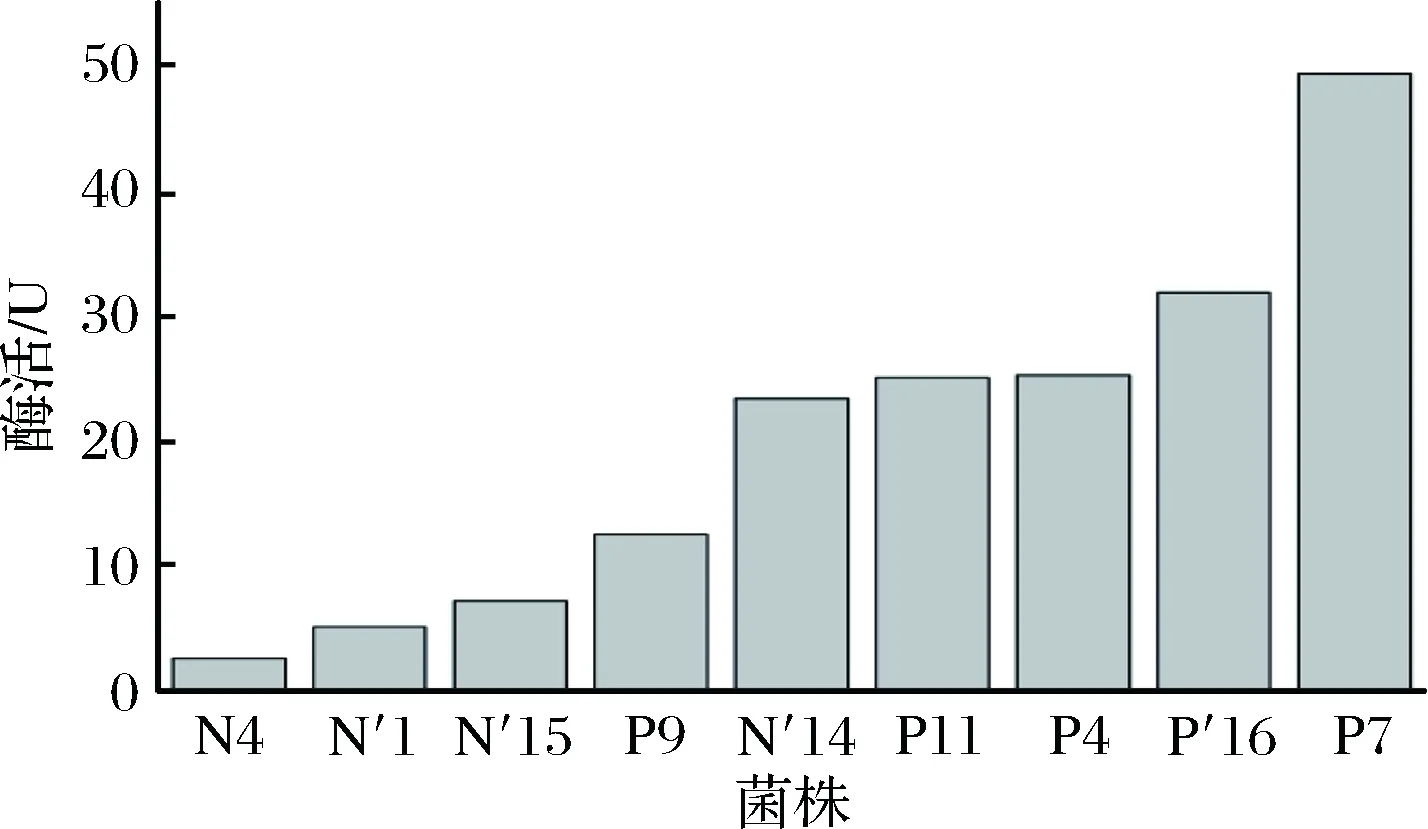
图2 CMC酶活Fig.2 CMC enzyme activity
由图2可知,在室温下菌株之间CMC酶活差距较大,仅有4株菌酶活超过20 U,酶活超过30 U的仅有P7和P′16两株菌。相比于其他菌株,菌株P7和P′16酶活较高,分别为49.31 和31.81 U。虽然部分菌株经刚果红染色中有较大透明圈,但在酶活测定中并未表现出较强的酶活,说明刚果红染色水解圈大的不一定酶活就高。
2.4 滤纸条崩解
滤纸条中含有大量的纤维素,菌株降解滤纸条的快慢能较直接地表现出菌株降解纤维素的能力。通过在滤纸条中加入菌液,观察滤纸条崩解情况,根据降解所需时间,筛选降解纤维素能力强的菌株,结如见图3所示。

图3 滤纸条崩解所用时间Fig.3 Time taken for the filter paper to disintegrate
在反应开始前2 d滤纸条降解不明显,仍然呈完整条状,到第3天滤纸条开始慢慢崩解,成絮状堆积。由图3可知,滤纸条在4 d和5 d后被菌株P7和P′16完全崩解,所用时间短于其他7株菌。其他菌株降解相同滤纸条所用时间更长,降解纤维素能力弱于上述两株菌。
2.5 酒糟降解实验
将酒糟作为底物培养微生物,并测量酒糟的降解率能最直接地表现出微生物降解酒糟中纤维素的能力。将菌液按5%的接种量加入到酒糟,每3 d测量酒糟的降解率,结果如图4所示。

图4 各菌株对酒糟的降解作用Fig.4 Degradation of distiller's grains by various strains
由图4可知,发酵前15 d加入菌株P7、P11、N′15和P′16的酒糟降解速率较快,酒糟由土黄色逐渐变为黑色,在发酵15 d后降解速率下降,酒糟颜色不再变化,24 d后降解率保持稳定,反应停止后酒糟中部分纤维素和其他物质被分解,呈黑色。虽然N′15前9 d的降解速率较快,但在18 d后酒糟基本不再降解,最终降解率仅有9.27%,低于菌株P7和P′16。9株菌对酒糟的降解率相差较大,有4株菌的降解率未达到10%,仅有菌株P7的降解率达到了22.1%,菌株P′16降解率为18.4%。说明菌株P7和P′16降解酒糟中纤维素的能力较强。
2.6 发酵条件对酶活的影响
将筛选出的9株菌株与里氏木霉分别在不同的发酵条件下进行培养,采用DNS法测菌株CMC酶活,对比分析。
2.6.1 不同碳源对酶活的影响
以羧甲基纤维素钠、无水葡萄糖、酒糟、蔗糖和糖蜜为唯一碳源,分别在28、37 ℃条件下培养48 h,用DNS法测定CMC酶活,结果如图5所示。

图5 不同碳源对酶活的影响Fig.5 Effect of different carbon sources on enzyme activity
在培养过程中,菌株P7和P′16长势较好,快于其他菌株形成明显的单菌落。由图5可知,菌株P7在不同碳源中的酶活均高于其他菌株,分别为49.31、38.46、42.83和44.61 U。蔗糖和糖蜜成分较复杂不利于微生物直接利用,导致菌株在蔗糖和糖蜜为碳源时酶活表现不够好。由于酒糟呈酸性对菌株生长影响较大,形成的单菌落形态略小,因此在酒糟中各菌株的酶活都明显降低。结果表明,以酒糟为碳源时,菌株P7的酶活高于里氏木霉,为38.46 U,说明菌株P7适用于降解酒糟中的纤维素;菌株P′16在各个碳源下的酶活变化不大,说明其对不同碳源的利用都较好,在不同方面应用都适用。
2.6.2 不同氮源对酶活的影响
以酒糟粉、酵母浸粉、(NH4)2SO4、牛肉膏和蛋白胨为唯一氮源,分别在28和37 ℃条件下培养48 h,用DNS法测定CMC酶活,结果如图6所示。

图6 不同氮源对酶活的影响Fig.6 Effect of different nitrogen sources on enzyme activities
由图6可知,以(NH4)2SO4为氮源时,其铵态氮能被微生物快速吸收,9株菌的长势最好,酶活高于其他氮源,其中菌株P7酶活最高,为49.31 U,因此在培养时(NH4)2SO4适合作为氮源。以酒糟粉作为氮源培养时,由于其较强的酸性,影响各菌种的繁殖代谢,因此各菌株的酶活都不高,仅有菌株P7的酶活有38.46 U,表明菌株P7降解酒糟中纤维素的高效性。结合图5和图6,菌株P′16在以酒糟浸出液为唯一碳源培养的酶活高于以酒糟浸出液为唯一氮源培养的酶活,说明在培养菌株P′16时酒糟更适合作为碳源。
2.6.3 培养温度对酶活的影响
结合酒糟堆肥腐熟时纤维素降解菌的作用时期和细菌生长的所适温度,为筛选出适合应用于堆肥不同阶段的菌株,本实验设置28、32、36、40和44 ℃培养条件,发酵培养基培养48 h,用DNS法测定CMC酶活,结果如图7所示。

图7 不同温度对酶活的影响Fig.7 Effect of different temperatures on enzyme activity
由图7可知,温度在28~36℃时,除菌株N′14和P′16外其他菌株长势较好,生长速度较快,酶活达到最大值,符合细菌的最适温度范围。培养温度在32 ℃时,菌株P7酶活接近于对照菌里氏木霉酶活,为51.12 U。说明菌株P7和里氏木霉适用在酒糟发酵腐熟的中温阶段。由于高温对微生物的生长影响较大,因此随着培养温度的变化菌株的酶活也在变化。实验结果表明,随着温度升高,7株菌的酶活降低,培养温度超过44 ℃后,仅有菌株P′16的酶活有26.53 U,高于其余菌株,说明菌株P′16适用在堆肥腐熟的中高温阶段。
2.6.4 不同培养时间对酶活的影响
采用DNS法,测定发酵培养48、72、96、120和144 h时菌株的CMC酶活,筛选最短时间达到高酶活的菌株,结果见图8。

图8 不同培养时间对酶活的影响Fig.8 Effect of different culture time on enzyme activity
在培养24 h,发酵培养基中未长出较明显的微生物;培养48 h后,发酵培养基开始浑浊有明显的微生物,因此培养48 h后开始测定酶活。由图8可知,在48 h时,研究对象上述9株菌的酶活达到最高,其中菌株P7酶活最高,为49.31 U;对照菌里氏木霉在培养48~72 h时,酶活才达到最大值,时间长于筛选出的菌株,筛选出的菌株快于里氏木霉达到最大酶活。培养超过48 h后,培养液出现浑浊沉淀,由于菌种开始出现老化现象,因此酶活降低,说明最适培养时间在48 h左右。
2.6.5 不同初始pH对酶活的影响
酒糟pH值在4.0左右,呈较强的酸性,为筛选高耐酸性的产纤维素酶菌株,本实验设置初始pH 7.0、6.0、5.0、4.0和3.0,分别菌株对应的温度28、37 ℃条件下发酵培养48 h,用DNS法测定CMC酶活,结果如图9所示。

图9 不同初始pH对酶活的影响Fig.9 Effect of different initial pH on enzyme activity
实验中初始pH越低培养基上的单菌落越小,由图9可知,初始pH 5.0时,菌株P7的酶活高于里氏木霉,为38.46 U;初始pH 4.0时,菌株P7和P′16的酶活高于里氏木霉,分别为28.46、24.55 U。由于酸性环境对菌株的生长代谢有抑制作用,随着pH下降菌株的长势变弱,因此菌株酶活随之下降。当初始pH低于3.0时,在强酸环境下菌株基本失活,酶活几乎为0。实验表明菌株P7和P′16耐酸性较强,适合投用到酒糟发酵腐熟中。
通过不同发酵条件对酶活影响的研究,以酒糟为氮源和碳源时菌株P7的CMC酶活为38.46 U;菌株P7和P′16培养时间较短,在培养48 h左右既能达到最高酶活49.31和31.81 U;在温度32 ℃下,菌株P7酶活为51.12 U,较适合用在中温阶段;在温度40 ℃下,菌株P′16酶活为31.81 U,适合用于中高温阶段;菌株P7和P′16耐酸性较好,初始pH 4.0时酶活为28.46和24.55 U。综上所述菌株P7和P′16适合投用到酒糟的腐熟发酵。
2.7 菌株的鉴定
2.7.1 革兰氏染色结果
将分离纯化得到的9株降解酒糟中纤维素的菌株,进行革兰氏染色鉴定,结果如表3所示。
革兰氏染色制片过程要注意控制每个步骤的时间,染色后能明显观察到颜色变化,由表3可知,菌株P4、P7、P9、P10、P11、N′14、N′15和P′16细胞壁较薄,乙醇脱色后呈红色,为革兰氏阴性菌;经染色P9和N′14呈紫色,为革兰氏阳性菌。染色后,在染色部分滴一滴香柏油在400倍光学显微镜下观察细菌形态,菌株P7与芽孢杆菌形态相似呈杆状,初步判断为芽孢杆菌。
2.7.2 生理生化鉴定结果
将得到菌株P7和P′16进行生理生化鉴定,然后根据《伯杰氏细菌鉴定手册》中的表述初步判断菌株P7和P′16的分类地位。生理生化鉴定结果如表4所示。

表3 革兰氏染色结果Table 3 Gram stain results

表4 理化鉴定结果Table 4 Physical and chemical identification results
注:“+”表示有该特征或能利用该物质,“-”表示无该特征或不可利用该物质。
对菌株P7和P′16进行生理生化实验,通过结果表6与《伯杰氏细菌鉴定手册》可以得到两菌株各项理化指标与芽孢杆菌属相似,初步认为2株菌为芽孢杆菌属。
2.7.3 16S rDNA相似性比较
将得到的菌株P7和P′16的16S rDNA序列在NCBI Blast中进行对比分析[20],用MEGA7.0软件中的Neighbor-Joining方法构建菌株P7和P′16基因系统进化树,见图10、图11。

图10 P7菌株16S rDNA系统进化树Fig.10 16S rDNA phylogenetic tree of P7 strain

图11 P′16菌株16S rDNA系统进化树Fig.11 16S rDNA phylogenetic tree of P′16 strain
由图10和图11可知,通过对比并结合生理生化实验结果,确定P7菌与贝莱斯芽孢杆菌(Bacillusvelezensis)16S rDNA序列相似度达到100%;P′16菌与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)16S rDNA序列相似度达到100%。因此,菌株P7初步鉴定为贝莱斯芽孢杆菌;P′16初步鉴定为解淀粉芽孢杆菌。
3 结论
酒糟在堆肥发酵是产生较高温度,对多数微生物降解纤维素能力有不利影响。本研究在28 ℃条件下从酒醅和窖泥中筛选出5株具有降解酒糟能力的菌株,在37 ℃条件下筛选出4株具有降解酒糟能力的菌株。用这9株菌与对照菌株进行发酵条件的研究,得到2株适合用于酒糟发酵腐熟的菌株—P7和P′16。对P7和P′16进行的研究表明,该菌在酒糟中酶活高、对酸性环境和温度耐受性好,在酒糟中酶活分别为38.56和38.55 U,且降解酒糟中纤维素能力强,对酒糟的降解率分别为22.1%和18.1%。经过16S rNDA相似性对比结合生理生化实验,初步确定菌株P7为贝莱斯芽孢杆菌(Bacillusvelezensis);P′16为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。
在酒糟中加入产纤维素酶的菌株可高效、快速的降解酒糟中的粗纤维,释放出酒糟的各种营养物质,有利于发酵,提高酒糟中有机质的利用率,改善酒糟生物有机肥的营养价值。在今后的研究中可以对P7和P′16和其他微生物之间的协同作用,进一步构建高效、安全降解酒糟的复合菌剂。

