马兜铃酸对斑马鱼的耳毒性及肾毒性研究*
谌晶晶 唐旭霞 徐慧芳 石涯
马兜铃酸(aristolochic acid, AA)为硝基菲类有机酸,其具有广泛的药理作用,如:抗癌、抗感染、增强细胞免疫。含马兜铃酸的中草药达数十余种,如:关木通、天仙藤、广防己、青木香、细辛等,目前,收载于中国药典、部颁标准以及地方药材标准的马兜铃科中药材有24种、含马兜铃属中药材的中成药口服制剂有47种[1]。但是,马兜铃酸具有明确的肾毒性,并且,有学者发现马兜铃酸可能是诱发肝癌的重要因素[2],因此,很多国家对含马兜铃酸药物的使用都有严格的规定。我国药物监督行政部门对含马兜铃酸的中药材也实施了严格管制[3]。很多具有肾毒性的药物,同时也有耳毒性,如:氨基糖苷类抗生素、顺铂类抗肿瘤药物、中草药雷公藤[4]等。马兜铃酸具有明确的肾毒性,但其有无耳毒性未见临床报道,也尚无该方面的研究。斑马鱼具有与哺乳动物相似的内耳结构,身体透明,繁殖周期短,这些特征使斑马鱼成为高通量进行药物耳毒性及听细胞保护剂研究的理想模型。故本研究利用斑马鱼来观察马兜铃酸的肾毒性,并对马兜铃酸的耳毒性进行初探。
1 材料与方法
1.1实验动物 斑马鱼胚胎的繁殖以自然成对交配的方式进行。每次交配准备4~5对成年斑马鱼,平均每对能产200~300个胚胎。在受精后6小时(即6 hpf)和24 hpf对胚胎进行清理(移除已死亡胚胎),并根据胚胎的发育阶段挑选合适的胚胎。在28 ℃条件下用养鱼用水孵育胚胎(养鱼用水水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为480~510 μs/cm;pH为6.9~7.2;硬度为53.7~71.6 mg/L CaCO3)。以受精后5天(5 dpf)的斑马鱼为研究对象[因为胚胎可以从自身的卵黄囊中获取营养物质,所以在受精后9天内(9 dpf)不需要喂食]。
1.2实验用药、仪器与试剂 马兜铃酸(阿拉丁,批号67451):用1.0%的二甲基亚砜(DMSO)配制成浓度为6.8 mg/ml的储备液,-20 ℃保存;庆大霉素(阿拉丁,批号39970)用超纯水配制成25 mg/ml的储备液,-20 ℃保存),荧光立体显微镜(Nikon AZ 100, Japan);6孔板(Nest Biotech);二甲基亚砜(DMSO,阿拉丁,批号1095515); DASPEI染料(sigma,批号109k1336)。
1.3实验方法
1.3.1确定马兜铃酸的最大非致死浓度(maximum non-lethal concentration,MNLC) 马兜铃酸的初始检测浓度设计为6.8、3.4、1.7、0.85、0.425 μg/ml。分别用上述不同浓度的马兜铃酸处理15尾5 dpf的斑马鱼,24 h后,统计不同浓度下斑马鱼的死亡数量,使用Graphpad prism 6.0统计学软件绘制最佳的浓度效应曲线,计算出马兜铃酸的MNLC。
1.3.2评价马兜铃酸的毛细胞毒性 根据MNLC,选取4个浓度(MNLC、1/2 MNLC、1/4 MNLC、1/8MNLC)的马兜铃酸,每个浓度处理30尾5 dpf的斑马鱼,分别命名为MNLC组、1/2 MNLC组、1/4 MNLC组、1/8MNLC组,所有实验组均含有相同浓度的溶剂。阳性对照组(庆大霉素组):用2.5 μg/ml的庆大霉素饲养30尾5 dpf斑马鱼;阴性对照组(溶剂组):用1.0%DMSO饲养30尾5 dpf斑马鱼 。
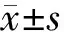
1.4统计学方法 马兜铃酸对斑马鱼的毛细胞损伤率计算公式如下:
×100%
根据毛细胞损伤率绘制剂量效应曲线;采用方差分析和Dunnett’s T-检验,P<0.05为差异具有统计学意义。
2 结果
2.1马兜铃酸的MNLC 不同浓度马兜铃酸组斑马鱼的死亡率见表1。根据表1中的数据,用GraphPad 6.0拟合浓度致死曲线,未能得到MNLC拟合结果,故本研究取未出现斑马鱼死亡的最大浓度(3.4 μg/ml)为MNLC。
2.2马兜铃酸的毛细胞毒性 活体斑马鱼染色后,毛细胞与染料结合后,发绿色荧光;可见,斑马鱼的毛细胞分布在侧线神经丘及头部,如图1中红色标记所示。拍照后,用图像处理软件分析图1中各组斑马鱼红色部分毛细胞荧光强度,再进行统计分析,结果显示:庆大霉素组(阳性对照组)毛细胞损伤率为88.5%,与阴性对照组比较,差异具有统计学意义(P<0.01)。马兜铃酸0.425、0.85、1.7、3.4 μg/ml各组(即1/8MNLC、1/4MNLC、1/2MNLC及MNLC组)毛细胞损伤率分别为12.4%、-0.4%、6.9%、-7.2%,与阴性对照组比较,差异均无统计学意义(表2)。
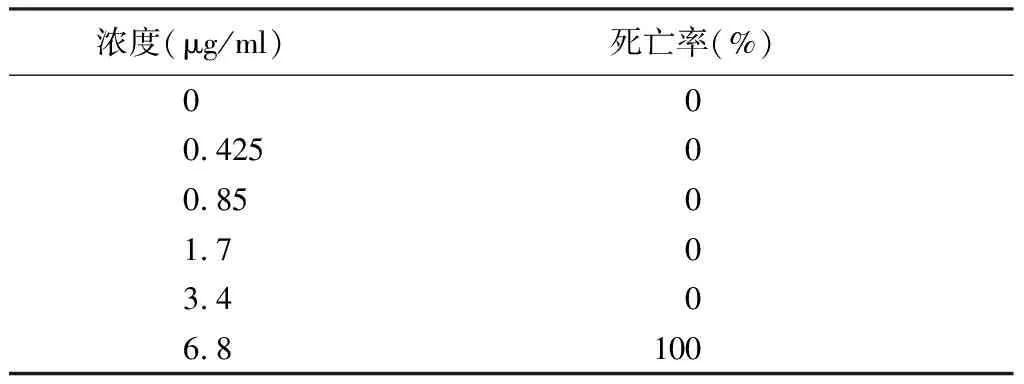
表1 不同浓度马兜铃酸诱发的斑马鱼死亡率(n=15)
表2 各组相对荧光强度及毛细胞的损伤率
注:与阴性对照组比较, *:P<0.01
2.3马兜铃酸对斑马鱼的肾毒性 各组剩余20尾斑马鱼饲养72 h后,马兜铃酸0.425、0.85 μg/ml组斑马鱼均无死亡,1.7 μg/ml组死亡率为10%,3.4 μg/ml组全部死亡。马兜铃酸1.7 μg/ml组中观察到11.1%的斑马鱼出现严重的肾包膜水肿(图2)。阳性对照组、阴性对照组及马兜铃酸0.425、0.85 μg/ml组均未观察到明显的肾包膜水肿现象。
3 讨论
斑马鱼属于低等脊椎动物,其生长周期短,产卵量大,胚胎体外发育且透明。斑马鱼虽然没有外耳和中耳,但有典型的内耳结构,同时,其身体侧线上用来感知周围水流方向和变化的毛细胞在结构和功能上也与哺乳动物内耳毛细胞非常相似[5,6]。利用其胚胎透明的特点,可以在显微镜下直接观察给药前后内耳形态的变化和身体侧线上的毛细胞,便于进行活体染色和观察。2005年,Ton等[7]首次用斑马鱼模型来评估药物耳毒性;2008年,Chiu等[6]使用斑马鱼模型筛查了FDA批准使用的1 040种药物,发现21种药物具有斑马鱼耳毒性,其中2种药物的耳毒性作用进一步在大鼠实验中得到确认[6],证明了斑马鱼在研究药物耳毒性方面的价值。
3.1马兜铃酸的肾毒性 本研究所用马兜铃酸浓度虽然未能得出其最大非致死浓度,但在6.8 μg/ml的浓度下处理24 h,斑马鱼均死亡,明确了马兜铃酸对斑马鱼的毒性作用。本研究观察到马兜铃酸1.7 μg/ml组中11%的斑马鱼出现了严重的肾包膜水肿,推测其死亡可能是因严重的肾毒性造成。Ding等[8]用马兜铃酸处理发育早期的斑马鱼,发现斑马鱼水肿以及肾脏形态功能异常,并最终导致斑马鱼死亡。肾脏是脊椎动物最主要的排泄器官,马兜铃酸是大分子物质,与血浆白蛋白结合后不能经肾小球滤过,其部分代谢产物主要经由肾小管分泌、排泄,这一过程主要依赖于近端肾小管上皮细胞的转运功能,因此,马兜铃酸诱发的肾损伤主要发生在近端肾小管[1]。内质网应激反应、氧化应激、DNA损伤、免疫炎症机制、凋亡机制等都与马兜铃酸引起的肾脏损伤有关[1]。
3.2马兜铃酸的耳毒性 耳蜗中阶外侧壁上血管纹的血-迷路屏障能在一定程度上保护内耳不接触来自血液中的有害物质。有研究显示耳毒性药物可能是通过血-迷路屏障从血液进入到内耳的液体循环[9]。目前并无马兜铃酸导致听力损伤的临床病例报道,推测马兜铃酸可能因分子较大而无法通过人体的血-迷路屏障。但斑马鱼身体侧线毛细胞无该屏障的保护作用,并且实验中马兜铃酸的给药方式是直接稀释到溶剂DMSO中来饲养斑马鱼,马兜铃酸可以通过斑马鱼肠道和皮肤吸收进入体内,尽管如此,马兜铃酸仍然未对斑马鱼侧线神经丘毛细胞造成损伤。推测可能与马兜铃酸的分子结构相关:马兜铃酸是硝基菲类有机酸,马兜铃酸及其衍生物的生理活性和毒性作用与分子结构中的羟基、甲氧基和硝基的位置和数量相关[10],分子结构的差异可能是马兜铃酸无耳毒性的原因。本实验中未观察到马兜铃酸的耳毒性,基于斑马鱼的给药方式及其缺乏血-迷路屏障的保护作用,有理由认为到达斑马鱼毛细胞的药物浓度高于到达人内耳的药物浓度,因此推测不导致斑马鱼死亡的药物浓度对人内耳是相对安全的。但在血-迷路屏障受到损害,如内耳缺血缺氧,或者药物浓度进一步增加的情况下,是否会造成人内耳损伤,尚不能给出结论。而更高浓度的马兜铃酸会导致斑马鱼死亡,因而也无法通过斑马鱼模型来进一步研究马兜铃酸对内耳毛细胞的毒性作用。
本研究的不足之处在于:①马兜铃酸浓度的选择欠佳,无法通过所选药物浓度判断马兜铃酸对斑马鱼的毒性作用是否存在剂量依赖关系;②仅依靠免疫荧光强度来判断马兜铃酸是否存在耳毒性,而未观察毛细胞的形态是否有轻微异常改变。在今后的实验中,将再设计实验药物浓度,进一步通过透射电镜观察斑马鱼毛细胞的形态,甚至斑马鱼的行为改变,以期更全面地认识马兜铃酸对斑马鱼毛细胞的影响。
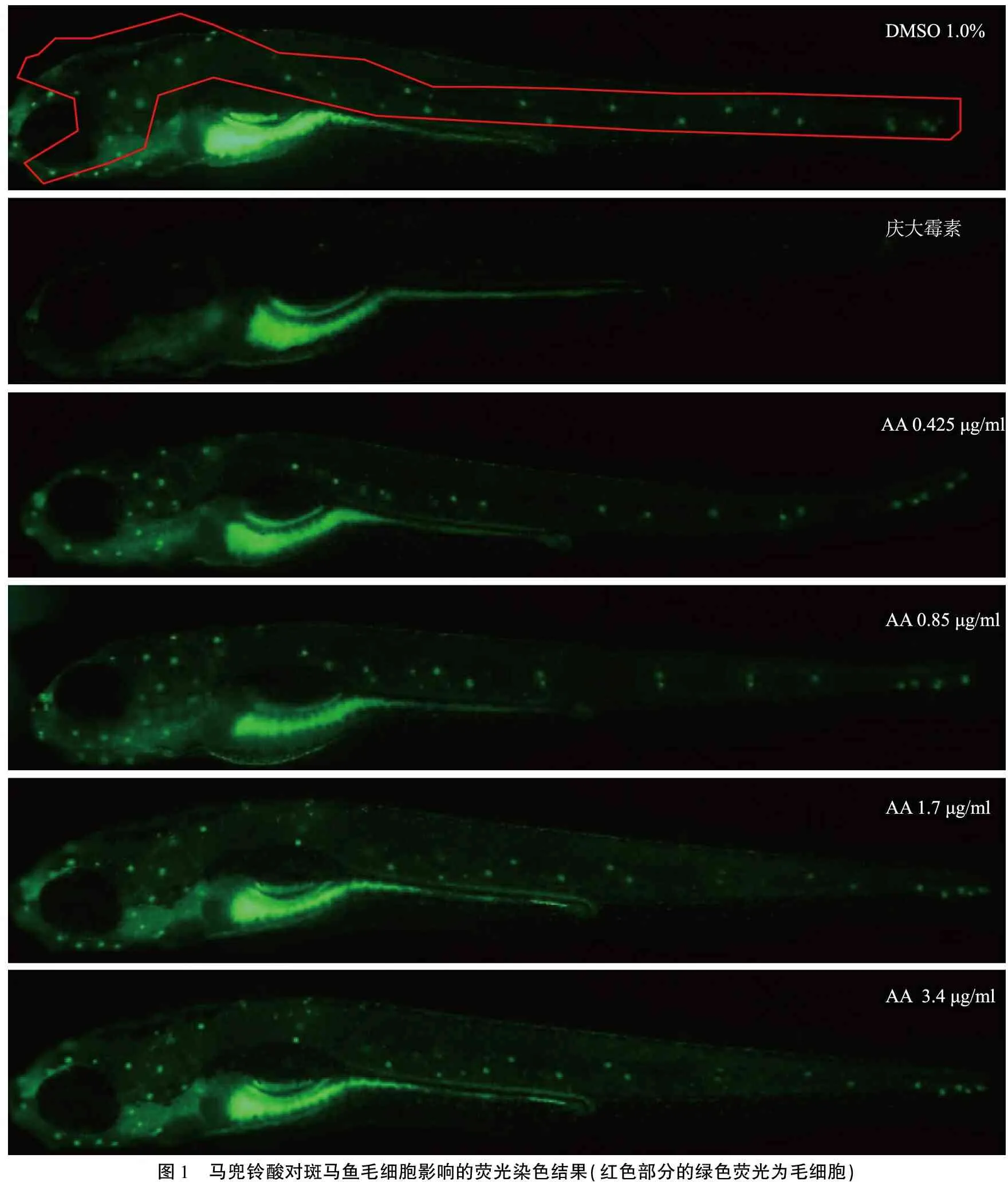
图1 马兜铃酸对斑马鱼毛细胞影响的荧光染色结果(红色部分的绿色荧光为毛细胞)
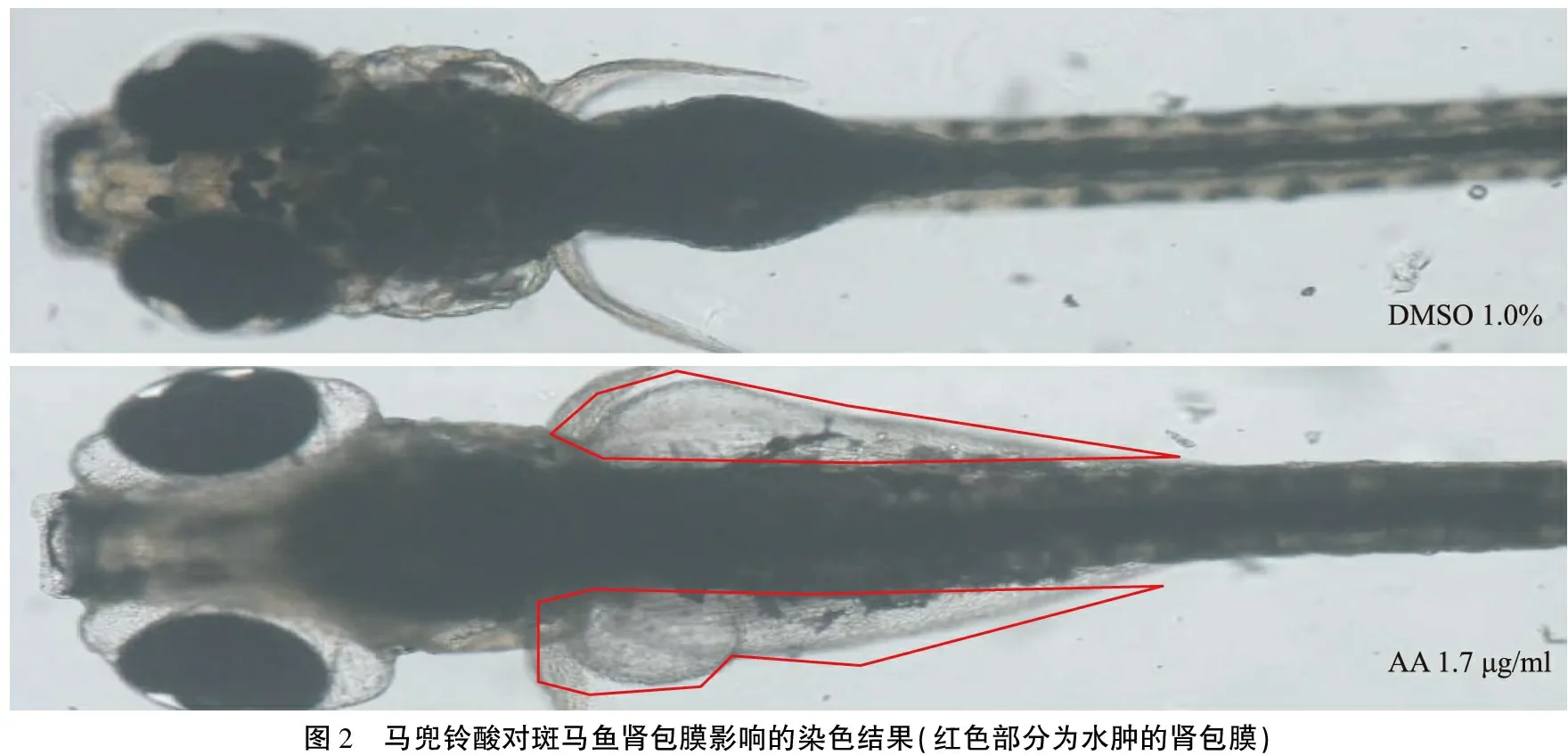
图2 马兜铃酸对斑马鱼肾包膜影响的染色结果(红色部分为水肿的肾包膜)

