7种胺基键合硅胶的制备及其对重金属Pb2+的吸附
李来明, 任芳芳, ASSEFA Aschenaki, 刘 佳, 张筱菲, 包建民, 李优鑫
(天津市现代药物传递及功能高效化重点实验室, 天津化学化工协同创新中心, 天津大学药物科学与技术学院, 天津 300072)
重金属持久存在于水及土壤中,很难降解,会随着生态循环蓄积到植物、动物甚至人体内,从而引起人类中毒,危害健康。为降低此危害,把好重金属污染的第一道关至关重要,即需要及时有效地处理含重金属的废水。材料吸附是去除重金属的一种有效途径,与其他吸附剂相比,功能化硅胶既可以通过配位作用有效吸附重金属离子,又兼具易分离、可重复使用和稳定性强的特性,在环境科学中已成为最具潜力、被广泛应用的重金属吸附剂。但随着硅胶上功能化基团的变化,其吸附重金属种类和能力均有所不同,因此随着每一种功能化硅胶吸附剂的开发,探索其在不同重金属吸附中的性能必不可少[1,2]。氮元素能与某些重金属离子配位而具有较高的吸附性能,氮配体的功能基团多种多样,近年来,以氮配体为功能基团的分离富集材料得到了广泛研究。如Kiado等[3]报道的氨基、酰胺和苯甲酰胺共价键合硅胶可用于铀的高效选择性富集。Aguado等[4]制备的氨丙基、乙二胺丙基、二乙烯三胺基丙基功能化介孔硅胶SBA-15材料可有效用于污水中重金属Cu2+等离子的吸附,且Cu2+的吸附符合准二级动力学模型(pseudo-second-order)。Zhang等[5]制备的4种具有不同结构的二亚乙基三胺硅胶吸附剂,在静态吸附条件下对Hg(II)具有较好的吸附性能。Benhamou等[6]采用胺基功能化MCM-41和MCM-48去除铬酸和砷酸盐。同时胺基键合硅胶由于胺基的影响,其碱性较大,反应活性较高,随着胺基的增加,其碱性逐渐增加,产品的饶曲强度也相应增加[7-10]。
铅(Pb)是一种常见的有毒重金属,常出现于机械、金属、电池、电镀、涂料、油漆等工业产生的废水中[11],随着废水的排放,极易富集于各种生物组织中,进而通过皮肤、消化道和呼吸道被人体吸收,并与多种器官产生不良反应。如人体铅含量超过0.1 mg/L,便容易引起贫血,损害神经系统[12]。为解决水污染中重金属铅含量超标的问题,目前研究者们对其进行了大量研究,如Balela等[13]采用天然疏水木棉纤维改性聚丙烯腈(PAN)从水溶液中吸附Pb2+离子,将木棉-PAN纳米复合材料浸泡在氢氧化钠溶液中水解,可以显著提高其对Pb2+的吸附量(78.34 mg/g)。目前去除铅离子的主要方法为吸附法,一般采用具有较大比表面积或者具有特殊功能基团的吸附材料[14-16],但这些材料制备步骤繁琐,制备成本和条件均较高,因此亟待一种价廉且实用的材料。
本文采用非均相氨化法经过一步反应制备了氨丙基键合硅胶(单胺,SiO2-N)和乙二胺-N-丙基键合硅胶(二胺,SiO2-2N),两步反应制备了二乙烯三胺基键合硅胶(三胺,SiO2-3N)、三乙烯四胺基键合硅胶(四胺,SiO2-4N)、四乙烯五胺基键合硅胶(五胺,SiO2-5N)、五乙烯六胺基键合硅胶(六胺,SiO2-6N)和聚乙烯亚胺基键合硅胶(聚胺,SiO2-nN),本文还系统研究了这7种键合硅胶对Pb2+的吸附性能。
1 实验部分
1.1 仪器、试剂与材料
TENSOR 27红外光谱仪(德国Bruker公司), U-3900紫外-分光光度计(日本Hitachi公司), S2800场发射扫描电子显微镜(SEM,日本Hitachi公司), ISRF-550i X-射线能谱仪(EDS,美国IXRF公司), D/MAX-2500 X射线衍射仪(XRD,日本理学公司), Vario Micro cube元素分析仪(德国Elementar公司)。
硅胶(200~300目)购自山东省烟台市信诺化工有限公司;3-氯丙基三乙氧基硅烷(CPTES,纯度≥99%)、3-氨丙基三甲氧基硅烷(APTES,纯度≥99%)、乙二胺-N-丙基三甲氧基硅烷(纯度≥99%)购自南京优普化工有限公司;二乙烯三胺(DETA,纯度≥99%)购自萨恩化学技术(上海)有限公司;三乙烯四胺(TETA,纯度≥95.9%)、四乙烯五胺(TEPA,纯度≥95%)和五乙烯六胺(PEHA,纯度≥95%)购自天津希恩思生化科技有限公司;高分子量聚乙烯亚胺(PEI,批号:QL-1001-C-3,纯度35%±2%)购自武汉市强龙化工新材料有限责任公司;其余化合物均为国产。
1.2 氨基硅胶的合成
1.2.1氯丙基键合硅胶(SiO2-CP)的合成
将300 g SiO2置于1 000 mL 6 mol/L的盐酸中,于60 ℃机械搅拌6 h,待反应结束后,用蒸馏水多次洗涤至中性,置于鼓风干燥箱中干燥,得酸化硅胶。取酸化硅胶,于130 ℃真空干燥箱中活化3 h,得到活化硅胶。
称取30 g活化硅胶,置于250 mL四口圆底烧瓶中,加入100 mL重蒸甲苯、35 mL CPTES,机械搅拌下回流反应24 h,待反应完成后,冷却过滤,依次采用30 mL甲苯、30 mL乙醇和30 mL乙醚洗涤,于60 ℃真空干燥6 h,最终获得产物。
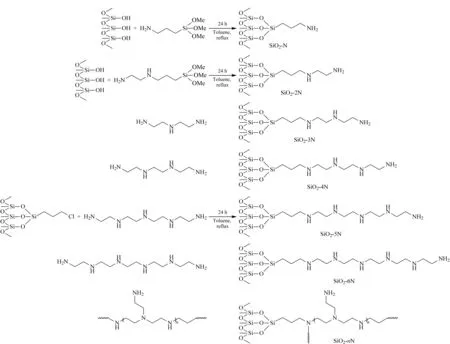
图 1 系列胺基键合硅胶的合成路线Fig. 1 Synthesis of a series of the amino bonded silica gel SiO2-N: aminopropyl bonded silica gel; SiO2-2N: ethylenediamine-N-propyl bonded silica gel; SiO2-3N: diethylenetriamine bonded silica gel; SiO2-4N: triethlenetetramine bonded silica gel; SiO2-5N: tetraethylenepentamine bonded silica gel; SiO2-6N: pentaethylenehexamide bonded silica gel; SiO2-nN: polyethyleneimine bonded silica gel.
1.2.2系列胺基键合硅胶的合成
称取10 g活化硅胶,置于100 mL四口圆底烧瓶中,加入50 mL重蒸甲苯、12 mL APTES或12 mL乙二胺-N-丙基三甲氧基硅烷,机械搅拌下回流反应24 h,待反应完成,冷却过滤,依次采用30 mL甲苯、30 mL乙醇和30 mL乙醚洗涤,于60 ℃真空干燥6 h,最终分别获得氨丙基键合硅胶和乙二胺-N-丙基键合硅胶。
其余系列胺基键合硅胶的合成路线参考相关文献[17,18],并做适当修饰,具体步骤如下。
称取10 g干燥SiO2-CP,置于250 mL四口圆底烧瓶中,加入100 mL重蒸甲苯、1.3 mL 9.23 mol/L的DETA或1.96 mL 6.31 mol/L的三乙烯四胺或2.40 mL 5.01 mol/L的四乙烯五胺或3.09 mL 3.88 mol/L的五乙烯六胺或0.60 mL 0.02 mol/L的聚乙烯亚胺,机械搅拌下回流24 h,反应完成后,冷却过滤,依次采用30 mL水、30 mL乙醇和30 mL乙醚洗涤,于60 ℃真空干燥6 h,得对应的系列胺基键合硅胶。制备路线见图1。
1.3 系列胺基键合硅胶吸附Pb2+
1.3.1Pb2+含量检测方法
由于Pb2+可与二硫腙产生相互作用并引起510 nm处吸光度(A)的变化,本文采用二硫腙比色法测试溶液中Pb2+的质量浓度[19]。100 mL二硫腙使用液(70%透光率)所需二硫腙溶液的体积(V, mL)见公式1。
(1)
其中吸附率(q)通过公式2计算:
(2)
平衡时Pb2+的吸附量(qe, mg/g)采用公式3计算:
(3)
其吸附动力学,即不同时间(t)下Pb2+的吸附量(qt, mg/g)采用公式4计算:
(4)
其中,C0、Ct和Ce分别为初始、t时间和平衡时Pb2+的质量浓度,mg/L;m为吸附剂的质量,mg。
1.3.2Pb2+标准曲线的建立
精密称取1.598 8 g硝酸铅,置于250 mL烧杯中,加水溶解,转移至1 000 mL容量瓶中,加入1 mL硝酸使其不易水解,加水稀释定容,配制成1.0 g/L的Pb2+母液;量取一定量1.0 g/L Pb2+母液,加水稀释为不同浓度的Pb2+溶液。
分别移取5、15、25、35和50 μL的200 mg/L Pb2+标准溶液(相当1、3、5、7、10 μg Pb2+),置于60 mL分液漏斗中,加入10 mL pH=9硼酸-氯化钾缓冲液(作为水相),混匀,再加入5.0 mL含0.05 g二硫腙的三氯甲烷溶液(作为有机相),剧烈振摇1 min,静置分层后,Pb2+与二硫腙形成稳定的络合物被转移至三氯甲烷层,将其滤至1 cm石英比色皿中,以三氯甲烷作为参比,检测510 nm处的吸光度。
同样,用pH=9的硼酸-氯化钾缓冲液取代Pb2+标准溶液,经过二硫腙法处理后测定510 nm处吸光度值作为空白吸收值。用各个标准Pb2+溶液吸收值减去空白吸收值,以水相中Pb2+的含量为横坐标(x, μg), 510 nm处吸光度值为纵坐标(y),制作标准曲线。
1.3.3实际废水中Pb2+的检测
精密称取160 mg SiO2-2N 3份,至3个50 mL离心管中,分别加入20 mL含Pb2+的废水,于30 ℃摇床振荡10 h,以4 200 r/min离心5 min,取2 mL溶液,加入10 mL pH=9硼酸-氯化钾缓冲液,摇匀,加入5.0 mL含0.05 g二硫腙的三氯甲烷溶液,剧烈振摇1 min,静置分层后,三氯甲烷层滤入1 cm比色杯中,于510 nm处测定吸光度值。
2 结果与讨论
2.1 系列胺基键合硅胶的表征
2.1.1红外光谱
采用红外光谱表征所制备的系列胺基键合硅胶,结果见图2。由IR图谱可推断,硅胶在3 451 cm-1处出现了明显的吸收峰,推断为Si-OH中O-H的伸缩振动峰。经过胺基化修饰后,未在3 370 cm-1左右出现典型的N-H伸缩振动峰[20],可能被O-H的宽吸收峰所掩盖,但在2 954 cm-1与2 866 cm-1处出现了亚甲基-CH2-的伸缩振动吸收峰,1 563 cm-1处出现了伯胺N-H键的弯曲振动吸收峰,1 475 cm-1处出现了亚甲基-CH2-的弯曲振动吸收峰,710 cm-1与664 cm-1处出现了两组伯胺N-H的变形振动吸收峰,这些吸收峰的出现表明胺基功能化基团已被成功键合到硅胶表面,形成了不同的胺基键合硅胶。

图 2 系列胺基键合硅胶的红外光谱图Fig. 2 IR spectra of a series of the amino bonded silica gel
2.1.2扫描电镜与X射线能谱
采用扫描电镜研究SiO2和7种胺基键合硅胶的表面形貌,其中SiO2和代表性键合硅胶(氨丙基键合硅胶)的扫描电镜图见图3。与未键合硅胶(见图3a和图3b)对比发现,经过胺基化修饰后,硅胶表面更加粗糙,凹凸不平,增加了许多皱褶,且呈不规则形状(见图3c和图3d),这些形貌可提供大量的吸附位点,有利于物质的吸附[21]。

图 3 硅胶和氨丙基键合硅胶扫描电镜图Fig. 3 Scanning electron microscopes (SEM) of SiO2 and the aminopropyl bonded SiO2 a. SEM of SiO2(×500); b. SEM of SiO2(×50000); c. SEM of the aminopropyl bonded SiO2(×500); d. SEM of the aminopropyl bonded SiO2(×50000).

图 4 (a)硅胶和(b)氨丙基键合硅胶的EDS能谱图Fig. 4 Energy dspersive spectroscopy (EDS) spectra of (a) SiO2 and (b) the aminopropyl bonded SiO2
同时为了进一步验证胺基键合的成功与否,还测试了各种胺基键合硅胶的X射线能谱,SiO2的能谱图见图4a,氨丙基键合硅胶的能谱图见图4b。对比发现,胺基键合硅胶中有C和N元素,由此证明胺基键合硅胶已被成功键合。
2.1.3元素分析
胺基键合量对铅离子的吸附可能会产生一定影响,为了对比各胺基键合硅胶中含氮量的差异,本文采用元素分析仪分析了所制备的7种胺基键合硅胶(见表1)。由表1可知,随着氮链的增加,7种胺基键合硅胶含氮量并不随链长的增加而增加,其中SiO2-2N和SiO2-6N的含氮量较高,达到4.8%与4.3%。通过分析可知,SiO2-N和SiO2-2N键合硅胶是通过相应硅烷试剂与硅胶直接修饰得到,二胺的含氮量明显大于单胺,是因为每个二胺基团中含N量是单胺的两倍,但单胺中氨丙基键合密度(2.07 mmol/g)明显高于二胺中乙二胺-N-丙基的键合密度(1.71 mmol/g);三胺、四胺、五胺和六胺键合硅胶是以氯丙基键合硅胶为中间体嫁接而成,其含氮量随氮链的增长而增加,如果考虑每个胺基链中含N的差异,则表明胺基链的键合量基本相同,均为0.5 mmol/g。而聚乙烯亚胺键合硅胶含氮量仅为3.4%,键合密度仅为0.02 mmol/g,这可能是其巨大空间位阻(相对分子质量约5 000)所致。对比各胺基键合硅胶的C/N比,发现其值均在2.0~2.5范围内,这可能是因为胺基链的增加是由二乙基胺基片段的增加所致。
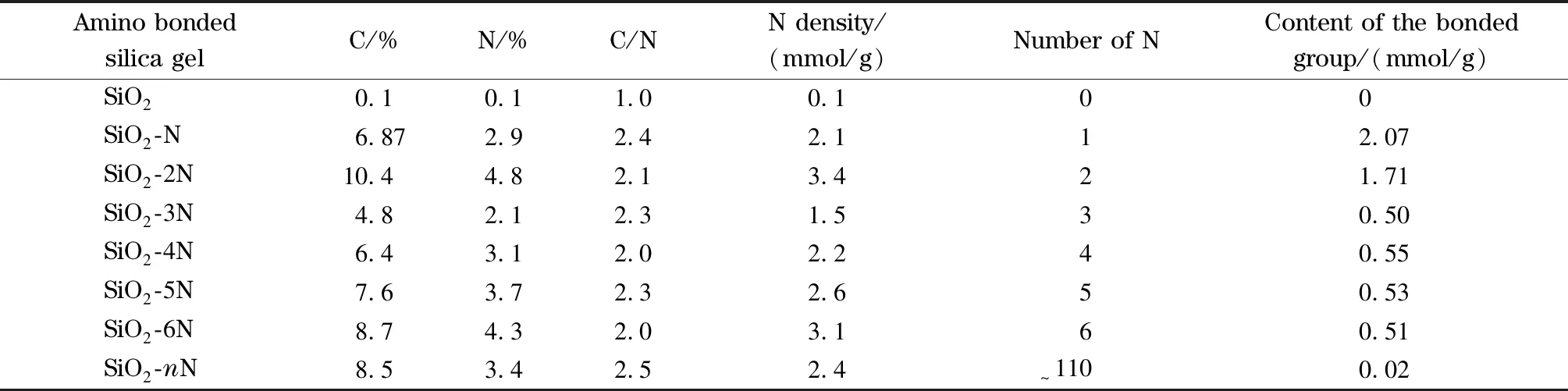
表 1 硅胶及系列胺基键合硅胶的元素分析结果Table 1 Elemental analysis results of SiO2 and a series of the amino bonded silica gel
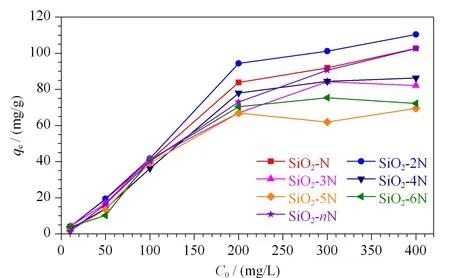
图 6 Pb2+初始质量浓度对系列胺基键合硅胶吸附量的影响Fig. 6 Effect of original mass concentrations of Pb2+on adsorptive capacities by a series of the amino bonded silica gel
2.1.4X射线衍射
图5展示了SiO2和7种胺基键合硅胶的小角粉末XRD分析结果。由图5可知,与SiO2相比,所制备的胺基键合硅胶的XRD图谱相似,但2θ为1°左右的衍射现象明显增强,说明胺基功能化对硅胶表面的微孔结构有一定改变,可能是各胺基基团不同程度镶嵌在硅胶孔径所致,也间接表明胺基键合硅胶表面有机胺片段含量较高[22]。

图 5 系列胺基键合硅胶的小角XRD图Fig. 5 Low-angle X-ray diffraction (XRD) patterns of a series of the amino bonded silica gel
2.2 胺基键合硅胶对金属离子Pb2+的吸附研究
根据1.3.2节建立标准曲线,结果表明,10 mL水相中Pb2+在1~10 μg间,其标准曲线为y=0.050 2x-0.014 8,相关系数(r2)为0.998 8,线性关系良好。
2.2.1金属离子浓度对吸附性能的影响
本文以Pb2+为重金属源,系统分析了7种不同胺基键合硅胶对Pb2+的吸附性能。称取20 mg不同胺基键合硅胶,分别分散于10 mL含10、50、100、200、300和400 mg/L Pb2+的水溶液中,测定Pb2+的质量浓度。实验结果如图6所示,随着溶液体系中Pb2+起始质量浓度的增加,7种胺基键合硅胶对Pb2+的吸附能力急剧增强,而当Pb2+起始质量浓度高于200 mg/L时,7种胺基键合硅胶对Pb2+吸附量增加缓慢并逐渐达到饱和。不同的胺基键合硅胶对Pb2+的吸附量不同,达到饱和吸附量时Pb2+的平衡浓度也不同。SiO2-N中氨基键合量虽然明显高于SiO2-2N,但是SiO2-2N吸附Pb2+的量(110.35 mg/g)却略高于SiO2-N(102.67 mg/g),这可能是SiO2-2N中两个毗邻N更有利于吸附Pb2+,使胺基的利用率从23.94%上升到30.92%。同样,SiO2-nN虽然键合量特别低,但每个聚乙烯亚胺链中含有100多个乙烯亚胺单元,每一组单元均可以吸附Pb2+,故其吸附Pb2+的量与单胺相当(102.56 mg/g)。SiO2-3N、SiO2-4N、SiO2-5N和SiO2-6N中胺基键合量低,Pb2+吸附量也远低于SiO2-N和SiO2-2N,分别为82.11、86.23、69.45和72.12 mg/g,但胺基的利用率却很高,依次为79.20%、75.15%、63.38%和67.98%。对比SiO2-N和SiO2-2N,可以发现,多胺基的利用率明显增高,尤其是SiO2-3N和SiO2-4N,这可能是SiO2-3N中的3个N、SiO2-4N中的4或3个N可以同时与Pb2+作用,增加了吸附Pb2+的能力。
总之,7种胺基键合硅胶对Pb2+最大吸附能力由高到低顺序为SiO2-2N、SiO2-N、SiO2-nN、SiO2-4N、SiO2-3N、SiO2-6N、SiO2-5N,胺基利用率依次为SiO2-nN、SiO2-3N、SiO2-4N、SiO2-6N、SiO2-5N、SiO2-2N、SiO2-N。
2.2.2溶液pH值对吸附性能的影响
溶液的pH值是吸附行为中最重要的影响因素。在一定pH值的溶液中,胺基键合硅胶表面形成水化层的厚度和所带电荷均会对金属离子的吸附产生影响。胺基键合硅胶对金属离子的吸附速率取决于金属离子在其表面的液膜扩散、功能基团的单分子层吸附或表层金属离子的内部扩散。为此,本文考察了在溶液pH值为3、4、5、6和7时7种胺基键合硅胶对Pb2+吸附性能的影响。固定Pd2+的初始质量浓度为400 mg/L,静态吸附时间为10 h。结果如图7a所示,在溶液pH值为3时,7种胺基键合硅胶对Pd2+吸附量均低于30 mg/g,这可能是pH值较低时,体系中的H+浓度较高,使配位的各N原子完全质子化,与Pb2+形成竞争,降低了吸附剂对Pb2+的配位能力。随着pH值从3增至5, 7种胺基硅胶对Pd2+的吸附量均呈上升趋势,当pH=5时,各吸附剂对Pb2+的吸附量达到最佳,SiO2-N和SiO2-2N的吸附量分别为131.28 mg/g和138.98 mg/g,略高于SiO2-nN(114.06 mg/g),高于SiO2-3N(85.37 mg/g)、SiO2-4N(75.22 mg/g)、SiO2-5N(61.87 mg/g)和SiO2-6N(79.12 mg/g),而胺基利用率却略有变化,SiO2-N和SiO2-2N分别上升至30%和39%, SiO2-3N上升至82%,其他胺基键合硅胶中的胺基利用率约为60%,这进一步说明不同胺基键合硅胶对Pb2+的吸附能力明显不同。随着溶液pH值的继续升高,各吸附剂对Pb2+吸附能力基本恒定,本文后续实验均调节溶液pH值至5。与文献报道的氮杂化键合硅胶和活性炭材料对Pb2+的吸附量(78.34 mg/g[13]、93.75 mg/g[23]和22.2 mg/g[14])相比,本文所制备的胺基键合硅胶展示了较高的Pb2+吸附性能。

图 7 (a)溶液pH值、(b)吸附时间和(c)吸附温度对 系列胺基键合硅胶吸附量的影响Fig. 7 Effect of (a) pH value of solution, (b) absorption time and (c) absorption temperature on the adsorption capacities of a series of the amino bonded silica gel
2.2.3吸附时间对吸附性能的影响
本文通过考察吸附时间来研究各胺基键合硅胶对Pb2+的吸附动力学。如图7b所示,以含有Pb2+的溶液加入到各胺基键合硅胶中时为0 h计,2 h时,7种胺基键合硅胶开始吸附Pb2+,随着时间延长至4 h,吸附速率急剧增加,随后吸附动力逐渐减缓,曲线逐渐趋于稳定,SiO2-3N、SiO2-4N、SiO2-5N和SiO2-6N在6 h就趋于吸附平衡,而SiO2-N和SiO2-2N需要10 h才可达到吸附平衡。所以,后续实验吸附平衡时间均采用10 h。
2.2.4温度对吸附性能的影响
为了阐明吸附温度对各胺基键合硅胶吸附性能的影响。本文固定溶液pH值为5,吸附时间为10 h,考察30、40、50、60、70和80 ℃下7种胺基键合硅胶对Pb2+的吸附能力。如图7c所示,在30~50 ℃时,各胺基键合硅胶吸附Pb2+的吸附量趋于稳定,随着温度逐渐增至80 ℃, Pb2+吸附量逐渐降低,可能是胺基键合硅胶吸附Pb2+属于放热过程[24],在低温下更有利于Pb2+与胺基硅胶的相互作用。由此可知,吸附温度对胺基键合硅胶吸附Pb2+具有一定影响,后续胺基键合硅胶吸附Pb2+实验均在30 ℃下进行。
2.2.5吸附等温线
为了对比各胺基键合硅胶对金属Pb2+的吸附性能,分别采用Langmuir和Freundlich等温方程对吸附数据进行拟合,得到Langmuir和Freundlich吸附等温线,其结果见图8。
Langmuir等温方程[17]为:
(5)
其中,Qe为平衡时的吸附量(mmol/g),ce为平衡时溶液中Pb2+的浓度(mol/L),Q0为饱和吸附量(mmol/g),b为经验参数。
Freundlich等温方程[25]为:
(6)
其中,n为Freundlich常数,KF为反应吸附剂对金属离子亲和力的结合能常数。
其中,Langmuir方程应用于均相吸附,即吸附在吸附剂表面上的各分子具有相等的吸附活化能。Freundlich方程用于多相和可逆吸附洗脱,不局限于单分子层吸附。
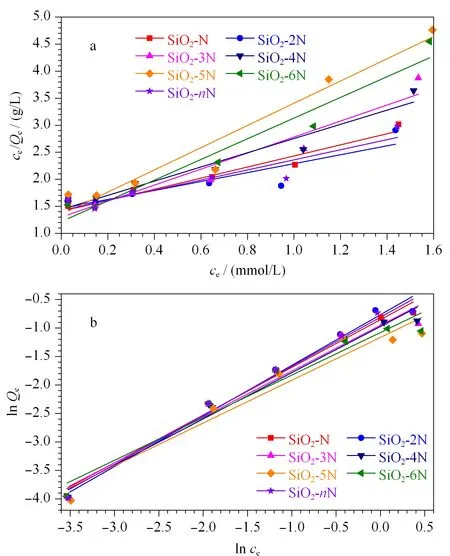
图 8 胺基键合硅胶吸附Pb2+的拟合(a)Langmuir和 (b)Freundlich等温线Fig. 8 (a)Langmuir and (b) Freundlich isotherms of absorption of the amino group bonded silica gels to Pb2+
吸附等温线结果见图8,比较回归系数(R2)发现,采用Freundlich模型的值比Langmuir模型的大,因此Freundlich模型更适用于研究系列胺基键合硅胶对Pb2+的吸附过程,由于Freundlich方程适用于多相吸附,推断各胺基键合硅胶表面对Pb2+具有不同的吸附量,比较各吸附剂的吸附性能发现,吸附量略有差异,由高到低顺序依次为SiO2-2N、SiO2-nN、SiO2-N、SiO2-3N、SiO2-4N、SiO2-6N和SiO2-5N,其中SiO2-2N的吸附量略高于其他各胺基键合硅胶。由此说明7种胺基键合硅胶中的SiO2-2N、SiO2-nN和SiO2-N对Pb2+吸附能力均较高,若改善SiO2-3N、SiO2-4N、SiO2-5N、SiO2-6N中胺基键合量,将是更具潜力的Pb2+离子吸附候选材料。
2.2.6共存离子及其他吸附剂对Pb2+吸附的影响
为了探究其他离子对Pb2+吸附的影响,本文选用SiO2-2N为吸附剂,首先依次考察了其对Cu2+、Mn2+、Cd2+3种金属离子的吸附量。结果表明:SiO2-2N对Cu2+、Mn2+和Cd2+的吸附量分别为32.53、16.30和36.81 mg/g,均远低于对Pb2+的吸附量。
配制400 mg/L的Pb2+、Cu2+、Mn2+和Cd2+混合溶液。选择对Pb2+吸附性能最佳的SiO2-2N,研究在Cu2+、Mn2+和Cd2+共存时,其对Pb2+的吸附性能。结果发现,在有Cu2+、Mn2+、Cd2+3种离子存在时,该二胺键合硅胶对Pb2+的吸附量依然高达73.51 mg/g,可能是受共存离子的影响,吸附值略有降低。
本文还选用了巯基键合硅胶与乙二胺四乙酸(EDTA)多羧基键合硅胶对Pb2+进行吸附实验。对比发现,在相同的吸附条件下,巯基键合硅胶、EDTA多羧基键合硅胶对Pb2+的最大吸附量分别为87.10 mg/g和108.46 mg/g。由此可见,本论文所制备的二胺键合硅胶对Pb2+的吸附能力大于巯基键合硅胶和EDTA多羧基键合硅胶这两种常用吸附材料,且制备过程简单,原料相对廉价,在应用过程中具有明显优势。
2.3 SiO2-2N去除废水样品中Pb2+
为了探索制备的键合硅胶对实际废水样品中Pb2+的去除能力,本文选用SiO2-2N为吸附剂,本学院本科教学实验室废水样品为实际样品,废水中可能含铅离子、无机盐、甲醇、乙醇、乙腈等物质。按1.3.3节描述处理废水样品,同法检测原废液中铅离子浓度。实验结果表明:经过SiO2-2N处理后,样品中Pb2+含量由3.211 9 μg/mL下降至0.726 2 μg/mL, Pb2+去除率可达77.4%。
3 结论
本文成功制备了7种胺基键合硅胶,且制备的胺基键合硅胶均表现出一定的Pb2+吸附性能,其中以SiO2-2N性能最佳。这些胺基键合硅胶有望广泛用于水溶液中Pb2+离子的吸附去除。

