产右旋糖酐肠膜明串珠菌酵培养基的优化
,*
(1.广东省生物工程研究所(广州甘蔗糖业研究所),中国轻工业甘蔗制糖工程技术研究中心, 广东省酶制剂与生物催化工程技术研究中心,广东广州 510316; 2.广东工业大学轻工化工学院,广东广州 510006)
右旋糖酐(Dextran)是一种由简单的葡萄糖单元聚合而成的高分子胞外多糖[1-2],它是由某些细菌(如肠膜明串珠菌、链球菌、葡糖杆菌及乳酸菌等)转化蔗糖合成的一种α-葡聚糖[3-4],广泛应用于医药、食品及精细化工等领域[5-7]。由于其糖苷键的构象不能被动物和人类所消化,进而选择性地被肠道益生菌利用,因此常作为益生元用作食品中的添加剂,其无毒、安全等优点使其在食品生产中被用于调理剂、稳定剂及增稠剂,也广泛用于糖食品的保鲜和防腐,这对于我国的绿色农业发展意义深远[8-10]。
目前,右旋糖酐的合成主要为微生物发酵法制备获得。生物发酵法[11-12]是通过明串珠菌(Leuconostocmesenteroides)分泌的右旋糖酐蔗糖酶催化蔗糖水解合成来实现的,先将蔗糖分解成一个果糖和一个与酶连接的葡萄糖基,随后将后者转移到葡聚糖残基的C3/C6位置或水分子,形成糖链[13]。有不少学者通过筛选突变菌株、优化发酵条件(pH、温度及转速)来提高菌体的发酵效率;Piyarat等[14]通过补料分批发酵降低发酵液粘度,改善物料传质性,加快蔗糖转化速率,从而提高了产物产量。然而,微生物发酵合成右旋糖酐过程中会受到多种物理、化学因素的影响[15-19],如培养液中碳氮源、缓冲盐离子等。适宜的培养基成分及浓度能够为菌体生长和酶分泌提供有利条件,是其他发酵调控手段的基础,因此,对肠膜明串珠菌的发酵培养基进行优化,能够直接影响其发酵效率。有文献报道,明串珠菌在糖代谢途径中,蔗糖一部分被胞外的葡聚糖蔗糖酶催化生成葡聚糖和果糖,另有一部分进入细胞被蔗糖磷酸酶分解为葡萄糖-1-磷酸和果糖,随后进入菌体的戊糖磷酸代谢途径,供应菌体生长,两者相互促进[20],因此,蔗糖的转化效率直接影响着产物的生成效率。响应面法可获得各因素水平与响应值的连续关联模型,因此被广泛应用于微生物发酵优化[21-24]。
本实验采用肠膜明串珠菌(CICC-23614),以单因素实验为基础,采用Box-Behnken实验对培养基成分及浓度进行优化,利用响应面分析研究,确定最优的发酵培养基成分及浓度,提高蔗糖转化率,为该菌定向制备右旋糖酐及其未来的应用提供可靠数据。
1 材料与方法
1.1 材料与仪器
肠膜明串珠菌Leuconostocmesenteroides(CICC-23614) 由广东省微生物研究所菌种保藏中心保藏;蔗糖 上海阿拉丁生化科技股份有限公司;十二水合磷酸氢二钠、磷酸二氢钾 广州化学试剂厂;广细菌蛋白胨 广东环凯微生物科技有限公司。
PR1203分析天平 梅特勒-托利多国际贸易(上海)有限公司;LDZX-30KBS灭菌锅 上海申安医疗器械厂;SW-CJ-1CU超净工作台 苏州安泰空气技术有限公司;GRJB-5D 5L发酵罐 镇江格瑞生物工程有限公司:LC-20A高效凝胶色谱仪 日本岛津。
1.2 实验方法
1.2.1 培养方法 种子培养基(g/L):蔗糖 130,蛋白胨 2.0,Na2HPO4·12H2O 1.4,KH2PO40.3,121 ℃,灭菌15 min;发酵培养基:各成分同种子培养基,培养基中各成分浓度根据实验设计调整,121 ℃,灭菌15 min。
菌种活化:将购买的肠膜明串珠菌CICC-23614安剖瓶装的冻干粉剂用无菌水溶解后,吸菌液在斜面培养基上划线,静置于25 ℃恒温培养培养24~48 h,得到斜面菌种,再用相同方法传代活化三次,斜面4 ℃保藏待用。
摇瓶种子:用接种环从活化好的斜面菌种挑取两环菌落接种于装有100 mL种子培养基的250 mL摇瓶中,于25 ℃、100 r/min摇床培养24 h,得到一级种子液。
发酵培养:以9%的接种量接种于发酵培养基中,于25 ℃、100 r/min摇床培养24 h,HPLC检测分析,记录蔗糖残留浓度,计算蔗糖转化率。
1.2.2 单因素实验 均以接种时为转化起点,在25 ℃、100 r/min摇床培养24 h后取样分析。
固定蛋白胨、Na2HPO4·12H2O及KH2PO4浓度分别为2.0、1.4、0.3 g/L,考察初始发酵培养基中蔗糖浓度(70、100、130、160、190、210 g/L)对蔗糖转化率的影响。
固定蔗糖初始浓度、Na2HPO4·12H2O及KH2PO4分别为130、1.4、0.3 g/L,考察发酵培养基中蛋白胨浓度(1、3、5、7、9 g/L)对蔗糖转化率的影响。
固定蛋白胨、蔗糖初始及KH2PO4分别为2.0、130、0.3 g/L,考察发酵培养基中Na2HPO4·12H2O浓度(0.4、0.8、1.4、2.0、2.6、3.2 g/L)对蔗糖转化率的影响。
固定蛋白胨、Na2HPO4·12H2O及蔗糖初始浓度分别为2.0、1.4、130 g/L,考察发酵培养基中KH2PO4浓度(0.1、0.3、0.5、0.7、0.9 g/L)对蔗糖转化率的影响。
1.2.3 响应面试验 根据Box-Behnken实验原理,以1.2.2单因素实验为基础,以其最佳浓度为0点,以蔗糖转化率为响应值,设计4因素3水平响应面试验,对肠膜明串珠菌CICC-23614培养基配方进行优化。各因素的三个水平用-1、0、1进行编码,如表1所示。利用 Design-expert 8.0.6软件进行响应面试验设计,共设计29个试验,其中24个析因试验,5个为中心试验,用以对误差进行估计。

表1 响应面分析因素与水平Table 1 Factors and levels of response surface analysis
1.2.4 指标分析方法
1.2.4.1 标准溶液的配制 将蔗糖干燥至恒重后(精确至万分之一),用二次蒸馏水配制,配制一系列浓度(0.3%、0.5%、1.0%、1.5%、2.0%、3.0%)的蔗糖溶液,用0.22 μm的水膜过滤头过滤后取适量注入进样瓶中,进行HPLC检测。
1.2.4.2 液相色谱条件 色谱柱为Shodex® SUGAR KS-803 No.H25T0005(300 mm×8.0 mm);流动相:超纯水;流速:1.0 mL/min;柱温:50 ℃;进样量:10 μL。
1.2.4.3 蔗糖残留测定及计算 从种子培养基中取9%的种子液于发酵培养基中,发酵结束后用流动相进行适当稀释后在液相色谱中对发酵液中残留蔗糖进行定量分析计算,蔗糖转化率的计算按照下式计算:

1.3 数据处理
利用Origin 7.5进行数据分析和绘图,利用Design-Expert 8.0.6进行响应面法试验设计和结果分析。
2 结果与分析
2.1 蔗糖的标准曲线
蔗糖的标准曲线为Y=(1.26073e-006)X+(-0.0156986),R2=0.9999145,见图1。
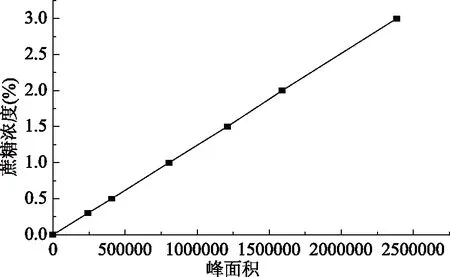
图1 蔗糖标准曲线Fig.1 Standard curve of sucrose
2.2 单因素实验结果分析
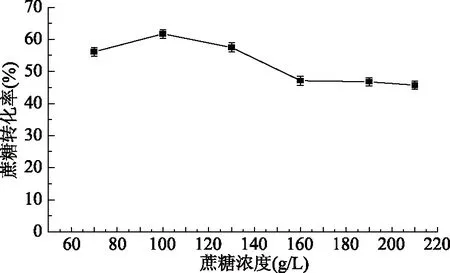
图2 蔗糖初始浓度对蔗糖转化率的影响Fig.2 Effects of sucrose concentration on sucrose conversion rate
2.2.1 蔗糖初始浓度对蔗糖转化率的影响 由图2结果可以看出,蔗糖初始浓度为70 g/L时,蔗糖转化率仅为56.1%;蔗糖初始浓度为100 g/L时,蔗糖转化率最高,其值为61.7%;随着培养基中蔗糖初始浓度提高至160 g/L以上时,蔗糖转化率均低于50%,呈明显降低趋势。因为在产物右旋糖酐合成过程中,蔗糖既是酶诱导物,又是酶作用底物,在蔗糖的诱导下肠膜明串珠菌分泌右旋糖酐蔗糖酶,该酶在胞外催化蔗糖合成葡聚糖和果糖,适宜浓度的蔗糖有利于细胞处于最佳生长状态;相反,蔗糖浓度过高会引起培养基中渗透压的变化,影响菌体的生长状况及右旋糖酐蔗糖酶的分泌,进而影响蔗糖的转化,所以选择蔗糖起始浓度为100 g/L。
2.2.2 蛋白胨浓度对蔗糖转化率的影响 肠膜明串珠菌属于化能异样型微生物,自身不能合成所需要的营养物质,需要外界提供氮源维持其生长[20]。由图3可以看出,蛋白胨浓度小于3 g/L时,菌体生长没有足够的氮源供给,生长状态差,菌体分泌的右旋糖酐蔗糖酶少,蔗糖转化率极低;当蛋白胨浓度为3 g/L时,蔗糖转化率仅为70%,随着培养基中蛋白胨浓度的不断提高,蔗糖转化率呈上升趋势,当蛋白胨浓度为5 g/L时,蔗糖转化率可达90%以上,此时继续提高蛋白胨浓度蔗糖转化率基本不变,这可能是因为其他营养物质限制了菌体生长,另外蛋白胨含量过高对菌体也可产生毒副作用,所以选择的蛋白胨浓度为5.0 g/L。

图3 蛋白胨浓度对蔗糖转化率的影响Fig.3 Effects of peptone concentration on sucrose conversion rate
2.2.3 Na2HPO4·12H2O浓度对蔗糖转化率的影响 无机盐是微生物生长所需的元素,适量的浓度可以促进菌体的生长,并可起到调节pH的作用。随着Na2HPO4·12H2O浓度的升高,蔗糖转化率呈先升高后降低的趋势,当Na2HPO4·12H2O浓度为0.8 g/L时,蔗糖转化率最高,为81.00%。由于肠膜明串珠菌的糖代谢特点,在以蔗糖为底物的培养基中,明串珠菌代谢产生乙酸。因为在代谢过程中生成乙酸比生成乙醇可多产生一个ATP,对菌体生长有利。因此,肠膜明串珠菌的生长代谢过程中会不断有乙酸的积累,pH会随发酵进行而降低[20,26],而培养基中Na2HPO4·12H2O与KH2PO4的存在形成一个缓冲体系,对培养液起着重要的pH缓冲作用,在Na2HPO4·12H2O浓度为0.8 g/L时最适合蔗糖的转化。因此,最佳的Na2HPO4·12H2O浓度为0.8 g/L。

图4 Na2HPO4·12H2O浓度对蔗糖转化率的影响Fig.4 Effects of Na2HPO4·12H2O concentration on sucrose conversion rate

图5 KH2PO4浓度对蔗糖转化率的影响Fig.5 Effects of KH2PO4 concentration on sucrose conversion rate
2.2.4 KH2PO4浓度对蔗糖转化率的影响 由图5可知,在实验研究范围内,蔗糖转化率基本变化不大,最佳的KH2PO4浓度为0.3 g/L,蔗糖转化率为82.92%。原因可能是Na2HPO4·12H2O为1.4 g/L时,与0.3 g/L的KH2PO4形成了一个很好的缓冲体系,可以在一定程度上很好地调节因菌体生长代谢引起的pH变化,使菌体处于较佳的生长状态,也可延长右旋糖酐蔗糖酶的催化作用,而有利于产物的生成[25];KH2PO4浓度过高,与Na2HPO4·12H2O的缓冲作用失调,不能很好地对培养液pH起到缓冲作用,影响右旋糖酐蔗糖酶的分泌,从而降低蔗糖转化效率。因此,选择的KH2PO4浓度为0.3 g/L。
2.3 响应面试验结果分析
2.3.1 Box-Behnken试验设计及结果 根据Box-Behnken试验原理,以单因素实验为基础,以其最佳浓度为0点,以蔗糖转化率为响应值,

表2 响应面试验结果Table 2 Results of response surface experiment
设计4因素3水平响应面试验,对肠膜明串珠菌CICC-23614培养基配方进行优化。各因素的三个水平用-1、0、1进行编码,如表2所示。
2.3.2 回归方程拟合及方差分析 利用Design-expert 8.0.6软件对表2数据进行数据分析和二次回归拟合,用Y表示蔗糖转化率,得到的回归方程为:Y=89.56-8.33A+5.68B+16.49C+0.37D+5.35AB+6.98AC+0.43AD+1.00BC+1.03BD+0.25CD-1.95A2-4.06B2-13.64C2-3.28D2,R2=0.9864,其方差分析如表3所示。
由表3可知,模型P值<0.0001,说明二次回归模型极显著,失拟项P值(0.1017>0.05),差异不显著,说明此二次回归模型能够较好地反映响应值的变化,模型与实际试验拟合度好,可以很好地对蔗糖转化率进行分析和预测。一次项A、B、C以及交互项AB、AC,二次项B2、C2以及D2对蔗糖转化率有极显著影响(P<0.01)。
图6~图11为根据回归方程绘制的试验因素间交互效应三维立体响应曲面和等高线图,可以直观地考察某两个因素固定的情况下,其他两个因素对蔗糖转化率的影响。由图可知,蔗糖浓度和蛋白胨浓度(AB)、蔗糖浓度和Na2HPO4·12H2O浓度(AC)的交互作用对蔗糖转化率有显著影响,其他交互作用不显著,与方差分析结果一致。

表3 方差分析Table 3 ANOVA analysis
注:**表示极显著(P<0.01),*表示显著(P<0.05)。

图6 蔗糖浓度和蛋白胨浓度对蔗糖转化率影响的响应面和等高线Fig.6 Response surface and contour of effects of sucrose concentration and peptone concentration on sucrose conversion rate
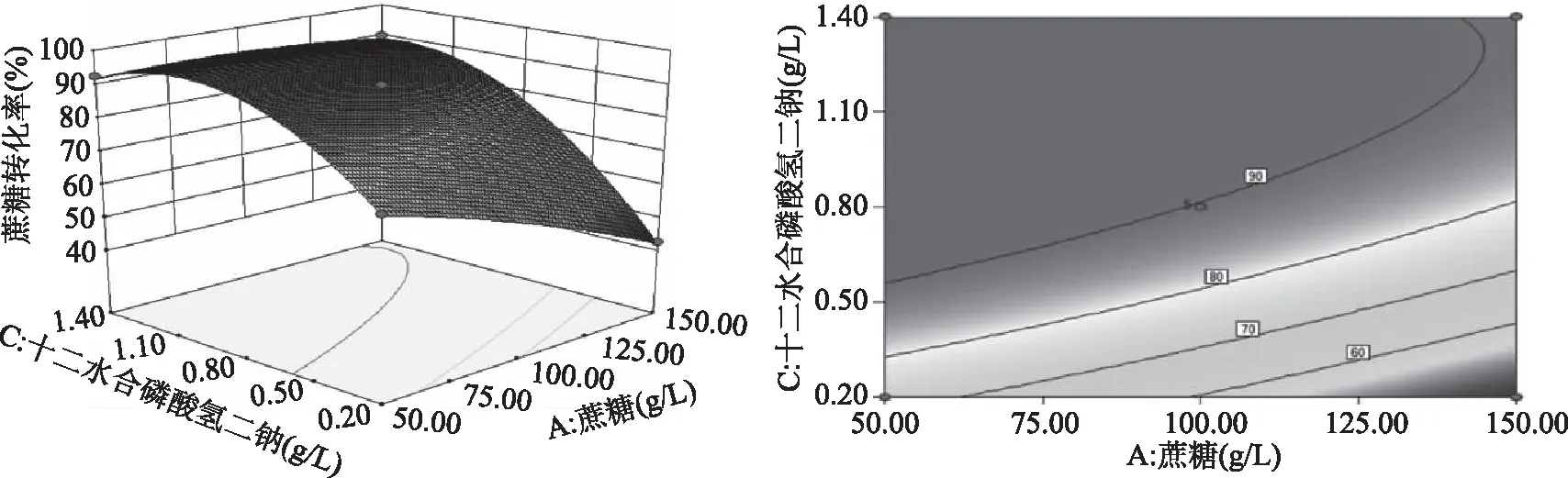
图7 蔗糖浓度和Na2HPO4·12H2O浓度对蔗糖转化率影响的响应面和等高线Fig.7 Response surface and contour of effects of sucrose concentration and Na2HPO4·12H2O concentration on sucrose conversion rate
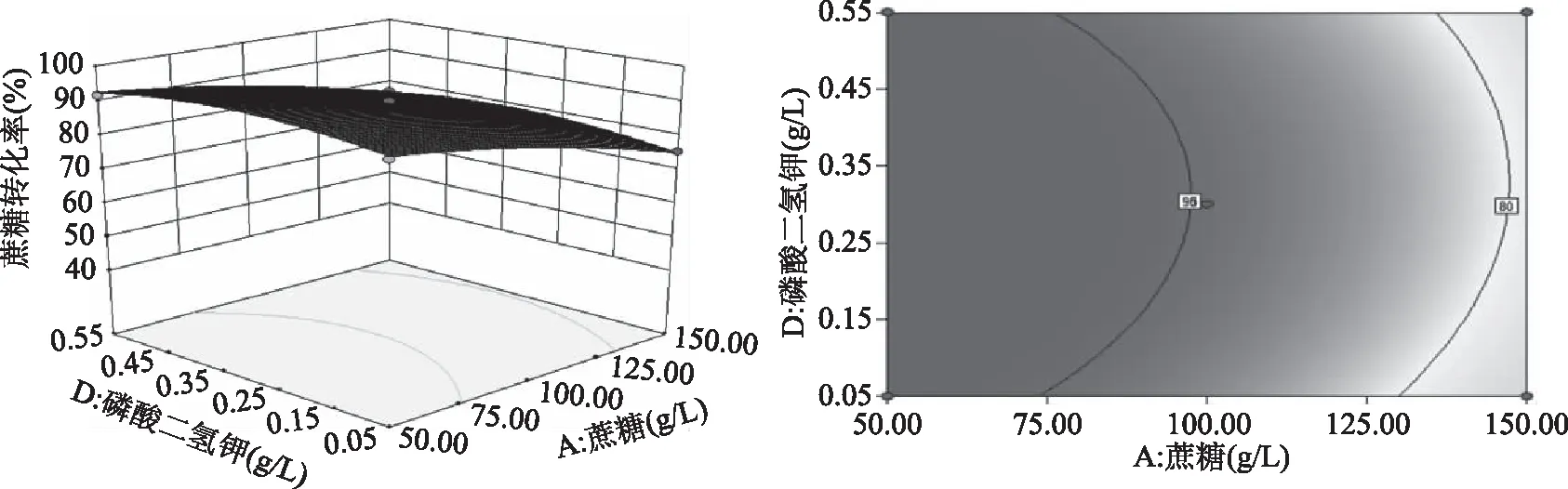
图8 蔗糖浓度和KH2PO4浓度对蔗糖转化率影响的响应面和等高线Fig.8 Response surface and contour of effects of sucrose concentration and KH2PO4 concentration on sucrose conversion rate

图9 Na2HPO4·12H2O浓度和蛋白胨浓度对蔗糖转化率影响的响应面和等高线Fig.9 Response surface and contour of effects of Na2HPO4·12H2O concentration and peptone concentration on sucrose conversion rate
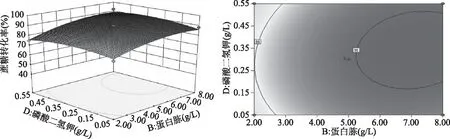
图10 蛋白胨浓度和KH2PO4浓度对蔗糖转化率影响的响应面和等高线Fig.10 Response surface and contour of effects of peptone concentration and KH2PO4 concentration on sucrose conversion rate

图11 Na2HPO4·12H2O浓度和KH2PO4浓度对蔗糖转化率影响的响应面和等高线Fig.11 Response surface and contour of effects of Na2HPO4·12H2O concentration and KH2PO4 concentration on sucrose conversion rate
2.3.3 验证实验 根据回归模型,通过软件分析,并且考虑到发酵效率及产物纯化问题,得到上述4因子的最优添加量为蔗糖101.31 g/L,细菌蛋白胨5.66 g/L,Na2HPO4·12H2O 1.11 g/L和KH2PO40.15 g/L,预测值是93.90%。在此条件下,进行平行验证,优化培养基培养获得的蔗糖转化率与预测值吻合良好,可达91.9%,与预测值误差仅为2.13%,说明该回归模型是科学合理的,且优化后的培养基发酵结果为原始培养基(56.35%±0.35%)条件下的1.6倍。
3 结论
在单因素实验的基础上,采用响应面法考察碳源、氮源以及无机盐对蔗糖转化率的影响。结果显示,二次方程的回归模型差异极显著(P<0.01),二次方差分析显示失拟项检验不显著,说明本实验所建立的二次回归方程能较好地反映所考察因素与响应值之间的关系,实验设计科学合理。通过工艺条件的优化,考虑到生产的经济性和后续产物的分离纯化,选择肠膜明串珠菌CICC 23614最佳培养基成分为:蔗糖101.31 g/L,细菌蛋白胨5.66 g/L,Na2HPO4·12H2O 1.11 g/L和KH2PO40.15 g/L。在优化后的培养基条件下,发酵24 h的蔗糖转化率为91.9%,与预测值误差仅为2.13%,为以后的右旋糖酐制备奠定可靠基础。

