鳖甲胶原蛋白酶解物的分离纯化及体外抗氧化性研究
卢梦楠 李兰芳 景玉蕾 宋 伟 李彩燕 钱国英
(浙江万里学院生物与环境学院,浙江 宁波 315000)
中华鳖(Pelodiscus sinensis)是我国传统的营养滋补佳品,其背甲俗称鳖甲,可药食两用。据报道,鳖甲中富含肽类、动物胶、角蛋白、维生素、磷酸钙、碳酸钙、氨基酸以及多糖等[1]。目前关于鳖甲的研究主要集中在化学组成或鳖甲提取物的药理作用方面[1-2];在鳖甲活性多肽方面的报道也仅限于膜分离法制备[2]、抗肝纤维化及合成[3]、干燥方式[4]等。
胶原蛋白或明胶经蛋白酶水解后可制得低分子或小分子胶原蛋白肽或水解胶原,此类物质具有免疫调节、抗氧化、抑菌、抗高血压、抗衰老等特殊功能,在保健品、化妆品、生物医药方面有着广泛的应用[5]。与陆生动物胶原蛋白相比,水生动物源胶原蛋白肽具有独特的生理功能和物化特性,已成为当前水产加工副产物综合开发利用研究的热点之一[6]。骨胶原肽品质独特,是特异功效活性肽的良好来源,具有其他替代材料无可比拟的优越性。目前人们已经从众多海洋和淡水生物的鱼鳞或骨架结构中制备得到具有良好体外抗氧化活性的胶原肽,如鲟鱼[7]、马面鱼[8-9]、鲤鱼[10-12]、罗非鱼[13-14]、鲢鱼[15]、草鱼[16]、鱿鱼[17-18]等。Abdollahi 等[12]利用酸法制备银鲤中的胶原蛋白及肽类并比较了其理化性质,Chen 等[14]也利用酸溶法制备获得了罗非鱼鳞片和皮中的酸溶性胶原蛋白,为中华鳖背甲中胶原蛋白的提取工作提供了思路。
前期研究从中华鳖的裙边部位制备获得胶原蛋白提取率为75.64%[19],整鳖蛋白质含量平均达23.44%[20],且含有存在于胶原蛋白中的特征性氨基酸——羟脯氨酸[1]。但鳖甲中特异性的功效成分尚未明确。目前国内外已有一些关于鳖源功能肽的研究报道,如徐怀德等[21-22]利用木瓜蛋白酶水解中华鳖蛋白获得了具有较强抗氧化活性的酶解物。鳖甲经过热水浸提后超滤可以得到相对分子质量小于6 kDa的肽类成分,具有显著的抗肝纤维化作用[2-3],说明鳖甲具有一定的生物学活性,也为研究鳖甲体外抗氧化性提供了初步的理论参考。但目前关于鳖甲中胶原蛋白酶解物的制备及活性研究尚鲜见报道。
为了建立鳖甲中胶原蛋白酶解物的制备工艺,本试验以DPPH·、O2-·和OH·清除率作为体外抗氧化能力的检测指标,研究酶解条件下鳖甲胶原的分离纯化条件及生物学特性,旨在为鳖甲的开发利用及鳖源新型抗氧化物质的研发提供科学依据。
1 材料与方法
1.1 材料与试剂
鳖甲,购自宁波当地中华鳖养殖场;DPPH(1-二苯基-2-三硝基苯肼[1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl]、胃蛋白酶(350 000 U·g-1)、木瓜蛋白酶(200 000 U·g-1)、菠萝蛋白酶(50 000 U·g-1),均购自美国Sigma 公司;复合蛋白酶(100 000 U·g-1)、低分子量蛋白质Marker(15~150 kDa),均购自北京Solarbio公司;其余试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 主要仪器与设备
透析袋(100 kDa 截留量),北京Solarbio 公司;KT-3400 磁力搅拌仪、高速冷冻离心机,上海卢湘仪离心仪器有限公司;FD-1A-50 真空冷冻干燥机,北京博医康实验仪器有限公司;165-8001 垂直电泳仪、Gel DocTM凝胶成像仪,美国Bio-Rad 公司;Sephadex G-75、DEAE(二乙胺基乙基纤维素) 离子交换层析柱,General Electrics 公司;GK-0740层析仪,印尼AKTA公司。
1.3 试验方法
1.3.1 鳖甲胶原蛋白制备 鳖甲经咬骨钳粉碎,以料液比1∶10 置于0.5 mol·L-1HCl溶液中浸泡3次(4 h/次),捞出沥干后再以料液比1∶20 置于0.1 mol·L-1NaOH溶液中浸泡5 h,沥干,在1∶15(m/v)10%的异丙醇中浸泡12 h,捞出沥干后沸水浸提10 min,称重然后添加5 000 U·g-1胃蛋白酶酶解,酶解产物于4℃、8 000 r·min-1条件下离心10 min,取上清液,于-50℃、1.0 Mbar条件下真空冷冻干燥48 h,即得中华鳖背甲胶原蛋白酶解物(collagen hydrolysates,CH)。
1.3.2 鳖甲胶原蛋白及其酶解物分子量测定 采用SDS-PAGE (sodium salt polyacrylamide gel electrophoresis)电泳法确定鳖甲胶原蛋白及胶原酶解物分子量。12%的分离胶、5%的浓缩胶;电泳缓冲液为Tris-甘氨酸缓冲液(pH值8.3,0.1% SDS);样品缓冲液为Tris-HCl 缓冲液(0.05 mol·L-1pH值8.0);染色液为0.25%考马斯亮兰R-250 甲醇水。样品质量浓度为15 mg·mL-1,上样量为10 μL。采用直流恒压电源,浓缩胶90 V,分离胶120 V,电泳时间2 h[19]。
1.3.3 单酶水解制备鳖甲胶原蛋白肽 参照文献[19,23-24]略有改动,根据水解度和酶解条件,初步筛选出胃蛋白酶、菠萝蛋白酶、复合蛋白酶3种酶,分别作为酸性、中性、弱酸作用条件的代表,水解中华鳖背甲胶原蛋白样品,3种蛋白酶最佳水解条件见表1。
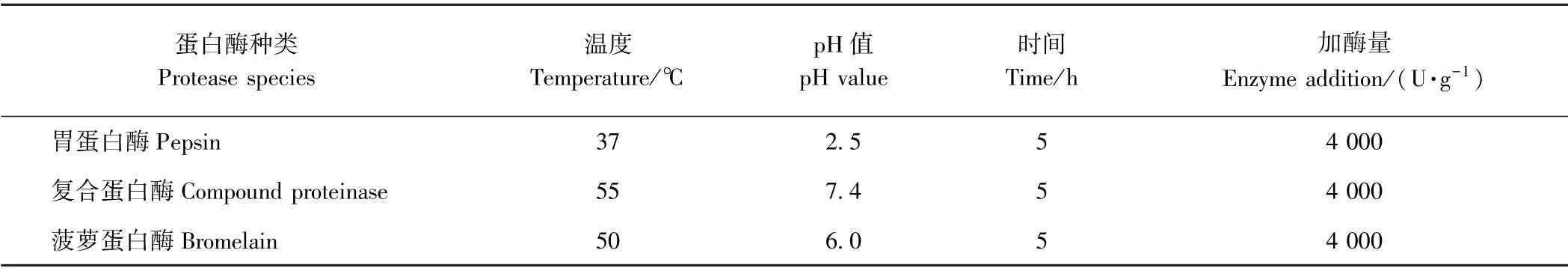
表1 中华鳖背甲胶原蛋白的酶解条件Table1 Enzymatic hydrolysis conditions of collagen from turtle carapace
1.3.4 体外抗氧化性测定 DPPH·清除率测定参考文献[21-22]稍作修改,每一吸光度平行测定3次,取平均值。以维生素C(Vc)作阳性对照。OH·清除率及·清除率测定参照文献[21]进行。
1.3.5 单因素试验 以3种自由基(DPPH·、O2-·、OH·)清除能力作为体外抗氧化性测定指标。选取不同加酶量(3 000、4 000、5 000、6 000 U·g-1)、不同水解温度(40、45、50、55、60℃)、不同pH值(2.0、2.5、3.0、3.5和4.0),分别进行单因素试验,确定每个因素的最佳条件。
1.3.6 Sephadex G-75 色谱柱层析分离鳖甲胶原酶解物 参照文献[25]略有改动,将最佳酶解工艺制备的鳖甲胶原酶解物(CH)过100、50 kDa 透析袋进行透析,对透析获得的不同分子量肽进行体外抗氧化活性测定,取抗氧化活性最高的透析液冻干,制成浓度为10 mg·mL-1的溶液,用Sephadex G-75 葡聚糖凝胶柱层析分离,上样量2 mL,检测波长220 nm,流动相0.01 mol·L-1PBS 缓冲液(phosphate buffer saline,pH值7.0),流速1 mL·min-1。收集抗氧化活性较高的洗脱组分,部分用于测定各组分的DPPH·、OH·、O2-·清除率,剩余部分冷冻干燥备用。
1.3.7 DEAE层析分离纯化 根据文献[26-27]略有改动。取上一步骤的层析组分冷冻干燥部分,用0.05 mol·L-1Tris 缓冲液(pH值6.0)配成50 mg·mL-1的样品溶液,0.1 mol·L-1NaCl 进行线性梯度洗脱,所有溶液经过0.45 μm 微孔滤膜进行过滤。根据优化条件选用1.6 cm×10 cm的离子交换层析柱,流速1 mL·min-1,检测波长214 nm,收集洗脱峰,测定各组分的DPPH·、OH·、O2-·清除率,冷冻干燥收集抗氧化活性较高的组分。
1.4 数据处理
试验数据以平均数±标准差表示。采用SPSS 17.0统计软件进行单因素方差分析(ANOVA),用Duncan多重比较法进行显著性检验(P<0.05);应用GraphPad Prism 5.0 进行数据整理并作图。
2 结果与分析
2.1 SDS-PAGE 电泳图
由图1可知,鳖甲胶原蛋白粗提物(泳道1)经酶解后的产物(泳道2)经过100 kDa 截流量的透析袋分离得到大于100 kDa和小于100 kDa的酶解产物,可以获得较为纯净的分子量大于100 kDa的胶原蛋白。小于100 kDa的酶解产物经过Sephadex G-75 色谱柱进行凝胶分离,得到了有效产物,即泳道3 产物;将所得产物通过离子交换柱分离获得了泳道4 产物,将以上所有分离步骤所得产物进行体外抗氧化测定,确定泳道4为高抗氧化活性产物且分子量在40 kDa左右的酶解物。

图1 鳖甲胶原蛋白及其酶解物纯化前后SDS-PAGE 电泳图Fig.1 SDS-PAGE of turtle carapace collagen and collagen hydrolysates before and after purification
2.2 不同蛋白酶水解鳖甲胶原蛋白的效果
由表2可知,经胃蛋白酶酶解的鳖甲胶原蛋白水解产物对DPPH·和OH·的清除率最高。复合蛋白酶酶解产物清除DPPH·和O2-·的效果优于菠萝蛋白酶,但清除OH·效果最低。故后续试验选择胃蛋白酶酶解制备鳖甲胶原蛋白肽并确定其酶解条件。

表2 不同蛋白酶水解产物对DPPH·、OH·和O2-·清除率的影响Table2 Effects of different protase hydrolysates on the DPPH·,OH·and O2-·scavenmg rate /%
2.3 单因素试验确定鳖甲胶原酶解物的制备条件
由图2-A可知,当其他酶解条件确定(pH值2.5,加酶量4 000 U·g-1),酶解温度为35℃时,经胃蛋白酶酶解的鳖甲胶原蛋白水解产物对O2-·、OH·和DPPH·3种自由基的清除率均达到最大。当酶解温度上升到40℃后,3种自由基清除率均随着酶解温度的升高而降低。
由图2-B可知,当其他酶解条件确定(pH值2.5,酶解温度35℃)时,酶解鳖甲胶原蛋白水解产物对和DPPH·的清除率均随着加酶量的增加而升高。当加酶量介于2 000~4 000 U·g-1之间时,3种自由基清除率提高的幅度较大;当加酶量为4 000~6 000 U·g-1时,3种自由基清除率增幅减缓。从经济和水解效率综合考虑,加酶量选取4 000~5 000 U·g-1为宜。
由图2-C可知,当其他酶解条件确定(加酶量4 000 U·g-1,酶解温度35℃)时,pH值介于1.5~2.5之间时,酶解鳖甲胶原蛋白水解产物对DPPH·、OH·和O2-·的清除率均逐渐增加,在pH值2.5时达到最大,分别为58.30%、27.65%和2.81%;随着pH值继续升高,3种自由基的清除率均逐渐降低。综上,胃蛋白酶在酸性条件水解效果较好。
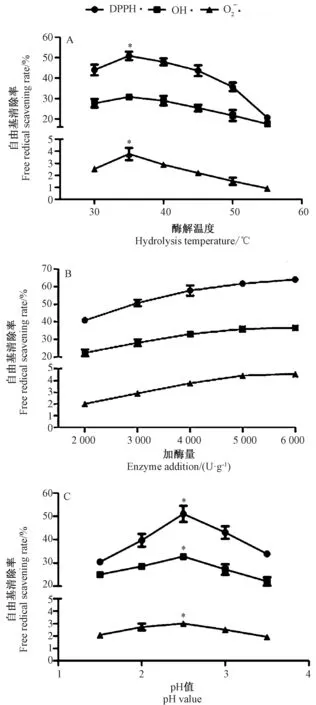
图2 酶解温度、加酶量、pH值对3种自由基清除率的影响Fig.2 Effects of hydrolysis temperature,enzyme addition,and pH value on free radical scavening rates
2.4 鳖甲胶原酶解物的分级纯化及体外抗氧化活性研究
在最适酶解环境下,鳖甲胶原酶解物(CH)经透析后分别得到组分CH-1(分子量>100 kDa)、CH-2(分子量50~100 kDa)和CH-3(分子量<50 kDa)。由图3可知,透析过的CH-1、CH-2、CH-3的体外抗氧化活性(OH·和DPPH·3种自由基清除率)不同,分子量越低抗氧化活性越高。CH-3 对3种自由基的清除率最高,极显著高于CH-1(P<0.01);CH-2 对3种自由基的清除率次之,显著高于CH-1(P<0.05);CH-1的清除效果最低。
Sephadex G-75 凝胶色谱柱层析可用于分离分子量介于3~80 kDa之间的蛋白。CH-3 经Sephadex G-75 凝胶色谱柱层析分离后出现2个特征明显的峰,即层析得到2个组分GP-1和GP-2(图4-A)。由图3可知,随着多肽分子量的降低,3种自由基清除率总体呈上升趋势,可见清除率与多肽分子量之间有一定的协同作用。
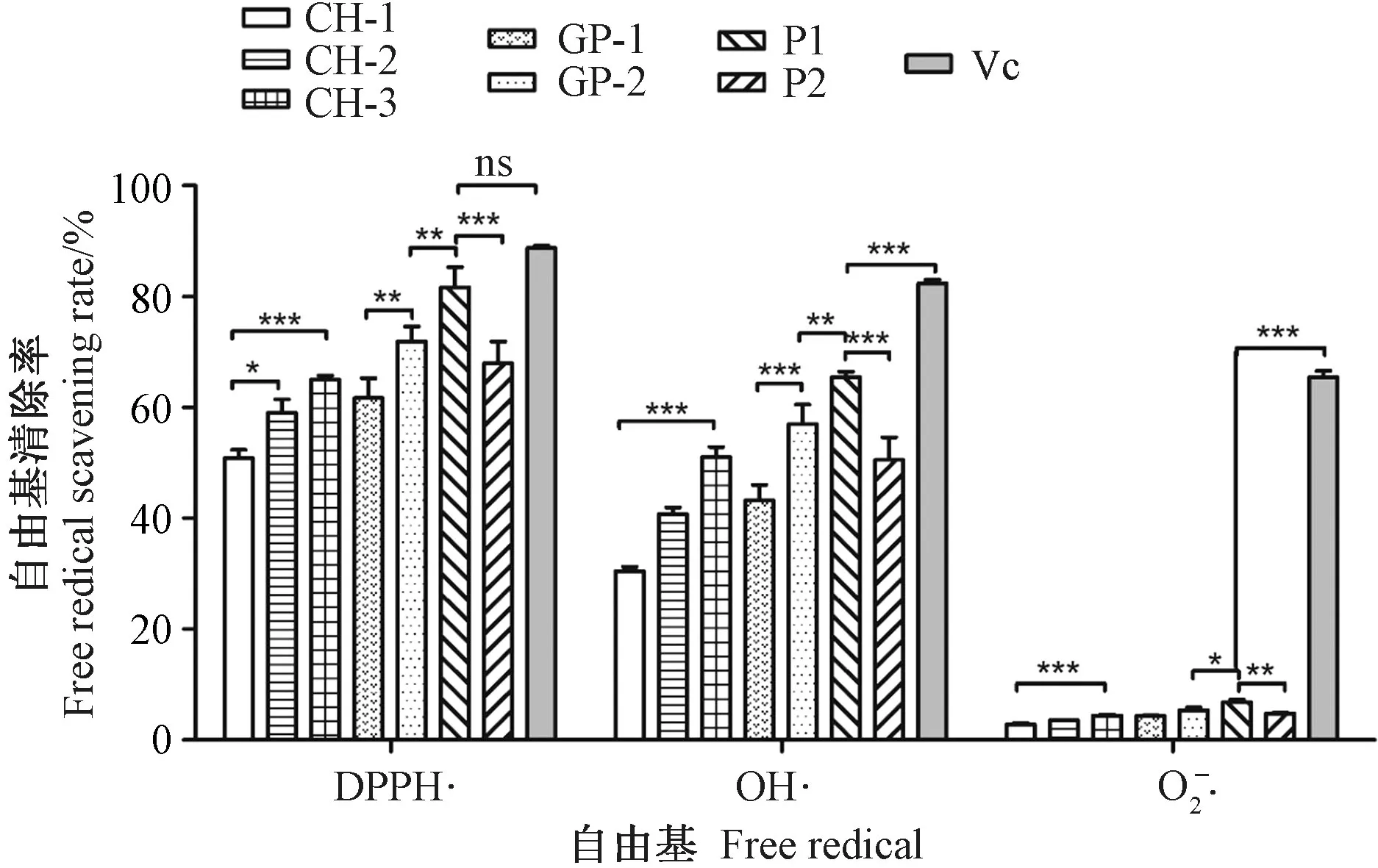
图3 鳖甲胶原酶解物纯化过程各组分对体外3种自由基清除率的影响Fig.3 Effects of collagen hydrolysate from turtle carapace on free radical clearance rates
GP-2 进一步经离子交换层析后得到了2个洗脱峰,即组分P1和P2(图4-B)。由图3可知,P1的体外抗氧化活性极显著高于P2(P<0.01),且P1 对DPPH·和OH·的清除率极显著高于GP-2(P<0.01),对O2-·的清除率显著高于GP-2(P<0.05)。与阳性对照Vc相比,P1 对DPPH·的清除率无显著差异(P>0.05)。表明鳖甲胶原酶解物经纯化分离后,体外抗氧化活性提高非常明显。经SDS-PAGE 电泳可知,P1组分分子量介于35~48 kDa之间(图1),也证实本试验获得了鳖甲组织的水解明胶。明胶是胶原蛋白部分水解的产物,其三螺旋结构部分被破坏,分子量通常介于15~250 kDa之间[9]。

图4 鳖甲胶原酶解物组分凝胶色谱层析(A)、离子交换层析(B)分离图谱Fig.4 Gel chromatography(A) and DEAE chromatography (B) of collagen hydrolysate from turtle carapace
3 讨论
本试验提取鳖甲胶原蛋白进行酶解获得的酶解产物具有良好的体外抗氧化活性,这与郭瑶[23]酶解罗非鱼皮胶原蛋白获得具有良好的体外抗氧化活性功能多肽的结果相一致。目前国内外采用联用纯化技术较为广泛,贾建萍等[5]将三文鱼皮抗氧化肽段深入纯化分离,获得了纯度较高的功能活性肽段。王雪芹[28]将鲐鱼多肽进行超滤纯化,将超滤后小于2.5 kDa 多肽经过Superdex 75层析获得4个组分,再次经过Sephadex C-25层析获得高体外抗氧化活性产物。舒一梅等[29]将猪股骨超滤后小于5 kDa 分子量滤液经Sephadex G-25 凝胶层析分离,再利用UNO-S 阳离子交换树脂对凝胶层析分离后的活性组分进一步分离,得到2个组分,组分2(1 kDa)的抗氧化活性较组分1(7 kDa)明显提高,这与本研究采用多级纯化获得高抗氧化活性产物的趋势相一致。邹利[30]利用猪骨粉酶解液制备抗氧化活性物质时发现,单纯的猪股骨抗氧化活性与LMPRS(mission planning and restitution system)各有优势,猪股骨酶解物对DPPH·清除率大于MPRS,但OH·清除率小于MPRS,这可能与2种物质中含有不同的化学官能团有关。王晨[31]测定牛骨胶原多肽的体外清除率发现,当活性成分的平均分子量为2.0 kDa时,其清除O2-·作用较强,与Vc的清除率接近,但对DPPH·的清除率明显低于Vc,而本试验获得的鳖甲胶原酶解物对DPPH·、OH·和O2-·的清除率低于Vc。这可能是不同动物来源的骨源多肽活性差异所致,也可能是由于不同分子量的胶原肽的体外抗氧化活性不同,这与Wu 等[32]和Li 等[33]的研究相一致,即胶原肽分子量越小,抗氧化性越强。蛋白分子量大小、构象及氨基酸组成是影响蛋白酶解物抗氧化能力的主要因素[33]。
本研究采用膜分离、凝胶分离、离子交换的联用纯化方法对鳖甲胶原蛋白酶解产物进行一系列分离,获得了具有良好体外抗氧化性的活性产物。但此方法与单一纯化技术相比,耗时偏长,不适用于中试化生产,下一步应探究有效的简便纯化方法。
4 结论
本试验确定了鳖甲胶原蛋白酶解物的适合制备条件为,采用胃蛋白酶酶解,酶解温度35℃、pH值2.5、加酶量4 000 U·g-1,获得的酶解产物经透析、层析等多级纯化获得分子量大小为40 kDa 左右的水解明胶产物,其DPPH·清除率与Vc 无显著差异。本研究为中华鳖背甲制品的研发及抗氧化活性的发挥提供了科学参考。

