广东石豆兰不同溶剂提取物抗氧化及与总黄酮、总酚含量的关系
苗永美 简 兴 汪 雁 徐荣华 钱立生 于庆才
(1安徽科技学院生命与健康科学学院,安徽 凤阳 233100;2安徽科技学院建筑学院,安徽 凤阳 233100)
石豆兰属(Bulbophyllum)为兰科(Orchidaceae)多年生植物,具有发达的横走茎,假鳞茎肉质,卵球型,分散着生在横走茎上,主要分布在广东、广西、福建、浙江、江西、贵州、云南等地。石豆兰全草或假鳞茎均可入药[1],在民间有着悠久的药用和食用历史,在广东沿海及香港、澳门地区常作为伪石斛使用。石豆兰属植物具有抗菌、消炎、抗氧化和抗胆碱脂酶活性等作用[2-3]。此外,吴斌等[4]研究证明广东石豆兰乙酸乙酯提取物和正丁醇提取物对人体肿瘤细胞(Hela)生长有杀伤作用;Xu 等[5]研究证实密花石豆兰中bulbophythrins A(1)和B (2)对人体白血病细胞、肺腺细胞、肝癌细胞和胃癌细胞的生长有抑制作用。生物体进行有氧代谢发生氧化还原反应时,产生的羟基自由基会引发不饱和脂肪酸发生脂质过氧化反应,损伤膜结构及功能并引发各类疾病,超氧离子自由基能损伤蛋白质和核酸等生命大分子,导致各种疾病,同时自由基也是引起机体衰老的原因之一[6]。
植物是人体外源性抗氧化物质的最重要来源,其提取物的抗氧化研究与开发利用日益受到广泛重视。目前已研究了王枣子[7]、文冠果[8]、金花葵[9]等植物不同提取物的抗氧化性及其与有效成分的关系。研究表明,石豆兰属植物含有黄酮、酚酸、菲类、联苄、苯丙素、甾体和挥发性等成分[10-11],与亲缘属石斛属植物相比,石豆兰属植物的研究尚浅,仅在药用成分分离鉴定、提取物药理方面开展过少量研究[2-5,12],对广东石豆兰不同部位极性提取物的抗氧化活性的研究更少。因此,本研究对广东石豆兰甲醇、乙醇、丙酮和乙酸乙酯提取物的抗氧化活性与总黄酮、总酚含量的相关性进行分析,以期明确广东石豆兰抗氧化活性物质,为更好地开发和利用该植物提供科学理论依据。
1 材料与方法
1.1 材料与试剂
石豆兰鲜样,采自福建屏南鸳鸯猕猴自然保护区,经形态学鉴定属于广东石豆兰(B.kwangtungense)。
芦丁标准品(纯度>98%)、没食子酸标准品(纯度>98%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、菲啰嗪均为Sigma 分装试剂,上海伊卡生物技术有限公司。
1.2 主要仪器与设备
DGG-9140B型电热恒温鼓风干燥箱,上海森信试验仪器有限公司;QE-100 中草药粉碎机,浙江屹立工贸有限公司;85-2型恒温磁力搅拌器,上海司乐仪器有限公司;R205B 旋转蒸发器,上海申顺生物科技有限公司;HH 数显恒温水浴锅,金坛市金城国盛试验仪器厂;ThermoHeraeus Multifuge X1R 冷冻离心机、T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 不同溶剂提取物的制备 鳞茎洗净、切成2 mm 左右的薄片,50℃烘干、粉碎,依次过40 目和60目筛,收集干粉备用。精密称取3.0 g 干粉,置于100 mL 圆底烧瓶,按1∶20 料液比分别加入70%甲醇、70%乙醇、乙酸乙酯、丙酮,于70℃回流2次,每次2 h,合并提取液,减压浓缩至约5 mL,室温挥发至干,得4种提取物。以无水乙醇为溶剂,配制1 mg·mL-1的样品原液,4℃密封保存。
1.3.2 总黄酮含量的测定
1.3.2.1 标准曲线绘制 采用Al(NO3)3-NaNO2法[13]。分别吸取0.5、1.0、1.5、2.0、2.5、3.0 mL 0.25 mg·mL-1芦丁标准品溶液于不同试管中,蒸馏水补至5 mL,然后加入0.3 mL 5% NaNO3溶液,摇匀,静置6 min,再加入0.3 mL 10% Al(NO3)3溶液,摇匀、静置6 min,最后加入2 mL 4% NaOH溶液,蒸馏水补齐至10 mL,充分摇匀,静置10 min,于510 nm 波长处测定溶液吸光度值,并绘制标准曲线。
1.3.2.2 总黄酮含量测定 各样品原液稀释10倍,按1.3.2.1的方法测定吸光度值,并通过标准曲线方程计算总黄酮含量,以每克石豆兰含有相当于芦丁的毫克数(mg·g-1)表示。
1.3.3 总酚含量的测定
1.3.3.1 标准曲线绘制 采用福林酚法[14]。分别吸取0、0.2、0.4、0.6、0.8、1.0 mL 0.05 mg·mL-1没食子酸标准品溶液于不同试管中,蒸馏水补至1 mL,然后加入1.2 mL 7.5% Na2CO3溶液,混匀,静置2 min,最后加入1.8 mL 0.1 mol·L-1福林酚,混匀,静置30 min,于765 nm 波长处测定吸光度值,绘制标准曲线。
1.3.3.2 总酚含量测定 各样品原液稀释10倍,按1.3.3.1的方法测定吸光度值,通过标准曲线方程计算总酚含量,以每克石豆兰含有相当于没食子酸的毫克数(mg·g-1)表示。
1.3.4 抗氧化活性的测定 用乙醇配制浓度为1 mg·mL-1的4种提取物母液,稀释成5个浓度梯度(100、200、300、400、500 μg·mL-1),分别编号1~5。样品液的总还原力、DPPH自由基清除能力、羟基自由基清除能力、超氧阴离子自由基清除能力(分别以相应L-抗坏血酸为阳性对照)和Fe2+螯合能力(以EDTA为阳性对照)的测定参考苗永美等[15]的方法。
1.4 数据处理
数据处理及绘图采用Microsoft Office Excel 2010软件,方差分析及多重比较采用SPSS 19.0 软件。
2 结果与分析
2.1 不同溶剂提取物中总黄酮和总酚含量比较
以质量浓度(X)对吸光度值(A)进行绘图、回归分析,得黄酮标准曲线方程A=7.428 6X-0.008 4(R2=0.999 8),线性范围为0.025~0.150 mg·mL-1;没食子酸标准曲线方程A=15.63X-0.010 3(R2=0.998 7),线性范围为0.01~0.05 mg·mL-1。由表1可知,4种溶剂提取物中总酚含量比总黄酮含量高;乙醇提取物中总黄酮含量显著高于其他溶剂(P<0.05),乙酸乙酯提取物中总黄酮含量最低,而甲醇与丙酮提取物中总黄酮含量差异不显著。甲醇和乙醇对总酚提取率较高,显著高于另外2种提取剂,但甲醇与乙醇提取物中的总酚含量差异不显著,乙酸乙酯的总酚提取率最低。由此可知,醇提取尤其是乙醇对2种成分提取效果较好,乙酸乙酯的提取效果较差。
2.2 不同溶剂提取物的抗氧化性分析
2.2.1 总还原力 由图1可知,4种溶剂提取物均具有一定的还原能力,总还原力随溶剂提取物浓度的增加而逐渐增大,总还原力介于0.006~0.427之间,各浓度不同溶剂提取物的总还原力均显著低于阳性对照。将浓度梯度提取物的还原力拟合得到线性方程,计算还原力为0.5时对应的提取物质量浓度(A0.5)。L-抗坏血酸的A0.5为174.87 μg·mL-1,甲醇、乙醇、丙酮、乙酸乙酯提取物的A0.5分别为614.38、578.11、565.75、716.14 μg·mL-1,4种溶剂提取物的总还原力分别为L-抗坏血酸的28.46%、30.25%、30.91%、24.42%。显著性分析表明,同一溶剂提取物浓度下,丙酮提取物的总还原力显著高于其他溶剂,乙酸乙酯提取物的总还原力最弱。

表1 不同溶剂提取物中总黄酮和总酚含量Table1 The content of total flavonoids and total phenols in different solvent extracts /(mg·g-1)
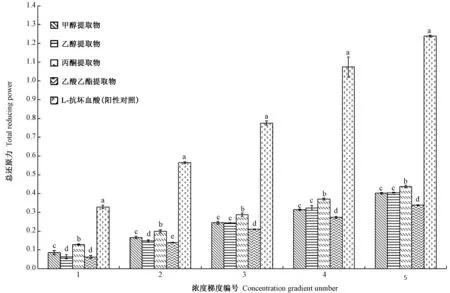
图1 不同溶剂提取物的总还原力Fig.1 Total reducing power of different solvent extracts
2.2.2 DPPH自由基清除能力 由图2可知,4种溶剂提取物对DPPH自由基均有一定的清除能力,清除能力随着溶剂提取物浓度增加逐渐增强。甲醇、乙醇、丙酮、乙酸乙酯提取物对DPPH自由基清除率达到50%时所需的效应浓度(EC50) 分别为293.25、106.22、285.29和59.98 μg·mL-1,4种溶剂提取物清除DPPH自由基能力分别是L-抗坏血酸的6.41%、17.70%、6.59%、31.55%。显著性分析表明,同一溶剂提取物浓度下4种溶剂对DPPH自由基清除能力相互之间差异显著,据EC50乙酸乙酯提取物的DPPH自由基清除能力最强,而甲醇提取物最弱。

图2 不同溶剂提取物的DPPH自由基清除率Fig.2 DPPH free radical scavenging rate of different solvent extracts

图3 不同溶剂提取物的羟基自由基清除率Fig.3 Hydroxy free radical scavenging rate of different solvent extracts
2.2.3 羟自由基清除能力 由图3可知,4种溶剂提取物对羟基自由基均有一定的清除能力,除100 μg·mL-1甲醇提取物的羟基自由基清除力显著高于同浓度的L-抗坏血酸外,其他浓度溶剂提取物组的羟基自由基清除能力均显著低于L-抗坏血酸。4种溶剂提取物的羟基自由基提高清除率均随着溶剂提取物浓度增加其增幅较小,线性方程的斜率反应了羟基自由基清除率的变化幅度,斜率越大变化幅度越大,4种溶剂提取物浓度在100~500 μg·mL-1范围内羟基自由基清除力曲线斜率分别为0.025、0.019、0.025、0.033、0.095,而L-抗坏血酸的斜率为0.179。甲醇、乙醇、丙酮、乙酸乙酯提取物对羟基自由基的EC50分别为1 185.24、2 031.79、2 129.52和1 511.24 μg·mL-1,羟基自由清除率分别为L-抗坏血酸的23.67%、13.81%、13.17%和18.56%。显著性分析表明,同一溶剂提取物浓度下4种溶剂提取物的羟基自由基清除能力相互之间差异显著,甲醇提取物的清除能力最强,丙酮提取物最弱。
2.2.4 超氧阴离子清除能力 由图4可知,4种溶剂提取物对超氧阴离子均有一定的清除作用。甲醇、乙醇、丙酮、乙酸乙酯对超氧阴离子的EC50分别为477.37、490.90、221.38、991.71 μg·mL-1,其超氧阴离子清除能力分别是L-抗坏血酸的35.65%、34.67%、76.88%、17.16%。显著性分析表明,同一溶剂提取物浓度下丙酮提取物的超氧阴离子清除能力最强,显著高于其他3种提取剂,乙酸乙酯提取物最弱。

图4 不同溶剂提取物的超氧阴离子清除率Fig.4 Superoxide anion scavenging rate of different solvent extracts
2.2.5 Fe2+的螯合能力 由图5可知,4种溶剂提取物对Fe2+的螯合能力均随溶剂提取物浓度的增加而逐渐加强,但均显著低于1/10 浓度EDTA的螯合率。甲醇、乙醇、丙酮、乙酸乙酯提取物对Fe2+的螯合率达到50%时(EC50)浓度分别为270.31、363.31、321.68和886.24 μg·mL-1,得出4种溶剂提物物对Fe2+的螯合能力分别是EDTA的1.26%、0.94%、1.06%、0.38%。显著性分析表明,当溶剂提取物浓度介于200~500 μg·mL-1之间,4种溶剂对Fe2+的螯合力相互之间差异显著,甲醇提取物对Fe2+的螯合能力最强,显著高于其他溶剂,乙酸乙酯提取物最弱。
2.2.6 不同溶剂抗氧化活性比较 4种溶剂提取物的抗氧化能力占阳性对照的百分比见表2。综合5个抗氧化指标,4种溶剂提取物的抗氧化活性从大到小依次为丙酮>乙醇>甲醇>乙酸乙酯
2.3 不同溶剂提取物中总黄酮、总酚含量与抗氧化性的相关性分析
设定甲醇、乙醇、丙酮、乙酸乙酯提取物的还原力为0.5时对应的质量浓度为A0.5,DPPH自由基、羟基自由基、超氧阴离子清除率和Fe2+的螯合率为50%时对应的质量浓度分别为EC501、EC502、EC503、EC504,将4种溶剂提取物的A0.5、EC501~4 与其总黄酮、总酚含量进行相关性分析。由表3可知,总黄酮含量与总还原力、超氧阴离子清除率、Fe2+螯合率3个抗氧化指标均呈正相关,与总还原力呈显著相关;除DPPH自由基清除率外,其他4个抗氧化指标与总酚含量呈正相关,但不显著。上述结果表明,总黄酮和总酚均参与了抗氧化体系,总黄酮的抗氧化性更强。总还原力、超氧阴离子清除率与Fe2+的螯合率之间呈正相关关系,但均不显著。

图5 不同溶剂提取物对Fe2+的螯合率Fig.5 Fe2+ Chelating rate of different solvent extracts

表2 不同溶剂提取物的抗氧化能力占阳性对照的百分比Table2 Antioxidant percentage of different solvent extracts in positive control /%

表3 相关性分析结果Table3 Results of correlation analysis
3 讨论
不同生物体产生自由基的种类和机理不同,因此,需要不同的抗氧化剂[16]。药用植物成分种类多,极性不同,溶解性存在差异,需要多种提取溶剂进行分级提取。本研究选用甲醇、乙醇、丙酮和乙酸乙酯4种常用溶剂作为广东石豆兰抗氧化物的提取剂,提取物均为混合物,成分复杂,难以用单一抗氧化指标评价,故采用5种抗氧化评价体系[7,17-19],尽可能全面、客观地评价不同溶剂提取物的抗氧化性。
黄酮类和酚类化合物易溶于极性强的有机溶剂,不易溶于水[20]。本研究所用的4种有机溶剂极性大小顺序为甲醇>乙醇>丙酮>乙酸乙酯,结果表明,4种溶剂对总黄酮和总酚提取效果不同,乙醇提取总黄酮的效果最好,甲醇对总酚的提取效果最好,而乙酸乙酯不利于2种成分的提取,这符合相似相容原理,如左龙亚等[21]用几种溶剂提取柠檬果皮多酚时发现,甲醇作为提取剂时提取率最高,而乙酸乙酯提取多酚的效果差;而李现日等[9]研究表明,乙酸乙酯对金花葵花乙醇提取物中的黄酮萃取效果最好,说明金花葵花黄酮在乙酸乙酯中的溶解性大于乙醇。这可能是因为不同植物内黄酮结构不同,导致其溶解性不同。
不同植物体内抗氧化成分不同,即存在不同的抗氧化体系。白芨醇提物的有效抗氧化活性(清除羟基自由基和DPPH自由基的能力,Fe3+的还原力)成分主要集中在乙酸乙酯和氯仿萃取出来的中等极性物质[22]。金线莲乙醇总提取物依次经石油醚、乙酸乙酯、正丁醇和水萃取得不同极性部位对DPPH自由基、ABTS 自由基和羟基自由基都有不同程度的清除能力,其中乙酸乙酯部位的清除能力最强[23]。许海棠等[24]通过清除DPPH自由基、羟基自由基和ABTS 自由基的能力及还原力评价了青天葵氯仿、乙酸乙酯、正丁醇和乙醇4种提取物的抗氧化性,得出乙酸乙酯提取物抗氧化性最强,乙醇提取物最弱。本研究结果表明,广东石豆兰4种溶剂提取物都具有一定的抗氧化活性,并呈一定的量效关系;不同提取物抗氧化途径不同,甲醇提取物在清除羟基自由基和螯合Fe2+方面效果好;丙酮提取物具有很强的总还原力和清除超氧阴离子自由基能力;乙酸乙酯提取物清除DPPH自由基能力最强。本研究还分析了广东石豆兰提取物抗氧化大小与总黄酮、总酚含量的相关性,结果表明,总黄酮、总酚含量与总还原力相关性最大,尤其总黄酮含量与还原力的相关性达显著水平。此外,2种成分均参与了清除超氧阴离子自由基、螯合Fe2+的两条抗氧化途径;总酚含量与清除羟基自由基的能力呈正相关,说明黄酮和酚是广东石豆兰中重要的抗氧化物质,尤其是黄酮的抗氧化效果更好。潘瑶等[25]比较了葡萄、芒果、草莓乙醇提取物抗氧化活性成分与其抗氧化的关系,发现葡萄提取物中总酚和总黄酮含量最高,其抗氧化性也最强,说明黄酮和酚是多数植物中重要的抗氧化物质。这可能与黄酮和酚结构中得邻位酚羟基很容易被氧化成醌类结构,使得黄酮和酚具有较强的捕捉自由基的能力,从而具有抗氧化活性有关。抗氧化活性强弱与其含量、种类、结构有关[26],且不同植物中黄酮和酚所占的抗氧化地位不同,因此得到不同的研究结果。如张露等[27]对香榧5个部位醇提物的抗氧化性与总酚、总黄酮和缩合单宁含量进行了相关性分析,发现香榧中总酚含量与DPPH自由基、ABTS 自由基清除能力的相关性大。大果榕果实中多酚对DPPH自由基、ABTS 自由基和羟基自由基具有显著的清除活性,并呈质量浓度依赖性[28];萌发青稞中多酚含量与抗氧化性呈显著正相关,是抗氧化性的主要贡献者[29]。本研究发现,有些抗氧化指标如DPPH自由基的清除能力与黄酮、酚含量呈负相关,根据5个指标平均抗氧化能力得出,丙酮提取物的抗氧化活性最强,乙酸乙酯提取物的最弱,而丙酮提取物中黄酮和酚含量并非最高,以上结果均说明提取物中可能还存在其他抗氧化物质,可以清除DPPH自由基,需进一步验证。
4 结论
广东石豆兰体内含有丰富的抗氧化物质,并具有较强的抗氧化能力,其体内的黄酮、酚具有一定的抗氧化能力,但2种物质参与的抗氧体系不同,即便同类物质其抗氧化能力和方式也与已报道的研究结论不同,说明黄酮、酚存在结构多样性,且因不同植物存在较大差异,开展不用植物体内的黄酮、酚等抗氧化物质的提取、生理活性分析、结构鉴定等研究具有重要意义。4种有机溶剂提取物抗氧化能力与总黄酮、总酚含量的相关性分析说明,除了黄酮和酚以外,还有其他重要的抗氧化物质,主要存在于丙酮提取物中,后续可开展抗氧化物质纯品的分离鉴定及其他抗氧化体系的研究。综上,广东石豆兰鳞茎可作为一种天然抗氧化物质来源进行开发利用。

