辣木叶黄酮对采后金桔青霉病的防治及机理研究
陈小丰 任 慧 许 凤 王 靖 孙 朦 王鸿飞
(宁波大学食品与药学学院,浙江 宁波 315211)
金桔[Fortunella margarita(Lour.) Swingle]是金橘属(FortunellaSwingle)的一种小果种,口感酸甜,可全部食用,富含维生素、果胶、钙、磷、铁和类黄酮化合物[1]。金桔作为传统的祛痰、降酒、调节气滞活血、抗抑郁的民间良药,具有良好的药用和食用价值[2-3]。然而,金桔采后生理退化、机械损伤、病原菌感染等,往往会缩短其保质期,造成一定的经济损失,因此柑橘采后病害的控制对于保持其品质和延长货架期至关重要。在金桔采后贮运期间,由意大利青霉(Penicillium italicum)引发的青霉病是金桔最常见的采后病害之一[4],除此之外,意大利青霉还会产生大量的无性分生孢子,容易借助气流传播[5-6]。为了控制这种病原体,目前多采用化学方法控制其采后病害的发生,但考虑到环境健康和食用安全问题以及开发新的杀虫剂以克服病原体所产生抗性的成本[7],化学杀菌剂的使用受到越来越多的限制[8]。因此,寻找安全有效的天然保鲜剂已成为当务之急。
含有活性成分的天然植物提取液因具有优良的抑菌和防腐性能,在采后果蔬保鲜和贮运过程中起着越来越重要的作用[9]。何丽芳等[10]研究发现,芒果皮提取液与羧甲基壳聚糖复合对葡萄的保鲜有明显的效果;另外,Zhang 等[11]对香附根茎精油的抑菌活性及作用机理进行了研究,结果表明,其对金黄色葡萄球菌具有很强的抗菌活性。已有研究表明,植物提取液不仅能够抑制或杀灭真菌,还可以通过去除自由基防止果实细胞膜脂质过氧化,进而保持果实新鲜,延长货架期[12]。辣 木(Moringa oleiferaLam.)为辣 木 科(Moringaceae Martinov)辣木属(MoringaAdans.)多年生热带植物,其叶、种子、根等部位均为民间传统药物。辣木作为一种优质的功能性食品原料,随着其营养和药用价值被逐步发现,目前已成为研究和开发的热点。黄酮类化合物是辣木富含的活性物质之一,作为低分子量天然多酚类次级代谢产物,其对细菌有抑制能力[13],已逐渐被应用于猪肉、果蔬等食品的保鲜,但鲜有文献报道辣木叶黄酮对金桔采后病害的防治作用。本研究通过体外和体内试验,探究辣木叶黄酮对金桔采后青霉病的抑制作用及其机制,以期为辣木叶黄酮的进一步开发利用以及金桔在运贮过程中真菌病害的防治提供理论依据。
1 材料与方法
1.1 材料与试剂
干辣木叶购于深圳惠绿宝辣木生物科技有限公司;意大利青霉(Penicillium italicum)购于西南大学柑橘研究所;金桔购于宁波大学森林果园(十月中下旬采摘),挑选大小、色泽基本一致,无病虫害及机械损伤的果实。
马铃薯葡萄糖琼脂培养基(potato-dextrose agar,PDA)、马铃薯葡萄糖肉汤培养基(potato-dextrose broth,PDB),杭州微生物试剂有限公司;几丁质酶试剂盒、果胶酶试剂盒、苯丙氨酸解氨酶(phenyalnine ammonia-lyose,PAL)试剂盒,南京建成生物工程研究所;芸香叶苷、槲皮苷、槲皮素、山柰酚、染料木苷、木犀草素、异鼠李素标准品,阿拉丁试剂(上海)有限公司;三叶豆苷、儿茶素、忍冬苷、紫云英苷、没食子酸、异槲皮苷、野黄芩素标准品,上海源叶生物科技有限公司;无水乙醇、氯化钠,国药集团化学试剂有限公司。
1.2 主要仪器与设备
DNP-9162型电热恒温培养箱,宁波江南仪器厂;LDZX-50KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;SHZ82型气浴恒温振荡器,金坛市科析仪器有限公司;SW-CJ-2FD型双人单面净化工作台,苏州净化设备有限公司;S-3400N型扫描电子显微镜,日本日立公司;TGL-16型台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;H-7650型透射电子显微镜,日本日立公司;SYNAPTG2型液相色谱、Synapt G2 MS型串联四级杆质谱,美国Waters 公司;TA-XT2i 质构仪,英国StableMicro Systems 有限公司。
1.3 试验方法
1.3.1 辣木叶黄酮制取 辣木叶黄酮的提取参照文献[14]并略作修改。将干辣木叶粉碎过80 目筛,称取一定量辣木叶干粉,按料液比1∶50(w∶v)加入70%乙醇溶液,60℃超声辅助提取90 min,8 000 r·min-1离心10 min,抽滤得上清液,参照文献[15]的方法进行黄酮分离纯化,之后45℃旋转蒸发,得辣木叶黄酮浓缩液,然后将浓缩液冷冻干燥,直至黄酮冻干为粉末,取出后-20℃密封保存备用。取一定量冻干粉,测得黄酮含量为53.14%。
1.3.2 辣木叶黄酮成分分析 采用超高效液相色谱-电喷雾质谱法。称取1 g 冻干粉,加入25 mL 甲醇溶液,超声波处理(60℃,功率150 W)40 min,然后常温离心(10 000 r·min-1,10 min),过0.22 μm 微孔滤膜后上机检测。
1.3.2.1 标准品制备 将各标准品用甲醇溶解定容至刻度,配制标准液,存放于棕色瓶中,待检测。各标准品浓度见表1。

表1 标准样品的浓度Table1 Concentration of standard samples
1.3.2.2 色谱质谱条件 色谱柱:Angilent Zorbax XDB-C18 柱(4.6 mm×150 mm,5 μm),流动相:甲醇(A)和0.1%甲酸溶液(B),流速0.8 mL·min-1,进样量10 μL,柱温25℃,检测波长254 nm。线性梯度洗脱程序:0~5 min,70%~30% A;5~18 min,30%~10%A。离子源ESI 扫描范围100~1 200m/z,毛细管电压2.50 kV,锥孔电压50.00 V,锥孔气流量50 L·h-1,提取电压2.00 V,离子源温度125℃,脱溶剂气温度250℃,脱溶剂气流量400 L·h-1。
1.3.3 孢子悬浮液的制备 利用于PDA 斜面上保存的意大利青霉菌[16],参照Bill 等[17]的方法制备孢子悬浮液。将斜面菌种接于PDA 平板上,28℃活化5 d,然后用无菌生理盐水将平板上的孢子洗出,通过8层纱布过滤除去菌丝等,并配成1×106个·mL-1的孢子悬浮液(血球计数板计数),随用随配。
1.3.4 辣木叶黄酮对意大利青霉菌体外生长的抑制作用
1.3.4.1 孢子萌发率测定 参考文献[18]的方法,并略作修改。取2 mL 1×104个·mL-1意大利青霉孢子悬浮液,加入2 mL PDB 培养基,再加入辣木叶黄酮至终浓度分别为0.5、1、2、4、8、16和32 mg·mL-1,以未加辣木叶黄酮处理为对照。于28℃、200 r·min-1条件下摇培20 h 后显微镜观察统计萌发的孢子数,每个平行至少观察200个孢子,每个处理设置3个平行。
1.3.4.2 菌丝生长抑制能力测定 采用琼脂稀释法[19]测定辣木叶黄酮处理后意大利青霉菌丝生长的情况。将PDA 培养基倒入已灭菌培养皿,将适量纯化后的辣木叶黄酮粉末用20%乙醇溶液溶解,并用蒸馏水稀释后添加到PDA 培养基中,得到辣木叶黄酮浓度依次为0、0.5、1、2、4、8、16和32 mg·mL-1的PDA 培养基。用灭菌的打孔器在长有意大利青霉的培养基上取直径为6 mm 菌饼置于含有辣木叶黄酮的培养基的中心处。将培养基置于28℃孵育48 h,每个处理设置6个平行。按照公式计算菌丝生长抑制率(mycelial growth inhibition,MGI):

式中,dc为对照组的平均菌落直径,mm;dt为处理组的平均菌落直径,mm;di为菌饼的初始菌落直径,mm。
培养48 h 后,完全抑制真菌生长的最低浓度被认为是最小抑菌浓度(minimum inhibitory concentration,MIC)。培养72 h 后,完全抑制真菌生长的最低浓度被认为是最低杀菌浓度(minimum fungicidal concentration,MFC)[20-21],表明此时原始接种物的杀灭率超过99.5%。
1.3.4.3 扫描电镜(scanning electron microscopy,SEM) 观察和透射电镜(transmission electron microscope,TEM)观察 扫描电镜根据文献[22]、透射电镜根据文献[23]的方法并略作修改。吸取孢子悬浮液分别注入PDB 培养基中,摇床(120 r·min-1,28℃)培养48 h 后挑取菌丝球,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)缓冲液(0.1 mol·L-1,pH值7.4)冲洗菌丝球,此后置于辣木叶黄酮终浓度分别为MIC和MFC的处理液中各处理6 h,以PBS溶液作为对照。然后置于3%戊二醛溶液中过夜(4℃),再用PBS 缓冲液洗脱,每次15 min,重复3次,经系列浓度乙醇(体积分数为30%、50%、70%、80%、90%、100%)逐级洗脱样品,每次间隔10 min,其中100%乙醇脱水2次。叔丁醇与无水乙醇逐级(比例分别为1∶3、1∶1、3∶1)洗脱样品,每次脱水10 min,最后用纯叔丁醇洗脱1次。经过干燥、粘样、镀膜后于扫描电子显微镜下观察、拍照,每个样品取3个平行。按照上述步骤处理样品,经乙醇梯度洗脱后,用无水丙酮洗脱4次,每次15 min,经包埋烘干后进行超薄切片,于透射电子显微镜下观察、拍照。每个处理设置3个平行。
1.3.5 辣木叶黄酮对金桔采后青霉病的防治效果
1.3.5.1 辣木叶黄酮溶液配制 取适量纯化后的辣木叶黄酮粉,用蒸馏水溶解至终浓度分别为1、4、8、12 mg·mL-1,以蒸馏水为对照。
1.3.5.2 样品处理 参照Sellamuthu 等[24]的方法并略作修改。将金桔放置于2%(v:v)的次氯酸钠溶液中浸泡2 min 后,取出晾干。将金桔随机分为5组,然后用灭菌不锈钢钉子于果实赤道部刺孔1个(深4 mm,直径3 mm),用微量移液器分别向每孔中注入10 μL 浓度依次为1、4、8、12 mg·mL-1辣木叶黄酮溶液和无菌水,自然风干后接入10 μL 意大利青霉孢子悬浮液。晾干后,将这些样品放入恒温恒湿培养箱(温度20±1℃,相对湿度75%)中,模拟零售环境。在贮藏0、2、4、6 d时测定菌斑直径(mm)。每组处理15个果实,设置3个平行,试验重复3次。
1.3.5.3 果皮硬度测定 采用质构仪进行测定。探头(SMSP/6)直径为5 mm。下压距离为5 mm,下压速度为1 mm·s-1,取最大值,每个金桔果实分别测定阴阳面赤道部位,每组处理15个果实,结果取平均值。
1.3.5.4 防御相关酶活测定 选取处理后的15个金桔果实,经0、2、4和6 d 贮藏后取果实病斑周围2~10 mm的果皮组织,经液氮速冻研磨成粉后于-80℃冰箱冷冻保存。按照试剂盒说明书进行几丁质酶、果胶酶、苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)等相关酶活性的测定。其中,粗酶液的制备参考文献[25]的方法进行,粗酶液中蛋白质含量采用Bradford法[26],使用考马斯亮蓝试剂盒测定。
1.4 数据分析
采用SAS 8.1 软件的One-way ANOVA 分析所得数据,差异显著分析用Duncan′s multiple range test 进行多重比较(P<0.05表示差异性显著),采用Origin Pro 9.0 软件制图。
2 结果与分析
2.1 辣木叶黄酮成分分析
由图1可知,在配制的14种标准品中,辣木叶黄酮只含有其中2种成分,分别为槲皮苷和异槲皮苷。由图1-A可知,m/z=463.09的质谱峰是异槲皮素标准品准分子离子[M-H]-,出峰时间为7.23 min,峰面积为6 432.44。由图1-B可知,m/z=447.09的质谱峰是槲皮素标准品准分子离子[M-H]-,出峰时间为8.00 min,峰面积为4 883.35。
由表2可知,辣木叶黄酮中所含黄酮成分主要为槲皮苷(黄酮类)和异槲皮苷(黄酮醇类)。其中异槲皮苷含量高达314.960 mg·L-1,槲皮苷含量为158.652mg·L-1。

图1 辣木叶样品的超高效液相色谱-电喷雾质谱图(254 nm)Fig.1 HPLC-EIS-MS of the samples in Moringa oleifera leaves at 254 nm

表2 辣木叶中黄酮的主要成分Table2 The main compounds of flavonoids in Moringa oleifera leaves
2.2 辣木叶黄酮对意大利青霉菌体外生长的抑制作用
2.2.1 辣木叶黄酮对孢子萌发的影响 由图2可知,不同浓度的辣木叶黄酮对意大利青霉孢子的萌发均有显著抑制作用(P<0.05),抑制效果随着辣木叶黄酮浓度的增加而增强。当辣木叶黄酮浓度大于8.0 mg·mL-1时,意大利青霉孢子的萌发率为0,表明此浓度下的辣木叶黄酮完全抑制了意大利青霉孢子的萌发。
2.2.2 辣木叶黄酮对菌丝生长抑制能力测定 由表3可知,辣木叶黄酮对意大利青霉的菌丝生长的抑制作用呈现一定的剂量效应。培养48 h时,4 mg·mL-1辣木叶黄酮已经完全抑制了意大利青霉菌丝的生长;培养72 h时,8 mg·mL-1剂量表现出对意大利青霉菌丝的完全抑制。因此,辣木叶黄酮对意大利青霉的MIC和MFC 分别为4 mg·mL-1和8 mg·mL-1。
2.2.3 SEM 观察辣木叶黄酮对意大利青霉菌丝形态的影响 由图3可知,辣木叶黄酮对意大利青霉的菌丝有一定的影响。对照组的样品菌丝排列规则且均匀,直径恒定,呈现出正常和完整的管状结构,且菌丝体表面光滑。而经MIC和MFC 浓度辣木叶黄酮处理的意大利青霉的菌丝在菌丝体形态上表现出较大变化。其中,MIC处理组菌丝表面皱缩且粗糙不平,菌丝已受损。MFC处理组菌丝体皱缩度加深,损伤程度较MIC处理组更严重,菌丝出现皱褶、塌陷、折叠,且细胞质已外流,甚至严重崩解。

表3 辣木叶黄酮对意大利青霉菌丝生长的抑制Table3 Effects of flavonoids from leaves of Moringa oleifera on mycelium of Penicillium italicum

图2 辣木叶黄酮对意大利青霉孢子萌发的影响Fig.2 Effects of flavonoids from leaves of Moringa oleifera on the germination of Penicillium italicum
2.2.4 TEM 观察辣木叶黄酮对意大利青霉内部形态的影响 由图4可知,对照组的菌丝结构规则,质膜和细胞壁完整,细胞器如线粒体清晰正常(图4-A 字母M所示)。经辣木叶黄酮处理后的意大利青霉菌的菌丝体内部形态变化较明显,MIC处理组的菌丝内部结构受到不同程度的损坏,质膜脱离细胞壁(图4-B箭头2所示),细胞膜受损甚至消失(图4-B箭头1所示)。所有的细胞器均变得模糊不清,有些细胞器甚至消失,内部出现空洞。而MFC处理组变化更明显,受损程度更严重,胞内空洞化(图4-C箭头3所示),已无完整的细胞器存在,胞质外流(图4-C箭头4所示),细胞已死亡。上述结果表明,辣木叶黄酮能破坏意大利青霉内部细胞器,导致其死亡。
2.3 辣木叶黄酮对金桔采后病害的防治作用
2.3.1 辣木叶黄酮对损伤接种意大利青霉的金桔果实硬度的影响 由图5可知,随着贮藏时间的延长,金柑果皮硬度均呈现下降趋势,但不同浓度辣木叶黄酮处理组金桔与CK 金桔的下降幅度不尽相同。在贮藏期结束时,果实硬度下降明显,但12 mg·mL-1辣木叶黄酮处理组仍保持较高的硬度(21.96 N),其次是8 mg·mL-1辣木叶黄酮处理组(14.69 N),CK的硬度值最低(9.97 N),显著低于不同浓度辣木叶黄酮处理组。说明辣木叶黄酮能够有效延缓金桔染病后果皮硬度下降的速率。
2.3.2 辣木叶黄酮对损伤接种意大利青霉的金桔果实菌斑直径的影响 由图6可知,贮藏期间金柑的菌斑直径均呈现上升趋势,经辣木叶黄酮处理后的金桔的菌斑直径均低于CK。贮藏第6天时,各浓度辣木叶黄酮处理组的菌斑直径均显著低于CK,12 mg·mL-1辣木叶黄酮处理组的菌斑直径为25.42 mm,1、4、8 mg·mL-1辣木叶黄酮处理组之间的病斑直径无显著差异。结合图7可知,辣木叶黄酮处理能够有效抑制青霉菌在金桔果实上的生长,对金桔果实采后病害具有一定的防治作用。

图3 扫描电镜观察意大利青霉菌丝形态变化Fig.3 The morphological alteration of Penicillium italicum hyphae observed by SEM

图4 透射电镜观察意大利青霉菌丝内部形态变化Fig.4 Internal morphological alteration of Penicillium italicum hyphae observed by TEM

图5 辣木叶黄酮对金桔果皮硬度的影响Fig.5 Effects of flavonoids from leaves of Moringa oleifera on firmness of kumquat peel
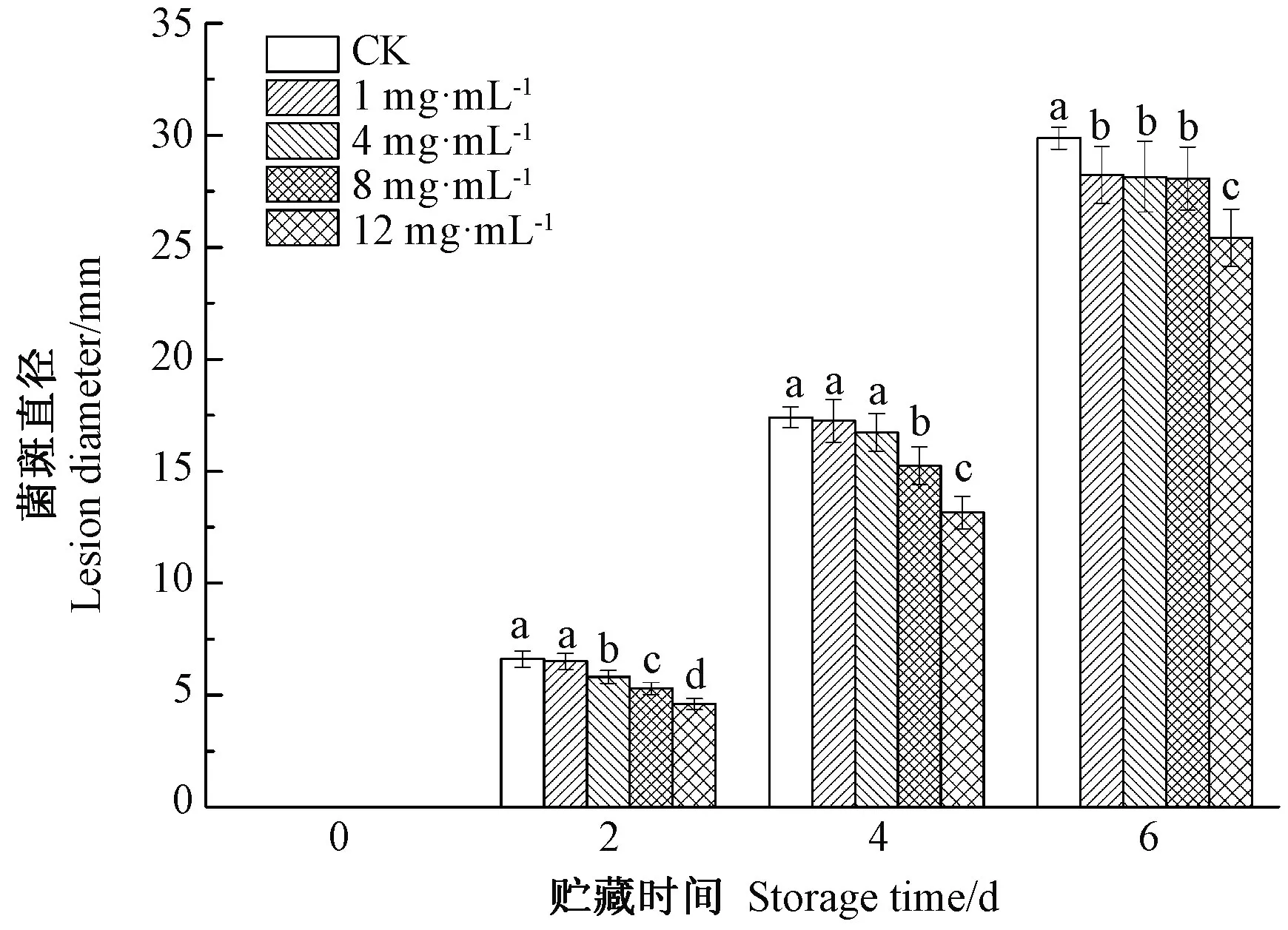
图6 辣木叶黄酮对金桔伤口菌斑直径的影响Fig.6 Effects of flavonoids from leaves of Moringa oleifera on lesion diameter of kumguat wounds

图7 辣木叶黄酮对金桔青霉病的抑制效果(第6天)Fig.7 Inhibitory effects of flavonoids from leaves of Moringa oleifera on blue mold of kumquat after 6 days
2.3.3 辣木叶黄酮对金桔防御酶系的影响 由图8可知,辣木叶黄酮对金桔防御酶系具有一定的影响。在各贮藏期间,与CK相比,辣木叶黄酮处理组对相关防御酶活具有不同程度的影响。在贮藏第2、第4和第6天时,果胶酶一直呈现上升趋势,在贮藏期第4和第6天时,12 mg·mL-1辣木叶黄酮处理组果胶酶活性显著低于其他处理组(图8-A),显著抑制了果胶酶的活性(P<0.05)。PAL活性在贮藏前4 d 一直处于上升趋势,相对于CK,4、8和12 mg·mL-1辣木叶黄酮处理组PAL活性显著上升,特别是高浓度辣木叶黄酮处理组更加明显;在贮藏第6天时,PAL活性出现下降,但12 mg·mL-1辣木叶黄酮处理组PAL活性一直显著高于他各组(图8-B)。而几丁质酶活性在整个贮藏过程中一直呈现上升趋势,其中8、12 mg·mL-1辣木叶黄酮处理组一直与其他各组存在显著差异(P<0.05),且显著高于CK(图8-C)。
3 讨论
研究表明,黄酮通过作用真菌细胞膜及呼吸代谢来发挥抑菌作用[27],蜂胶及其活性化合物松曲菌素可通过抑制意大利青霉的能量平衡和细胞膜的完整性来抑制其菌丝的生长[28]。此外,Jabeen 等[29]指出辣木叶黄酮的抗菌活性与亲脂性化合物有关,它可能与细胞质膜结合,改变真菌细胞膜透性,延缓其生长。本研究结果表明,辣木叶黄酮对意大利青霉菌丝的生长有抑制作用,且满足剂量效应关系。经过不同浓度的辣木叶黄酮处理,菌丝收缩,形成粗糙的表面,出现严重扭曲和凹陷现象。此外,超微结构发现菌丝细胞膜受损,胞质外流,细胞器受到不同程度的损伤。推测可能是黄酮类化合物对病原体细胞质膜具有干扰作用,从而导致膜流动性的变化,随后使某些细胞内的营养物质流出,最终导致细胞死亡[30]。
硬度是衡量果实品质的重要指标,辣木叶黄酮对金桔硬度的保持具有显著的效果。本研究中,辣木叶黄酮可能作为屏障,减少了金桔中乙烯的产生,从而提高膜的完整性并保持其坚韧性。本研究中对照组金桔果皮硬度下降,这与Tesfay 等[16]的结果相似,可能与细胞壁结构减弱、膜完整性丧失、纤维素和半纤维素的水解以及果胶和淀粉的解聚有关,其中纤维素和半纤维素的水解、果胶和淀粉的解聚是由聚半乳糖醛酸酶、果胶甲基酯酶、果胶裂解酶等酶的催化导致的[31]。果品若在销售阶段出现硬度下降,会对其品质造成不利影响[32],研究发现植物提取物对果实品质的保持具有良好的效果。戴鹏辉等[33]研究发现紫苏提取物能延缓越橘品质下降,与本试验中辣木叶黄酮有相似的作用。研究表明,果胶酶活性的增加会加快果实软化[34]。本试验发现,与对照组相比,4、8、12 mg·mL-1辣木叶黄酮处理组的果胶酶活性明显较低,说明较高浓度的辣木叶黄酮能抑制果胶酶的活性,使果实保持一定的硬度。这可能是因为辣木叶黄酮直接与果胶结合,防止了果胶酶进入细胞壁的基底,有效保护了果实的细胞壁,从而使其具有一定的硬度[35]。
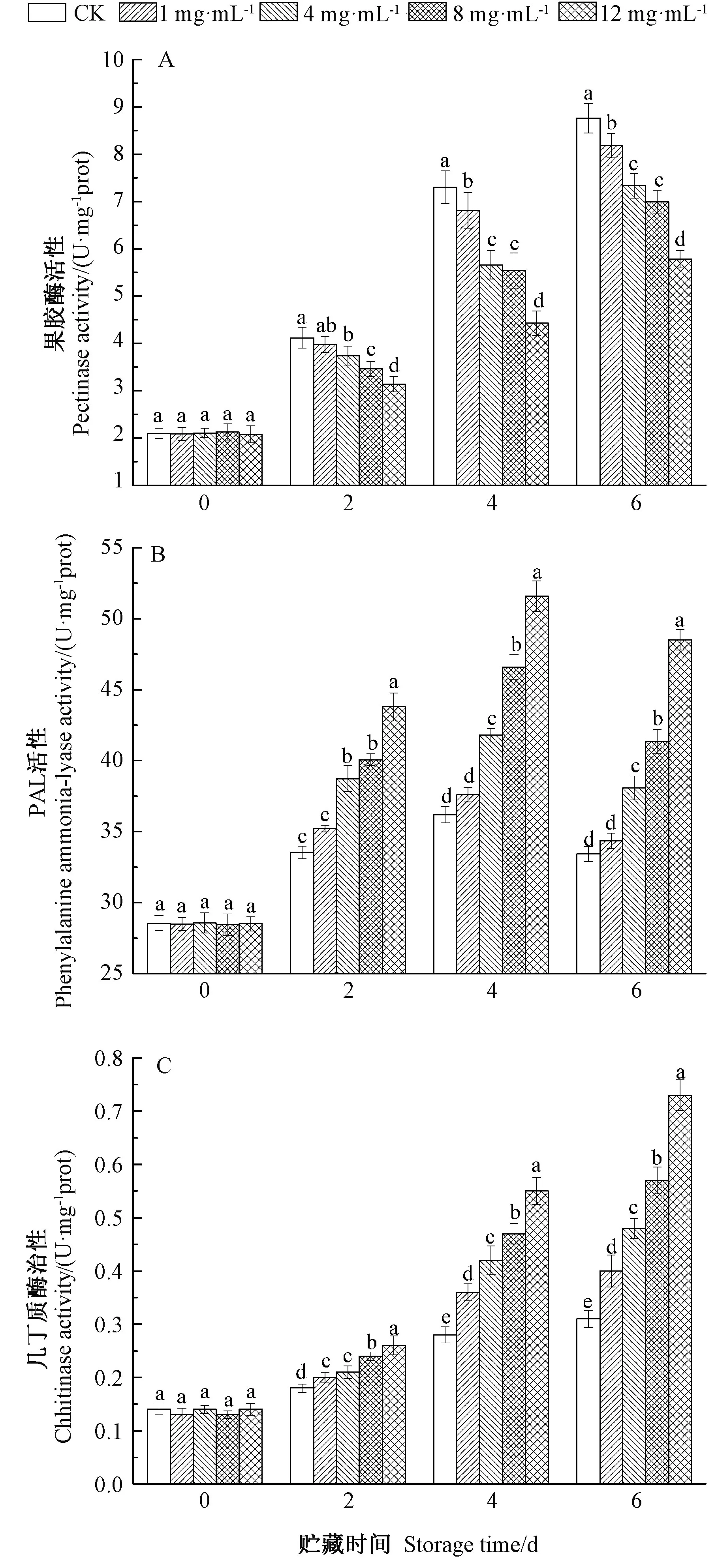
图8 辣木叶黄酮对金桔防御相关酶的影响Fig.8 Effects of flavonoids from leaves of Moninga oleifera on active of defence response-related enzymes of kumquat
采后水果的抗病性与病程相关蛋白有关。在病程相关蛋白中,几丁质酶与植物抗病性密切相关,被认为是植物抗真菌侵染的关键物质[17]。辣木叶黄酮能显著诱导金桔中的几丁质酶活性的升高,抑制果实腐烂。本研究结果表明,辣木叶黄酮能够延缓金桔青霉病发病进程,保护细胞膜的完整结构和正常功能。这些作用都有助于提高金桔果实组织抵御青霉入侵的能力,减缓意大利青霉的传播,这与张美丽[36]的研究结果具有相似性。PAL是苯丙烷类代谢途径的关键酶,其活性与酚类化合物的合成密切相关。PAL是植保素、木质素和酚类化合物合成的关键酶,对植物生长发育、抵御病虫害、防紫外辐射及构成植物交撑系统等方面有重要意义,当果实被诱导后PAL活性明显增强[37]。本研究发现辣木叶黄酮在初期提高了PAL活性,有助于提高果实的抗菌能力,延长货架期。
4 结论
本研究结果表明,辣木叶黄酮能够破坏意大利青霉菌的细胞结构,导致内容物外漏,胞内细胞器损伤,出现空洞化,进而抑制意大利青霉的生长,抑制采后青霉病的发生。本研究着重揭示了几丁质酶和PAL活性的增加,从而增强金桔对意大利青霉的抵抗能力,表明辣木叶黄酮可以作为一种极具潜力的生物杀真菌剂。考虑到辣木叶黄酮在病害防治中的重要作用,应进一步研究辣木叶黄酮抑制意大利青霉的作用机理。

