微生物分解2-羟基吡啶的研究进展
陆 鹏, 刘爱民
(安徽师范大学 生命科学学院 重要生物资源保护与利用研究安徽省重点实验室, 芜湖 241000)
吡啶及其衍生物是芳香杂环类有机化合物的重要代表,是生物碱、吡哆醇、烟酰胺等辅酶的天然组成部分;也是重要的工业原料,广泛应用于化工、医药、农药、石油、农产品加工等行业,对人类经济社会的发展有着重要意义[1-2]。然而长时间的大量使用,导致这些吡啶类化合物不可避免的进入土壤、水体、空气等环境中,并长期残留,造成严重的环境污染[3]。吡啶及其衍生物具有很强的挥发性、水溶性和毒性[4],并具有致癌、致畸性,因此被美国环保署列为优先等级污染物[5]。人体接触后会产生抑郁、恶心、头痛、肝肾损伤等不良反应,造成严重的健康问题[4]。因此消除残留的吡啶及其衍生物,修复被污染的环境是当下亟须解决的问题。生物分解具有成本低,效率高且无二次污染等优点,是消除环境中吡啶残留的有效方法[6]。
2-羟基吡啶(2-HP)是一种常见的吡啶衍生物(图1),也是含N杂环类物质生物分解的核心中间代谢产物[7-8]。多项研究表明,吡啶生物分解的关键步骤是形成羟基吡啶,然后再进一步分解[9-11]。除此之外,2-HP也是尼古丁、3,5,6-三氯-2-吡啶酚(TCP)等剧毒化合物分解的中间产物[12-13]。因此研究2-HP的生物分解,对吡啶类污染物及相关的剧毒化合物的生物修复具有重要意义。本文从2-HP分解菌的种质资源,代谢途径、分解基因和关键酶等方面综述其生物分解的研究进展,并对后续研究做出展望。
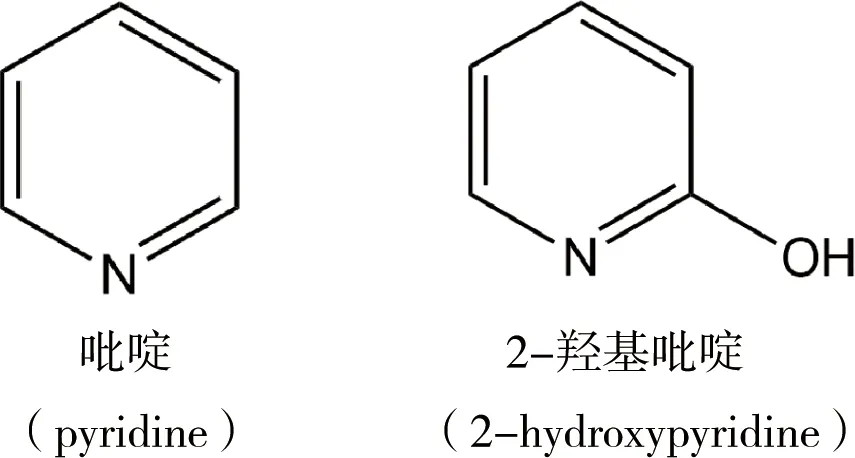
图1 吡啶及2-羟基吡啶结构式
1 分解2-HP的微生物
微生物是2-HP自然分解的主要动力。Ensign分离到一株能以2-HP作为唯一碳源和氮源生长的细菌Arthrobactercrystallopoietes,在分解2-HP过程中,会使培养基产生蓝色—紫色—橙色的颜色变化,推测这些有色物质是2-HP分解的产物[14]。Houghton分离获得一株能在含有2-HP的基础盐培养基上生长的细菌Achromobactersp. G2,该菌株可在48 h内氧化分解浓度为1000 mg/L的2-HP,并以其为生长的唯一碳源、氮源及能量来源[15]。
Zefirov等分离到一株细菌Rhodococcusopacus,可以1.5 g/L 吡啶为唯一碳氮源生长,并在48 h对产生的2-HP进一步开环分解[16],这株细菌除了能分解2-HP外,也可以分解吡啶。Bondareva等从污染土壤中分离到3株2-HP分解细菌,可分解浓度达2000 mg/L,菌株分属Rhodococcusrhodochrous、A.crystallopoietes两类,其中的菌株R.rhodochrousPY11经后续研究,发现其也具有分解吡啶的能力[17]。Semenaite等从被吡啶重度污染的土壤中分离到18株2-HP分解细菌,其中有4株可以同时利用吡啶作为碳源[18];类似的还有菌株Arthrobactersp. KM-4,也同时具有分解吡啶和2-HP的能力[9]。这也说明了2-HP是吡啶分解的重要中间代谢产物。
目前已知的2-HP分解细菌,还有一部分是不能分解吡啶,或是没有明确是否有分解吡啶能力的。如Arthrobacterpyridinolis、Arthrobacterviridescens[19]、Arthrobactersp. IN13[20]、Burkholderiasp. MAK1[21]等。Lu分离获得的TCP分解菌Cupriavidussp. DT-1,可分解TCP产生2-HP,并进一步矿化分解[13]。这一类分解菌均可以2-HP作为唯一碳源和氮源生长,并裂解吡啶环,达到矿化2-HP的目的。
2 2-HP的生物分解途径研究进展
第一类分解途径为二羟基吡啶(DHP)途径,此类途径的共同特点是2-HP通过一个位点的羟基化,形成2,X-DHP后,随即开环分解。Houghton等研究发现分解菌Achromobactersp. G2可将2-HP转化为2,5-二羟基吡啶(2,5-DHP),再进一步氧化分解,生成CO2、NH3和水[15]。Cain进一步研究菌株G2对2-HP的分解途径,发现2,5-DHP是经马来酸途径分解,吡啶环裂解后形成甲酸盐和马来酰胺酸(maleamic acid),检测到的终产物为反丁烯二酸(fumaric acid),见图2-a[22]。在后续的研究中,Burkholderiasp. MAK1[21]、Agrobacteriumsp. DW-1[6]等多种微生物内发现了这条分解途径。综合来看,目前发现存在此途径的分解菌均为革兰氏阴性细菌。
菌株R.opacus分解2-HP,产生2,6-二羟基吡啶(2,6-DHP),再进一步开环分解为3-戊烯酸单酰胺(5-amino-5-oxo-2-pentenoic acid),具体见图2-b。菌株A.crystallopoietes分解2-HP,会形成2,3-二羟基吡啶(2,3-DHP),开环后检测到的终产物为琥珀酸半醛(succinic semialdehyde),具体见图2-c[16]。
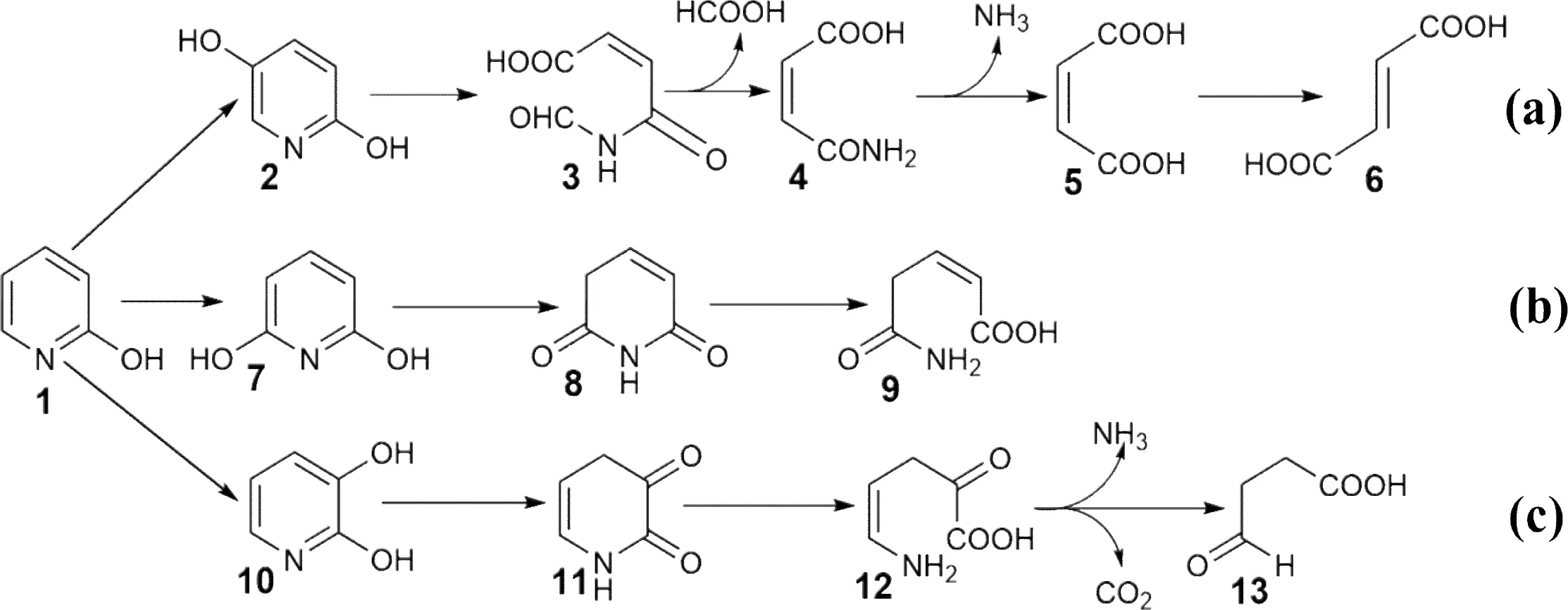
(1) 2-HP; (2) 2,5-DHP; (3) N-formylmaleamic acid; (4) maleamic acid; (5) maleic acid; (6) fumaric acid; (7) 2,6-DHP; (8) 1,3-dihydropyridine-2,6-dione; (9) 5-amino-5-oxo-2-pentenoic acid; (10) 2,3-DHP; (11) 1,4-dihydro-pyridine-2,3-dione; (12) 5-amino-2-oxo-4-pentenoic acid; (13) succinic semialdehyde
图2 二羟基吡啶途径[16,21]
Figure 2 Pathways of dihydroxypyridine for 2-hydroxypyridine[16,21]
第二类分解途径为三羟基吡啶(THP)途径。2-HP通过两个位点的羟基化产生2,3,6-三羟基吡啶(2,3,6-THP),然后再开环分解。但2,3,6-THP不稳定,会自发的氧化聚合,生成一种蓝色化合物——尼古丁蓝(nicotine blue pigment),具体见图3-d,所以通过尼古丁蓝的形成可以判断2,3,6-THP的产生[23]。Nocardiasp.(PNO)分解2-HP产生2,5-DHP,再羟基化产生2,3,6-THP,然后以THP的形式进入马来酸途径,生成反丁烯二酸,再转化为丙酮酸(图3-e)[24]。Arthrobactersp. KM-4分解2-HP,先羟基化生成2,3-DHP,再产生蓝色化合物,最终产物为琥珀酸半醛(图3-f)[9];R.rhodochrousPY11将2-HP转化为顺式-5,6-二氢-5,6-二羟基-2-羟基吡啶[cis-5,6-dihydro-5,6-dihydroxy-2-pyridone],再氧化为2,3,6-THP后开环分解,最终产物为铵离子和α-酮戊二酸(α-ketoglutarate),具体见图3-g[8],另外还有Arthrobactersp. IN13[20];Arthrobactersp. PY22[18]等。这类细菌在分解2-HP的过程中,均可检测到蓝色的中间产物,意味着它们都以2,3,6-THP作为代谢的中间体,区别在于形成2,3,6-THP的过程不同;并且吡啶环裂解之后的反应有所差别。总体来看,具有这类代谢途径的分解菌基本都是革兰氏阳性细菌。
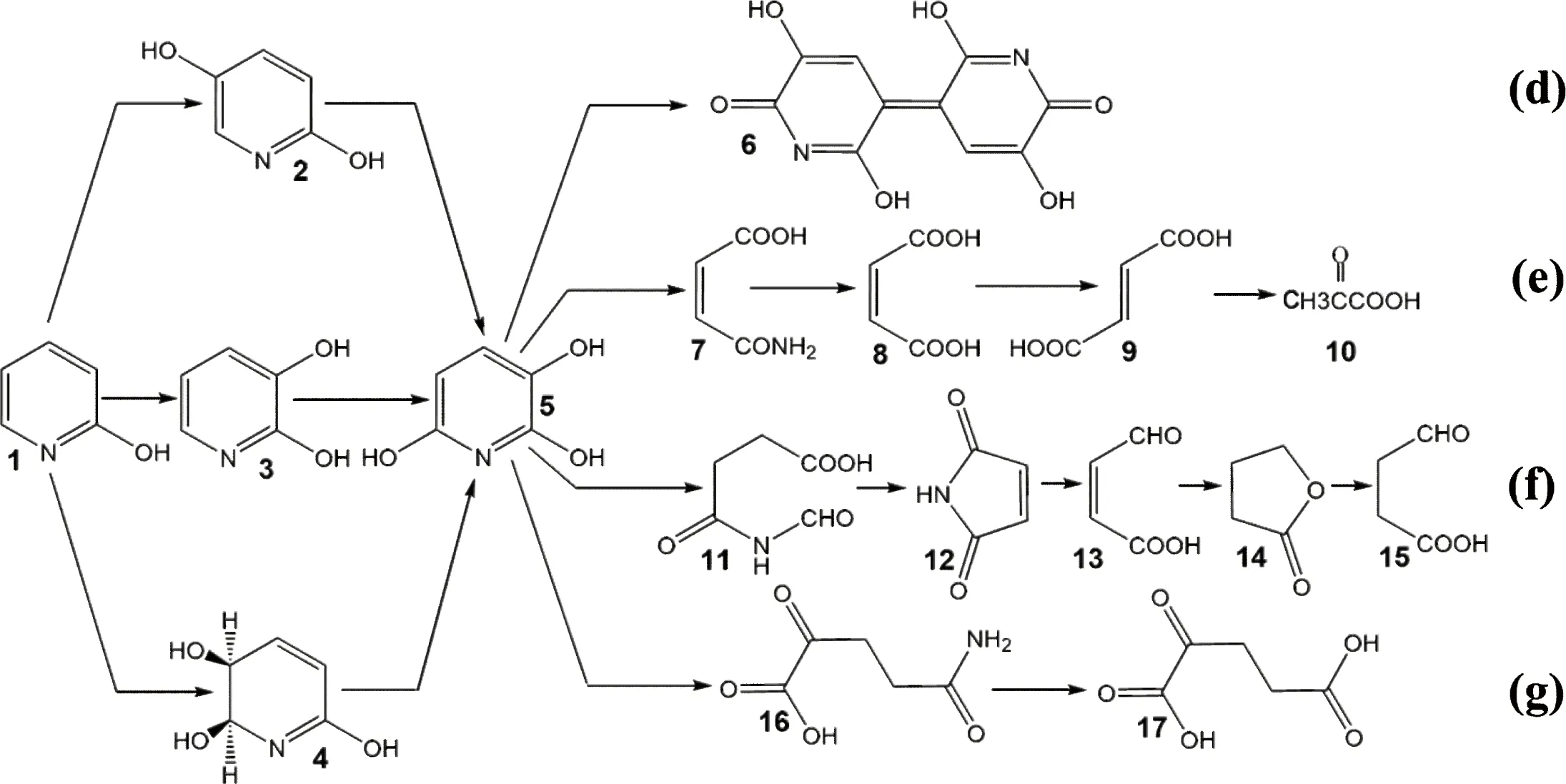
图3 三羟基吡啶途径[8-9,24]
(1) 2-HP; (2) 2,5-DHP; (3) 2,3-DHP; (4) cis-5,6-dihydro-5,6-dihydroxy-2-pyridone; (5) 2,3,6-THP; (6) nicotine blue pigment; (7) maleamic acid; (8) maleic acid; (9) fumaric acid; (10) pyruvic acid; (11) 4-formamido-4-oxobuta-noic acid; (12) 1-hydropyrrole-2,5-dione; (13) 4-oxobut-2-enoic acid; (14) γ-butyrolactone; (15) succinic semialdehyde; (16) 2-ketoglutaramate; (17) α- ketoglutarate
3 微生物分解2-HP机制研究进展
Tang等从菌株PseudomonasputidaS16中克隆到一个基因簇nic2,其中包含4个与2,5-DHP转化相关的基因:2,5-DHP双加氧酶基因(hpo)、N-甲酰马来酸酰胺去甲酰酶基因(nfo)、马来酰胺酸脱酰胺酶基因(ami)、马来酸异构酶基因(iso),编码的酶分别催化2,5-DHP到反丁烯二酸的4步反应[25]。菌株PseudomonasputidaKT2440中的基因nicX、nicD、nicF及nicE也具有相同的功能[26],Yao等研究认为,NicX和Hpo同属一个环裂解双加氧酶家族,该家族基因为Fe(Ⅱ)依赖型。其中Hpo和Nfo协同作用,将2,5-DHP转化为马来酰胺酸[7]。除此之外,菌株Ochrobactrumsp. strain SJY1中发现的4个基因vppE、vppF、vppG及vppH[12];Alcaligenessp. strain P156中的naaD、naaE、naaF和naaG[27];AlcaligenesfaecalisJQ135 中的picD、picE、picF及picG编码的酶也都具有相同的功能,且对应的基因之间有高度的相似性[28]。
Stanislauskiene 等用穿梭载体pRMU824Km对Arthrobactensp. PY22中的2-HP分解基因进行筛选,获得一个6 kb的DNA片段。序列分析表明,其中的hypB可能编码一种单加氧酶、与hypD基因的编码产物共同参与了2-HP分解之初的羟基化反应[29]。Petkevicius利用转座质粒plasposon pTnMod-OKm插入突变的方法,从Burkholderiasp. MAK1中克隆到一个基因簇hpd,里面包含2-HP分解的全套基因。由hpdA、hpdB、hpdC、hpdD和hpdE5个基因构成的基因簇编码2-羟基-5-单加氧酶,催化反应第一步,由2-HP生成2,5-DHP;随后由hpdF编码的双加氧酶HpdF催化开环分解,通过马来酸途径,在HpdG、HpdH及HpdI的逐步催化下,最终生成反丁烯二酸(图4)。各个酶与菌株P.putidaS16及Ochrabactrumsp. strain SJY1中鉴定出的与马来酸途径反应相关的酶功能类似,对应的基因hpdF、hpdG、hpdH和hpdI也与该两株菌中的4个基因具有高度相似性[30]。
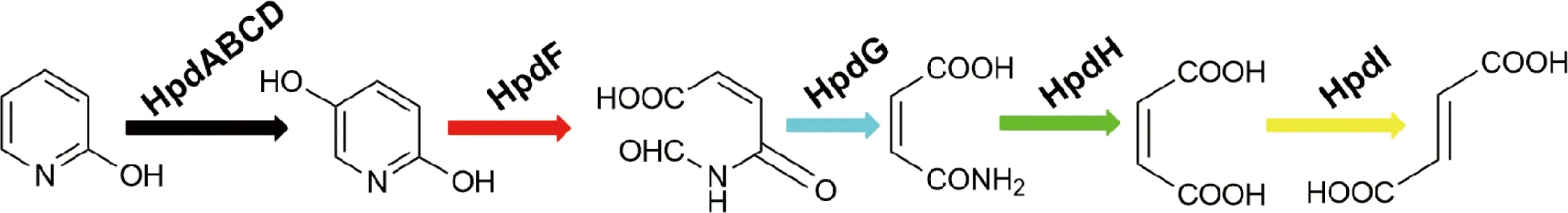
图4 菌株MAK1中Hpd对2-羟基吡啶的分解作用[30]
Vaitekunas从菌株R.rhodochrousPY11中鉴定出一个由12个基因构成的分解2-HP的操纵子并对其中的各功能基因和表达产物进行鉴定,基因簇hpoBCDF编码一种4组分双加氧酶HpoBCDF,其中的HpoB、HpoC及HpoF分别与环羟基化双加氧酶的构成组分铁氧还蛋白、α大亚基、铁氧还蛋白还原酶的氨基酸序列高度相似;而HpoD与HpoC可形成复合物,故推测其是双加氧酶系统的一个小亚基。HpoBCDF构成了催化2-HP氧化的双加氧酶系统,可将2-HP氧化为顺式-5,6-二氢-5,6-二羟基-2-羟基吡啶。HpoE(脱氢酶)进一步将其氧化为2,3,6-THP,再在一种新型水解酶HpoH(THP水解酶)的催化下开环形成2-酮戊二酸酰胺,随后被HpoI(ω-酰胺酶)转化为α-酮戊二酸(图5)[8]。
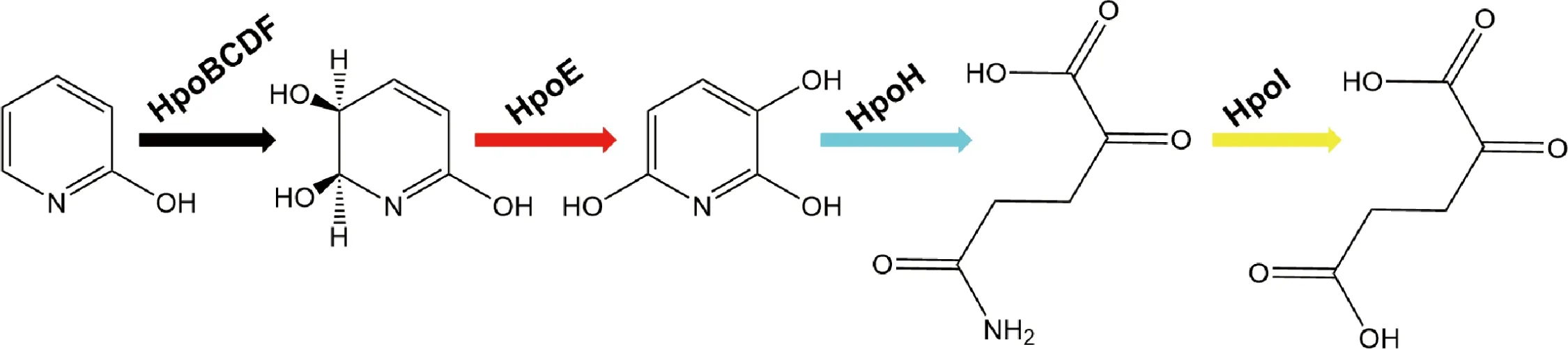
图5 菌株PY11中Hpo对2-羟基吡啶的分解作用[8]

图6 菌株DT-1分解2-HP过程中产生的蓝色物质
4 讨论与展望
2-HP是含N杂环类化合物的重要代表,也是长久以来存留于环境中的污染物。在各种去除污染的措施中,生物修复因其高效、安全、低成本、无二次污染等优点而具有良好的发展前景,而对2-HP分解微生物的研究将有助于对吡啶类化合物及其衍生物污染环境的修复。在自然环境中,微生物是2-HP分解的主要驱动力,这为我们筛选相关分解细菌提供了丰富的样本。目前已分离获得的2-HP分解细菌主要集中在Arthrobacter、Rhodococcus、Achromobacter、Burkholderia、Ochrobactrum等几个属[14-21],分解菌种属多样性不足,限制了生物修复研究的进一步发展。关于分解机制方面,马来酸途径、α-酮戊二酸途径等完整的代谢通路已被阐明,且相关的分解基因和酶也均被发现[8,30],但尚有多条途径的机制仍不明确。而且主要的研究仍局限于实验室条件下,处于理论阶段,尚无用于修复的相关分解菌剂和酶制剂等产品。
在前期的研究中,我们分离获得的菌株Cupriavidussp. DT-1, 具有良好的2-HP的分解性能[13],可在12 h内完全分解浓度为500 mg/L的2-HP,与前述各分解菌相比,该菌可分解的2-HP浓度较低,虽然分解速度快,菌株活性高,并有着较高的生长速率,在生产分解菌剂和复合酶制剂方面具有潜在的应用价值。且菌株在分解2-HP的过程中,发现有蓝色代谢产物的出现(图6),推测2,3,6-THP为中间代谢产物。目前已报道的形成蓝色的化合物的分解菌均为革兰氏阳性细菌,而DT-1是一株革兰氏阴性细菌,这就为2-HP的代谢机制研究提供了新的思路,同时也说明,除了上述几个属的细菌外,还有其他种属的细菌也具备2-羟基吡啶的分解能力。综合上述研究现状,今后一段时间内2-HP生物分解的研究可以在以下几个方面展开:1)利用宏基因组学、高通量测序等技术筛选环境中2-HP分解基因,建立分解基因种质资源库。2)综合分析2-HP在微生物体内迁移、转化及代谢的机理。3)深入开展分解酶基因的克隆、调控机制、酶活性强化等研究。4)选取优势菌株构建基因工程菌,增强菌株分解性能和环境适应性。5)优化发酵及分解酶纯化提取方法,研究分解菌制剂及复合酶制剂的生产工艺。6)研究原位微生物修复的影响因素、作用机制、工艺技术和相应的操作规程。
随着工业的进一步发展,将吡啶类化合物引入环境的源头和渠道还在扩展,这将导致其污染更加严重,也为我们的研究带来了新的挑战。虽然控制污染源头是解决问题的根本途径,然而对于已经污染的环境,开发新型高效的分解方法无疑是行之有效的措施。生物修复法凭借其自身的优势及潜力,将脱颖而出,成为吡啶类化合物污染环境修复的首选方法。

