茶多酚微胶囊/溶菌酶聚乙烯醇复合涂膜对美国红鱼鱼片的保鲜性能
张家涛,张 璇,魏旭青,李秋莹,李颖畅,谢 晶,孙 彤,*,励建荣,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,辽宁锦州 121013;2.生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;3.上海海洋大学食品学院,上海 201306)
近年来涂膜保鲜技术在果蔬、肉类和水产品保鲜中的应用多见报道[1-3]。可直接用于食品保鲜的成膜基质有明胶、壳聚糖(chitosan,Cs)、海藻酸盐、聚乙烯醇(polyvinyl alcohol,PVA)等。其中PVA具有优良的生物相容性、水溶性和可降解性。以PVA为成膜材料,制备具有抗菌、抗氧化性活性的包装薄膜已有报道[4-5]。为提高食品的贮藏品质,一般将生物保鲜剂与成膜基质(如Cs、PVA等)进行复合,所制备的复合涂膜能有效地防止食品腐败[6-8]。常见的生物保鲜剂有茶多酚(tea polyphenols,TP)、溶菌酶(lysozyme,LZM)、Cs等。LZM对细菌细胞壁有明显的破坏作用,但抑菌谱较窄,只对革兰氏阳性菌有抑菌活性[9-10]。王当丰等[11]将TP与LZM按一定比例复配,得到的复合保鲜剂能有效抑制白鲢鱼丸蛋白氧化和微生物繁殖,拓宽了LZM的抑菌谱。TP是从茶叶中提取的一类物质,TP对很多水产品有较好保鲜作用,同时其抑菌谱也较广[12]。但是TP极易被氧化,导致多酚结构的改变和生物活性的降低,进而缩短其保鲜时效[13]。
微胶囊化通常是指颗粒或液滴嵌入某一基质中,或者被涂层包围,从而获得微米或纳米级的小胶囊[14]。近年来,微胶囊控制释放的概念在食品添加剂领域已凸显其地位,因为它能提高食品添加剂的功效,减少使用量,并延长作用时效[15-16]。武伟等[17]以麦芽糊精为壁材,以肉桂醛为芯材,制备了具有缓释抑菌效果的肉桂醛微胶囊;申莉莉[18]利用Cs和海藻酸钠包埋百里香精油,有效地控制了百里香精油的挥发和释放,从而达到长效抑菌和抗氧化的目的。此外,徐永霞等[19]研究了丁香酚、明胶以及丁香酚-明胶涂膜对草鱼片-2 ℃贮藏过程中品质的影响,研究发现丁香酚-明胶复配涂膜处理后鱼片的货架期显著延长。可见,复合涂膜和微胶囊均可用于解决保鲜剂作用时效短的问题。
美国红鱼又名眼斑拟石首鱼(SciaenopsOcellatus),为鲈形目石首鱼科拟石首鱼属[20]。其蛋白含量高,脂肪含量低,肉质鲜美,符合现代人对膳食结构的需求,故受到广大消费者的喜爱。由于常需要制成冻品或鱼片,在贮藏过程中易造成微生物污染和蛋白质、脂肪氧化,因此采用新型长效保鲜材料尤为重要。
本文利用微胶囊和复合涂膜技术,在PVA涂膜内加入TP微胶囊和LZM,制备了TP微胶囊/LZM-PVA复合涂膜,通过分析不同涂膜处理后美国红鱼鱼片品质变化的影响,研究TP微胶囊/LZM-PVA复合涂膜对美国红鱼鱼片保鲜性能,旨在为提高水产品的贮藏品质提供技术支持和方法借鉴。
1 材料与方法
1.1 材料与仪器
鲜活美国红鱼 辽宁省锦州市水产市场,每条鱼重(600±15) g;Cs 脱乙酰度>95%,分子量范围是50万~100万,食品级,上海麦克林生化科技有限公司;TP 食品级,纯度>98%,安徽红星药业有限公司;溶菌酶(鸡蛋白源)、冻干粉(活力≥40000 U/mg) 美国Sigma-aldrich公司;其余试剂 均为分析纯;去离子水 自制。
CJJ79-1磁力加热搅拌器 鄄城威瑞科教仪器有限公司;LQ-C5001电子天平 上海瑶新电子科技有限公司;MLS-3030CH立式高压灭菌锅 日本三洋有限公司;Bagmixer 400W拍击式均质机 上海珂淮仪器有限公司;SW-CJ-2FD 超净工作台 苏景集团苏州安泰技术有限公司;RH-150生化培养箱 上海一恒科技有限公司;T25型数显型均质机 上海智理科仪有限公司;FE20 pH计 瑞士METTLER TOLEDO公司;UV-2550紫外可见分光光度计 日本岛津公司;cs 150 gx3超速离心机 日本日立公司;Keltec 8400全自动凯氏定氮仪 丹麦FOSS公司;TA-XT-Plus质构仪 英国Stable Micro Systems公司。
1.2 实验方法
1.2.1 TP微胶囊悬浮液的制备 以浓度1.0%冰乙酸(V/V)为溶剂,配制浓度为2.0%Cs冰乙酸(w/V)溶液。同时配制2.0% TP(w/V)水溶液。将上述两种溶液按体积比1∶1混合,搅拌均匀,224 W超声脱气30 min,备用。在磁力搅拌条件下,将等体积0.3%三聚磷酸钠(w/V)溶液逐滴加入至上述TP与Cs的混合溶液中,滴加完成后继续搅拌30 min,得TP微胶囊悬浮液。
1.2.2 TP微胶囊/LZM-PVA复合涂膜液的制备 在磁力搅拌条件下,将PVA溶于70 ℃去离子水中,配制浓度为10.0% PVA(w/V)溶液。将PVA溶液与1.2.1中得到的等体积的TP微胶囊悬浮液混合,并添加0.6% LZM(m/V)和0.3%甘油(V/V),在40 ℃条件下搅拌20 min,224 W超声脱气15 min,得TP微胶囊/LZM-PVA复合涂膜液。采用上述方法,不添加LZM,制备TP微胶囊-PVA复合涂膜液;采用1.0% TP(w/V)水溶液代替TP微胶囊悬浮液,制备TP/LZM-PVA复合涂膜液;采用1.0% TP(w/V)水溶液代替TP微胶囊悬浮液,不添加LZM,制备TP-PVA复合涂膜液;不添加TP、TP微胶囊和LZM,制备PVA涂膜液。
1.2.3 美国红鱼鱼片复合涂膜保鲜 将美国红鱼清洗干净,冰温淬死,去头、去皮、去内脏,取鱼刺骨两侧鱼片,每片重(150±5) g,用无菌水洗净,沥干体表。分别将鱼片浸渍于各涂膜液中,20 min后取出,自然风干后装于已灭菌的蒸煮袋内密封,4 ℃冷藏。以未涂膜处理的鱼片作为对照组,分别于第0、3、6、9、12和15 d测定各样品的鲜度指标。
1.2.4 美国红鱼鲜度指标测定 菌落总数的测定参照GB 4789.2-2016《食品微生物学检验菌落总数测定》[21],采用平板倾注计数法测定菌落总数。pH的测定参考Arashisar等[22]的方法稍作改动,取5.00 g绞碎鱼肉,加45.00 mL去离子水,用数显型均质机均质3 min,静置30 min后离心,取上清液,测定上清液的pH。TBA的测定参照杨丽丽等[23]的方法,测定并计算鱼片的硫代巴比妥酸值(TBA)值,结果以mg MDA/kg表示。鱼肉中挥发性盐基总氮(TVB-N)值的测定参考FOSS应用子报的方法[24],取10.00 g鱼肉,用凯氏定氮仪测定样品的挥发性盐基氮值,结果以mg N/100 g表示。由10名水产专业同学组成感官评定小组,参考雷志方等[25]的方法,从美国红鱼鱼片的外观、气味和肌肉色泽等三方面进行感官评分,其中9分为满分,6分为可接受限值。
质构的测定:取美国红鱼脊背部鱼片切成边长为1.5 cm的正方体,选用P/50R探头,用质构仪测定其质构指标。测定参数:测试速率1.0 mm/s;测量后探头回程速率1.0 mm/s;针入距离1 mm;触发力值5 g。
1.3 数据处理
实验数据均采用3次平行实验结果的平均值,结果以“平均值±标准偏差”表示,使用Origin 8.5软件绘图。
2 结果与分析
2.1 TP微胶囊/LZM-PVA复合涂膜对美国红鱼鱼片菌落总数(TVC)的影响
鱼肉腐败主要是由微生物生长繁殖造成的[26]。贮藏期间美国红鱼鱼片的菌落总数(TVC)变化如图1所示,鱼片的初始TVC为2.85 lg(CFU/g),属一级鲜度。随着贮藏时间的延长,鱼片的TVC上升,且未处理样品的TVC增长最快,涂膜处理后,鱼片的TVC上升速度较之下降。这是由于PVA具有良好的成膜性,包裹于鱼片表面后,阻隔了鱼片与外界空气的直接接触,减少了微生物侵袭,抑制了微生物的生长繁殖。国际微生物规格委员会(ICMSF)(1998)规定,新鲜鱼的标准限值为7.00 lg(CFU/g)[27]。未处理样品在贮藏的第8 d前后超过此限值,经PVA涂膜处理的鱼片大约在第9 d超过此限值,延长货架期1 d左右。在PVA涂膜中加入TP、TP微胶囊和LZM后,处理后鱼片在第12~13 d超过此标准限值,延长鱼片货架期4~5 d。在贮藏的前3 d,各种涂膜处理鱼片的TVC无明显差异。从第3 d开始,经含TP或TP微胶囊的PVA涂膜处理鱼片的TVC低于PVA涂膜处理的样品,说明TP具有优良的抗菌性能,这与前人[28-29]的研究结果一致。涂膜中继续加入LZM后,复合涂膜处理鱼片的TVC除第15 d外又有所降低,说明LZM也具有抗菌性能,使TP-PVA涂膜和TP微胶囊-PVA涂膜的抗菌性能增强。涂膜中采用TP微胶囊代替TP后,PVA复合涂膜处理后鱼片的TVC更低,其中TP微胶囊/LZM-PVA涂膜的处理效果最优。这是由于TP从微胶囊中缓慢释放到涂膜中,再从涂膜中释放后作用于鱼片表面,在贮藏第12~13 d,仍可在鱼片表面达到一定的浓度,控制鱼片内微生物的生长繁殖,起到了长效抗菌的作用。
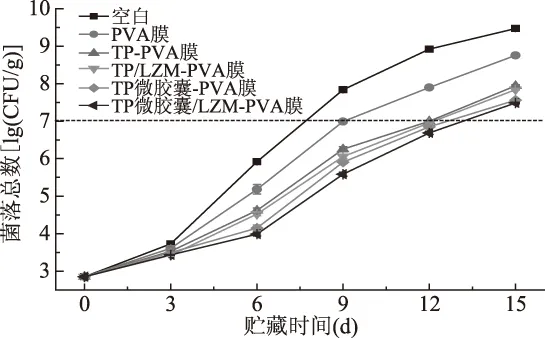
图1 贮藏过程中美国红鱼鱼片菌落总数变化
2.2 TP微胶囊/LZM-PVA复合涂膜对美国红鱼鱼片鲜度指标的影响
通常情况下,鱼死后体内糖原经无氧降解,生成乳酸等酸性物质,导致pH下降[30]。随着贮藏时间的延长,鱼体表面由于细菌的繁殖以及体内蛋白质、氨基酸等含氮物质分解产生碱性的氨类和胺类物质,使pH上升[31]。如图2a所示,在贮藏期间,鱼片的pH均呈先下降后上升的趋势,这符合鱼肉pH变化的一般规律[32]。未处理鱼片的pH在第3 d达到最小值,即6.72,PVA涂膜组、TP-PVA涂膜组、TP/LZM-PVA涂膜组、TP微胶囊-PVA涂膜组和TP微胶囊/LZM-PVA涂膜组的pH在第6 d达到最小值,分别为6.73、6.75、6.77、6.79和6.82。在贮藏的前3 d,未处理鱼片的pH下降速度最快,经单一PVA涂膜处理的鱼片次之,经含TP或其微胶囊的复合涂膜处理样品的pH下降较慢,且3个样品间无明显差异。此外,经含TP或TP微胶囊的复合涂膜处理样品的最低pH明显高于未处理鱼片。可能是PVA涂膜在鱼片表面形成了微气调环境,减弱了鱼片与周围环境的物质交换,抑制了鱼体内糖原的无氧降解,减少了乳酸等物质的生成。而涂膜中加入TP后,由于TP优良的抗菌性能抑制了鱼片内微生物的生长繁殖,进一步抑制了鱼体内糖原的无氧降解,故鱼片的pH下降减慢,这与田光娟等[33]的报道一致。在第3 d之后,鱼片的pH升高,说明此时鱼片中胺类等碱性物质已经生成,导致了鱼片的碱化。且经涂膜处理鱼片的pH显著低于未处理的鱼片。其中,经单一的PVA涂膜处理的鱼片pH上升最快,经添加TP或其微胶囊的复合涂膜处理的鱼片pH上升较慢。这是由于TP具有较好的抗菌性能,减少了细菌繁殖代谢产生的胺类等碱性物质的含量。涂膜中增加LZM后,所处理鱼片的pH上升速度降低,这可能是由于TP和LZM复合使抑菌谱拓宽,提高了复合涂膜的抗菌性能,使蛋白质等含氮物质分解速度降低,这与王当丰等[11]的研究结果一致。采用TP微胶囊取代涂膜中的TP后,经该涂膜处理的鱼片在贮藏后期的pH上升速度更慢,这是因为微胶囊包埋TP的缓慢释放起到了长效抗菌的作用,抑制了鱼片内的微生物繁殖,减弱了蛋白质等含氮物质的分解,与LZM复配后又起到了协同抗菌作用,最大程度地维持了鱼片pH的稳定。
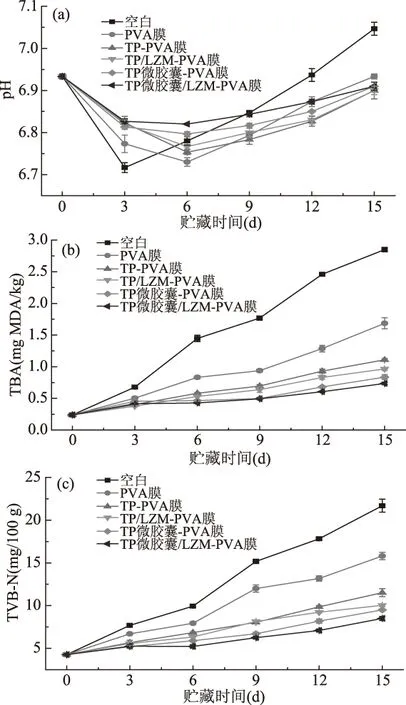
图2 贮藏过程中美国红鱼鱼片pH(a)、TBA(b)和TVB-N(c)的变化
不饱和脂肪酸被氧化后得到的降解产物是丙二醛,可与硫代巴比妥酸呈色,在波长为532 nm处进行比色测定,TBA值可以指示水产品和肉类的脂肪氧化酸败程度[34]。如图2b所示,随着贮藏时间的延长,鱼片的TBA呈上升趋势,且未处理鱼片的TBA增加最快。这是可能是因为涂膜处理使鱼片避免了与外界氧气的直接接触,形成了微气调环境,从而减缓了鱼片体内脂肪的氧化,使TBA增加变缓。经含TP或TP微胶囊的PVA复合涂膜处理鱼片的TBA均低于同期经PVA涂膜处理的样品,这可能是由于TP具有良好的抗氧化性,可优先与脂肪酸自由基结合,减少自由基的连锁反应,使其对脂肪氧化的抑制能力加强[13]。在第3 d之后,涂膜中施加LZM后,所处理鱼片的TBA增长速度较低,说明LZM的添加增强了涂膜对鱼片脂肪氧化的抑制作用。采用TP微胶囊取代涂膜中的TP后,在第12 d之后,经该涂膜处理的鱼片TBA更小,可能是由于TP从微胶囊中缓慢释放,起到了清除自由基的长效作用。
TVB-N的测定与在碱性介质中蒸馏的、与鱼制品变质有关的挥发性含氮化合物有关,可以用来反映水产品的新鲜程度,该值的变化也与腐败菌及内源酶活性有关[35]。TVB-N越低,说明鱼肉鲜度越高,反之,说明鱼肉腐败程度越高。美国红鱼鱼片在贮藏期间TVB-N的变化如图2c所示,随着贮藏时间的延长,鱼片的TVB-N上升,这是由于微生物的繁殖加快了蛋白质、氨基酸等物质的分解,进而增加了挥发性含氮化合物的含量。未处理鱼片的TVB-N上升速度最快,明显高于同期经涂膜处理的样品,这是由于涂膜处理可有效抑制微生物的生长,降低微生物对鱼体蛋白质的分解。经加入TP或其微胶囊的复合涂膜处理后,鱼片的TVB-N上升速度降低,这是由于TP能与鱼肉中蛋白质络合,使蛋白质结构保持稳定,不易被降解,并可以有效抑制微生物的生长,使鱼肉的酸性相对稳定,胺类物质的产生也得到了控制,这与刘焱等[36]的报道一致。从第3 d开始,经另加有LZM的复合涂膜处理后,由于LZM抗菌作用的发挥,鱼片的TVB-N也相对减小。经TP微胶囊/LZM-PVA涂膜处理鱼片的TVB-N最小,说明该涂膜的保鲜性能最优。分析认为,TP从微胶囊中缓释后,再经涂膜缓释,而后作用于鱼体表面,在贮藏后期仍能保持足够的抗菌浓度,达到了长效抗菌和抑制蛋白降解的目的,而LZM的施加拓宽了抑菌谱,起到了高效抗菌作用,故鱼片的TVB-N最低,这与TVC、pH和TBA的研究结果相似。
2.3 TP微胶囊/LZM-PVA复合涂膜对美国红鱼鱼片感官指标的影响
贮藏过程中美国红鱼鱼片感官评分的变化如图3所示。由图3可知,随着贮藏时间的延长,美国红鱼的感官评分逐渐下降。未处理的鱼片在第9.6 d左右达到可接受限值6分,鱼体肌肉变软无光泽,弹性差,并产生腐败性气味。与未处理鱼片相比,经涂膜处理的鱼片感官评分下降相对缓慢,经PVA-涂膜处理的样品在第11.6 d左右达到可接受限值,经TP-PVA涂膜和TP/LZM-PVA涂膜处理的样品在13.0 d左右和13.4 d左右达到可接受限值,而经含有TP微胶囊-PVA复合涂膜和TP微胶囊/LZM-PVA复合涂膜处理的样品在14.9 d左右和15.5 d左右才达到可接受限值。可见涂膜处理能明显延长美国红鱼鱼片的货架期,涂膜在鱼片表面形成致密的保护膜,阻碍了其与空气的直接接触,且具有调节气体通透性的作用,延缓了鱼片的腐败。在涂膜中加入TP后,涂膜的抑菌性能增强,可抑制鱼片表面微生物的生长、脂肪的氧化和蛋白质的降解,延缓鱼肉的腐烂,减少腐败气味的产生。涂膜中加入LZM后,使鱼片的感官指标下降速度略有减缓,这是由于LZM增强了复合涂膜的抗菌性能,并在一定程度上减少了鱼片鲜度指标的下降。采用TP微胶囊取代涂膜中的TP后,经该涂膜处理的鱼片的感官评分下降最缓慢,在贮藏大约4 d后,差异更为显著。这是因为含TP微胶囊的复合涂膜具有长效抗菌的性能,TP能够在鱼片表面长期维持抗菌浓度,在贮藏13 d后,保鲜效果更好,可显著(P<0.05)延长鱼片的货架期。
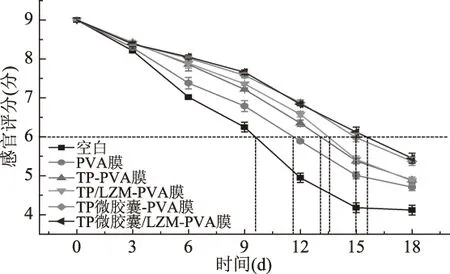
图3 贮藏过程中美国红鱼鱼片感官评分的变化
2.4 TP微胶囊/LZM-PVA复合涂膜对美国红鱼鱼片质构指标的影响
美国红鱼鱼片在贮藏过程中质构指标的变化如图4所示,包括硬度、弹性、咀嚼度和回复性。硬度是反映食品可保持原有形状的内结合力[37],弹性能够反映食品在外力作用下变形及去应力后的恢复程度[38],咀嚼度表示的是嚼劲,回复性是反映鱼肉在受压状态下快速恢复变形的能力[39],回复性、咀嚼性是弹性的综合表现。由图4可知,随着贮藏时间的延长,各项指标均呈下降趋势,这是由于鱼肉在内源酶和微生物的作用下,蛋白质发生降解,且肌肉之间结合力降低,导致肌肉变软和汁液的流失。如图4a所示,随着贮藏时间延长,鱼片的硬度持续下降,未处理鱼片的硬度始终低于同期经涂膜处理的样品,而经PVA复合涂膜处理的样品硬度高于经单一PVA涂膜处理的鱼片,其中经TP微胶囊/LZM-PVA涂膜处理的样品硬度下降最小。经涂膜处理后,鱼片表面形成了一层致密的保鲜涂膜,阻止外界环境与鱼片内部的物质交换,抑制鱼片表面微生物的生长繁殖,减缓鱼肉中的糖原降解、蛋白质和脂肪分解,使蛋白质空间结构遭受破坏的程度降低,则鱼片硬度下降速度减慢[40]。而复合涂膜中加入保鲜剂后,抗菌、抗氧化性能增强,减缓了鱼肉鲜度指标的变化。在TP微胶囊/LZM-PVA涂膜中,TP微胶囊均匀分散于PVA涂膜中,可与涂膜基质PVA形成氢键,相互之间的结合更为紧密,使涂膜内部微结构得到改善,力学性能增强,且微胶囊中TP在微胶囊和涂膜中逐级释放到鱼片表面,起到了长效抗菌的作用,故该涂膜的保鲜性能最优。
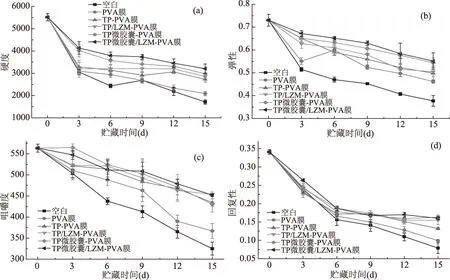
图4 贮藏过程中美国红鱼鱼片质构变化
如图4b所示,鱼片弹性的变化趋势与硬度一致。随着贮藏时间的延长,鱼片的弹性持续下降,这是由于pH的变化导致蛋白质空间结构遭到破坏,且微生物的繁殖使鱼片肌球蛋白含量降低,导致结合水的能力降低,弹性下降。涂膜处理后,鱼片内的微生物生长速度降低,减缓了结合水能力的降低,故鱼片弹性指标下降缓慢。涂膜中添加保鲜剂后,减少了肌球蛋白和肌动蛋白的结合,延缓了肌肉收缩,使肌肉间的结合力较大,进而维持了良好的弹性。由图4c、图4d可以看出,随着贮藏时间的延长,咀嚼度和回复性都呈持续下降的趋势。在贮藏第6 d之后,未处理鱼片的值始终低于经涂膜处理的鱼片,经含TP或TP微胶囊复合涂膜处理鱼片的咀嚼度和回复性始终低于单一PVA涂膜处理鱼片。在贮藏12 d后,经TP微胶囊/LZM-PVA复合涂膜处理的样品下降最慢,能维持较好的咀嚼度和回复性,这是涂膜中的抗菌、抗氧化成分抑制鱼片硬度降低和弹性减小的综合作用造成的。
3 结论
含TP或TP微胶囊的PVA复合涂膜处理可有效抑制美国红鱼鱼片TVC的增长,进而降低pH的变化幅度,延缓脂肪的氧化和蛋白质的降解,维持鱼肉较好的品质,有效保持了鱼片的鲜度,延长了产品的货架期。在含有TP微胶囊的复合涂膜中,TP从微胶囊到涂膜,再到鱼体表面的缓慢释放,使其在贮藏后期仍具有更优的保鲜性能。涂膜中添加LZM后,抑菌谱拓宽,增强了TP的抗菌性能,故TP微胶囊/LZM-PVA复合涂膜的保鲜性能更优。构建“微胶囊-涂膜”逐级缓释体系可以有效提高生物保鲜剂的长效保鲜性能,LZM和TP复配使用可有效拓宽抑菌谱,具有协同增效作用。

