锂资源提取与回收及锂制备工艺研究现状
王冬斌,梁精龙,邓孝纯,王 晶
(华北理工大学冶金与能源学院,现代冶金技术教育部重点实验室,河北唐山063210)
锂为银白色金属,有良好的导电性,在空气中易氧化,在高容量电池、核聚变反应堆等领域均有广泛的应用,被誉为21 世纪的能源金属[1-4]。锂资源在自然界中有两种富存形式:以碳酸锂(Li2CO3)形式存在于锂辉石、锂云母中;以离子态(Li+)存在于盐湖卤水和海水中。 矿石提锂主要应用于高质量的电池级碳酸锂的制备; 海水或卤水提锂主要应用于工业级碳酸锂的制备。近年来,锂电池由于其自身的优异性能而得到广泛使用,随着大量锂电池退役,其正极材料如LiCoO2、LiMn2O4等含锂废弃物随之产生,而且电池正极材料中锂的含量远高于盐湖卤水, 实现含锂的固体废弃物回收成为当下的研究热点之一。因此,研究锂的资源化提取、回收工艺及其发展方向具有重要的意义[5]。
1 锂资源的提取与回收
1.1 盐湖卤水锂资源的提取
卤水提锂是工业生产碳酸锂的主要方式, 其工艺流程简单、成本低廉,但是盐湖卤水中杂质较多、锂浓度较低,特别是镁锂比较高,严重制约了锂的开采效率。 卤水锂资源提取主要有沉淀法、吸附法、萃取法等,其中以沉淀法和萃取法应用最为广泛。
1)沉淀法。 沉淀法是将卤水中的锂离子(Li+)富集到一定的浓度,除去Mg2+、Ca2+等杂质,最后加入沉淀剂提锂的方法。 由于沉淀剂不同,沉淀法提锂可分为碳酸盐沉淀法和铝酸盐沉淀法。 目前工业沉锂使用的是碳酸盐沉淀法。
碳酸盐沉淀法是目前工业化最为成熟的方法,是将工业卤水蒸发后得到锂离子浓度较高的浓缩液,此时杂质Mg2+的浓度也随之增大。 向浓缩液中加入碳酸钠,Mg2+先与CO32-反应生成碳酸镁沉淀,过量的碳酸钠才会与锂离子反应生成碳酸锂(Li2CO3)沉淀。 这种方法主要适用于低镁锂比的卤水,当镁锂比较高时会造成大量碳酸钠浪费。
铝酸盐沉淀法主要原理是利用铝酸盐制备氢氧化铝[Al(OH)3],并将氢氧化铝加入溶液中生成LiCl·2Al(OH)3·nH2O 沉淀,沉淀物经焙烧、浸出、除杂得到LiCl,随后加入碳酸钠制备碳酸锂。该方法利用氢氧化铝对氯化锂的高选择性实现高效的镁锂分离,可制得较高纯度的碳酸锂。 但是,该工艺过程较为繁琐,能耗较高,工业化程度较低。
徐徽等[6]对高镁锂比卤水的镁锂分离进行了研究。 其采用氨和碳酸氢铵进行二段沉镁,生成氢氧化镁和碱式碳酸镁沉淀分离,滤液浓缩结晶析出氯化铵后,再用氢氧化钠进行深度除镁,很好地实现了镁锂分离。 研究结果表明,母液中的镁离子可完全被分离,为后续制备碳酸锂打下良好的基础。 熊攀等[7]使用磷酸盐沉淀法对卤水中的镁锂进行分离。 其以磷酸氢二钠作为沉淀剂,与镁离子生成磷酸氢镁(MgHPO4)沉淀。使用Na2HPO3饱和溶液代替固体方式进料,在Na2HPO4过量1 倍、反应温度为40 ℃、反应时间为30 min、陈化时间为3 h 条件下,镁的脱除率高达99%,锂的损失率小于1%。
现阶段对于高镁锂比卤水镁锂分离的研究更倾向于使用沉淀剂分离镁离子,并最大程度地保留原液中的Li+,有较高的应用价值,可以实现卤水资源的综合利用。
2)萃取法。 萃取法主要是依靠离子在互不相溶的两种液体中溶解度的不同从而达到分离的效果,而且在萃取剂中溶解度更高。 对于高镁锂比卤水,可将Li+提取至萃取剂中,实现锂、镁分离。通常锂萃取剂的研究主要以磷酸三丁酯(TBP)居多,并通过搭配分散剂、稀释剂等实现更高效的萃取。
侯翰林[8]利用咪唑类离子液体1-丁基-咪唑六氟磷酸盐作为萃取介质,磷酸三丁酯为萃取剂、二氯乙烷为稀释剂配制有机相, 研究了不同镁锂质量浓度比(40∶1、70∶1、130∶1)条件下温度、相比、离子液体浓度对萃取锂的影响。研究结果表明:在镁锂质量浓度比为40∶1 的溶液中,最优萃取条件为25 ℃、相比(VO/VA)为1.5、有机相离子液体质量分数为15%;在镁锂质量浓度比为70∶1 和130∶1 的溶液中, 最优萃取条件均为25 ℃、相比为2、有机相离子液体质量分数为5%。在最优萃取条件下,锂萃取率达到94.51%。
张永兴等[9]使用分析纯的磷酸三丁酯(TBP)、磺化煤油、盐酸、氯化铁配制萃取剂,以负载有机相与盐酸溶液进行反萃取,实现卤水中的镁锂分离。通过对萃取剂浓度、料液酸度、萃取相比、Fe3+与Li+物质的量比等进行单因素实验,得到最优条件为:TBP 体积分数为30%、萃取相比为2、Fe3+与Li+物质的量比为1.8、H+浓度为0.1 mol/L、萃取时间为10 min,在此条件下锂的单级萃取率达到75%以上。 反萃取工艺最优条件为: 反萃取相比为5、HCl 浓度为3 mol/L,在此条件下锂的单级反萃取率达到51%,多级反萃取可实现锂的高效反萃取。
萃取法可以实现Li+的高效提取与分离,但是由于萃取法流程过于繁琐、萃取剂成本较高,而且萃取剂损耗过大以及萃取剂对设备腐蚀较为严重等原因,萃取法仍处于实验室研究阶段,未来萃取剂的选取以及工艺流程的优化、 工业化生产仍是主要研究方向,以实现低成本、高附加值、低能耗生产。
1.2 废旧锂电池中锂资源的回收
废弃正极材料中锂离子的含量远高于天然盐湖中的锂含量,有较高的回收价值,而且电池正极材料含有的钴、镍、锰等有价金属也有较高的回收价值。锂电池回收过程中较多研究人员注重钴、 镍等金属的回收,忽视锂的提取与回收。锂电池正极材料中金属的回收主要使用酸洗-浸取法, 使固态的正极材料如LiCoO2、LiMn2O4中的金属元素以离子态富存于溶液中,随后经过萃取、沉淀等方法逐一分离。
1)酸洗-浸出法。 施丽华[10]对废旧三元正极材料的回收进行了研究。 将拆解分离后的废电池正极材料置入H2SO4-Na2SO3混合液中, 在一定条件下得到 含 有Ni、Co、Mn、Li、Fe 等 多 种 金 属 元 素 的 浸 出液,调节pH 至4.5,浸出液中的铁和铝水解生成沉淀分离。 将滤液pH 调节至11 左右,浓缩后加入Na2CO3制备工业级Li2CO3。 在混合物中加入氨水将锰和镍钴分离,得到氢氧化锰。 有机溶剂P507 与溶剂油按照体积比为1∶3 混合,用于分离镍和钴,使用草酸铵收集返萃后的钴; 用氢氧化钠溶液沉积萃取液中的硫酸镍,生成氢氧化镍沉淀。整个工艺流程中钴回收率为91.82%、镍回收率为91.21%、锂回收率为90.53%、锰回收率为91.08%。 整个工艺流程较为完善,同时对镍、钴、锰、锂4 种主要有价金属进行了回收,且均具有较高的回收效率。
Peng 等[11]采用还原性硫酸回收工艺对正极材料有价金属进行回收,还原剂抗坏血酸(C6H8O6)的加入对钴、锂的浸出有促进作用,同时抑制铜的浸出。对比了还原剂用量、时间、温度等的影响,得到最佳浸出条件:80 ℃,在硫酸体系(2 mol/L )中浸出90 min,在浸出开始时加入C6H8O6(0.11 mol/L)。通过该选择性浸出工艺, 实现了金属Li 的浸出率为95.7%、Co 的浸出率为93.8%、铜的浸出率仅为0.7%。
Sattar 等[12]重 点 研 究 了 酸 浓 度、H2O2用 量、时间、温度、矿浆浓度对浸出金属的影响。 确定了最佳工艺参数:H2SO4浓度为2 mol/L、H2O2体积分数为4%、矿浆固相质量分数为5%、50 ℃、120 min。 在此条件下,98%以上的金属均被浸出。 使用KMnO4沉淀锰离子, 分离得到MnO2。 随后加入丁二酮肟(DMG,C4H8N2O2)选择性提取镍,在pH 为5、DMG与Ni 物质的量比为2∶1 时可沉淀出99%以上的镍。随后使用0.64 mol/L(50%皂化)的Cyanex 272 萃取回收钴,在平衡pH 为5.0、相比为1∶1 条件下,可以实现定量提取。 最后,剩余溶液经浓缩,并调节pH为12,加入碳酸钠,可得到碳酸锂沉淀。 该方法能够针对不同金属逐一提取, 但是过程中药剂消耗量较大,工业化较为困难。
Roshanfar 等[13]选择了两种无污染的有机酸(葡萄糖酸和乳酸)作为浸提剂,从锂离子电池材料中浸出锂和钴。实验结果表明,葡萄糖酸对锂的回收率约为89%、对钴的回收率约为87%;乳酸对锂的回收率约为97%、对钴的回收率约为97%;乳酸中过氧化氢体积分数提高至5%, 锂的回收率可从约82%提高到约97%、 钴的回收率从约83%提高到约98%;在乳酸环境中,温度从40 ℃升高至80 ℃,锂的回收率从约89%提高到约97%、 钴的回收率从65.5%提高到约97%。 在最佳条件下(温度为79 ℃,酸浓度为1.52 mol/L、固液比为16.3 g/L、过氧化氢体积分数为4.84%、以乳酸为浸提剂、2 h 浸提时间),锂和钴的回收率分别为100%和97.36%。 该方法回收率较高,浸出剂无污染,能够同时实现对钴酸锂中锂、钴的回收,研究价值较大,工业化生产较为方便。
Sun 等[14]使用DL-苹果酸浸出废旧锂离子电池中的有价金属。 电池拆解后将阴极置入90 ℃的N-甲基吡咯烷酮(NMP)溶剂中浸泡1.5 h,随后分离活性材料,阴极材料在700 ℃煅烧2 h 去除石墨,随后将活性材料球磨成细小的颗粒。 通过单因素实验对比了酸浓度、固液比、反应时间、还原剂用量(H2O2)和温度的作用, 确定最佳浸出条件为DL-苹果酸浓度为1.2 mol/L、固液比为40 g/L 、80 ℃、H2O2体积分数为1.5%、30 min。在此条件下,Li 浸出率为98.9%、Co 浸出率为94.3%、Ni 浸出率为95.1%、Mn 浸出率为96.4%。 该方法能够将有价金属全部浸出至DL-苹果酸中,并以离子形式存在,但是仍需要更多其他分离步骤才能实现4 种有价金属的完全分离。
Li 等[15]从LiFePO4中提取金属。将回收的LiFePO4加入助磨剂柠檬酸和H2O2进行共磨,在球粉质量比为25、柠檬酸与LiFePO4质量比为20、还原剂H2O2用量为1.0 mL、搅拌转速为300 r/min、时间为2 h 条件下,Li 萃取率为99.35%、Fe 萃取率为3.86%,展示出较好的Li+选择回收特性。使用去离子水代替H2O2共磨时,在球粉质量比为45、柠檬酸与LiFePO4质量比为20、搅拌转速为300 r/min、时间为2 h 条件下,Li 萃取率为97.82%、铁萃取率为95.62%。 调节pH 至11~12,溶液中铁沉淀分离,在95 ℃的滤液中加入饱和碳酸钠回收Li2CO3。 该回收方法简洁高效,可选择回收锂离子或锂、铁共回收,且回收后无环境污染,工业化较为方便。
Chen 等[16]使用磷酸回收废旧电池正极材料中的锂资源。 反应之前使用适量草酸分离锰、镍离子,避免引入杂质。在最佳条件下进行浸取实验,钴酸锂电池中锂的浸出率为100%, 锰酸锂电池中锂的浸出率为92.86%, 磷酸铁锂电池中锂的浸出率为97.57%,三元电池中锂的浸出率为98.94%。 最终制得的磷酸锂(Li3PO4)纯度达到98.4%。该方法实现了从不同阴极材料中提取锂,对环境污染较小,产生废物排放少。
2)其他方法。 赵天瑜等[17]重点研究了废旧三元锂离子电池中锂资源的回收, 通过借鉴卤水提锂的方式,提出使用萃取法优先提取Li+。 在磷酸三丁酯(TBP)中加入稀释剂磺化煤油,与FeCl3-NaCl 酸性溶液混合,萃取出锂离子。最终锂的单级萃取率达到75%,4 级逆流萃取锂的萃取率达到99%。 此外,钴、镍、锰3 种金属离子在溶液中损失较低,几乎没有被萃取。该工艺最大程度地回收了锂离子,并且尽量减少其他有价金属的损失, 效果显著。 为防止Fe3+水解,在实验过程中加入了适量盐酸。 此外,为保证Fe3+不发生脱落引入杂质, 需要保证Cl-在溶液中的浓度。 以上两点为提取过程增加了难度。
Xiao 等[18]针对锰酸锂废旧电池正极材料进行了研究。将废旧电池机械分离后,将正极材料与石墨粉混合物在800 ℃真空条件下焙烧45 min,可转化为碳酸锂和氧化锰,水浸回收碳酸锂,锂的回收率达到91.3%。最后过滤残渣,并在空气中将剩余石墨燃烧,可回收得到纯度为95.11%的四氧化三锰。
酸浸法可以有效地使正极材料中的有价金属离子进入溶液中,有利于后续沉淀、分离等操作。 酸浸法需要耗费大量的酸,一定程度上会造成环境污染,使用对环境污染较小的有机酸浸出有较大的研究前景。有机酸浸出较慢,适当的催化剂及反应条件需要进一步优化。混合石墨粉焙烧法对环境污染较小,有较大的应用前景,但是反应条件要求较高,制约其工业化发展。 目前锂离子电池正极材料中有价金属的回收仍处于实验室研究阶段,尚未完全实现工业化,主要原因是正极材料通常含有2 种及以上的金属离子,回收过程较为繁琐。随着废旧锂离子电池的不断增加, 正极材料中有价金属的回收及其工业化仍会是研究的热点。
2 锂单质的冶炼工艺
2.1 熔盐法
熔盐电解法是以氯化锂为原料,制备纯金属锂。将氯化锂加热至熔融状态,以高纯石墨为阳极、低碳钢为阴极,并使用钢制薄膜将阴极和阳极分开。在一定电压条件下,金属阳离子(Li+)向阴极移动并得到电子,被还原为金属锂,由于密度低,浮至熔盐表层。而氯离子向阳极移动, 在石墨表面失去电子氧化为氯气,并向外挥发溢出。 锂进入专用收集室,氯气上升至出气口排除或收集。 在电解过程中需不断供电维持电解, 同时不断供能保证熔盐体系处于稳定的温度。可以通过在氯化锂中加入氯化钾来降低熔点,从而降低能耗, 通过电压控制可以只将氯化锂电解而不产生钾。该方法在电解过程中产生氯气,若不恰当处理会造成污染,同时产品质量不易控制。由于锂金属活动性最强,电解还原需要较大的电压,导致耗能较大,成本较高。
2.2 真空热还原法
真空热还原法主要是以工业碳酸锂为原料,配入氧化钙及金属还原剂,在高温、真空条件下制备金属锂单质。其中以硅热还原法、铝热还原法和铁热还原法为主, 反应过程中需要加热至800 ℃以上,使Li2CO3分解为Li2O;保持真空条件的基础上,按一定配比加入氧化钙和还原性金属单质如硅、铁、铝等。 反应温度、反应时间、真空度、物料粒度、还原性金属配比及加入量均对锂元素的还原效率有直接的影响。
1)硅热还原法。 硅热还原法还原机理:
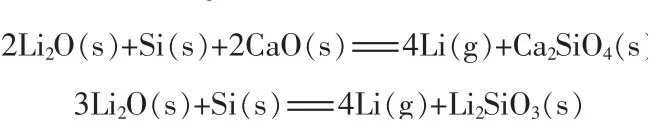
谢苏云等[19]以工业Li2CO3、分析纯CaO 和75#硅铁为原料制备金属锂。取270 g 工业Li2CO3与81 g 75#硅铁充分混匀加入石墨坩埚,加入206 g CaO,真空度为15 Pa、时间为120 min。 1 000 ℃条件下锂的还原率为92.02%,1 100 ℃条件下锂的还原率为99.17%。
2)铝热还原法。 铝热还原法还原机理:
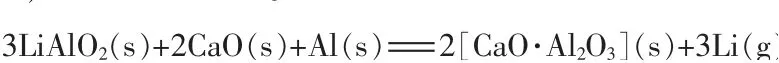
狄跃忠等[20]将Li2CO3、Al2O3、CaO 以物质的量比为3∶3∶4 混匀后压制成直径为25 mm 的球团, 煅烧得到LiAlO2熟料,研磨后与一定量的铝粉混匀迅速压制成直径为25 mm 的球团,在制团压力为45 MPa、物料粒度为75 μm、铝粉过量20%、还原温度为1 150 ℃条件下反应180 min 得到金属锂,还原率为95.50%,铝粉利用率为79.17%。 李继东等[21]以Li2O为原料、铝粉为还原剂,还原制备金属锂,通过正交实验确定最佳工艺条件为1 170 ℃、180 min、 还原剂过量15%、粒度为150 μm。在该条件下,金属锂的还原率高达92.20%。
3)铁热还原法。 铁热还原法还原机理:
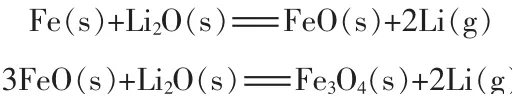
樊粉霞[22]将一定质量比的碳酸锂和铁粉混匀压制成团,干燥后保持真空度为5 Pa 以下,在700 ℃煅烧使碳酸锂分解,随后在1 200~1 300 ℃恒温60~80 min, 在真空条件下冷却至室温, 即可得到金属锂。 升高温度、延长保温时间均可提高锂的还原率。最佳工艺条件: 还原温度为1 300 ℃, 反应时间为150 min,还原剂过量10%,制团压力为10 MPa。
硅热还原法在加入氧化钙后提取效率较高,提取效率的主要影响因素是温度条件与还原时间。 通过对比发现,温度升高可以提高锂的还原率。铝热还原法受物料配比的影响程度较大, 特别是还原剂铝粉,铝粉加入量不足时反应不充分,直接影响锂的还原效率及提取率, 当铝粉过量时也会降低锂的还原率,因此真空铝热还原法在控制反应时间、反应温度条件的基础上还要精确调节物料配比,以实现锂的最大化提取。在真空热还原法中,反应真空箱压力对分解反应产生较大的影响, 当真空压力较低时需要提高反应温度才能使分解反应发生。 真空热还原法制备金属锂单质仍需要进一步优化控制反应条件,选取最优方案,以适应大规模工业化制备金属锂单质。
3 结语
锂是工业应用较多的金属。 现阶段锂的提取主要是卤水中锂的富集与提取, 因镁锂比较高而受到制约, 因此卤水提锂的主要研究方向仍然是在高镁锂比条件下实现锂镁分离。此外,吸附法或制备选择性离子筛对Li+的单一回收有较高的效率,但是离子筛吸附法在工业化过程中仍有较大的局限性。 目前废旧锂电池回收锂是研究的热点, 国内外众多学者尝试用浸取法、沉淀法、吸附法等回收废旧锂电池中的锂及其他金属资源, 在浸出过程中应更倾向于无污染回收,如使用有机酸代替硫酸、盐酸等强酸以减少环境污染, 同时锂电池回收的工业化应用也是未来的研究热点。 工业上金属锂的制备主要是电解熔融氯化锂, 而真空热还原是最有可能代替熔融电解制备锂的方法,研究前景较为广阔。

